白酒糟纤维素降解菌的优选及酒糟降解工艺
2020-08-12杨第芹曹文涛王晓丹
阳 刚,杨第芹,曹文涛,2,王晓丹
白酒糟纤维素降解菌的优选及酒糟降解工艺
阳 刚1,杨第芹1,曹文涛1,2※,王晓丹1
(1. 贵州大学酿酒与食品工程学院,贵阳 550025;2. 贵州省发酵工程与生物制药重点实验室,贵阳 550025)
白酒酿造行业产生的酒糟含有大量纤维素,不仅原料利用率低,而且丢弃的酒糟会对环境产生污染。为了获得酒糟纤维素降解能力强的微生物并进行应用,从酱香型酒醅、清香型酒醅、浓香型大曲、竹林里的土壤腐殖质中分离筛选酒糟纤维素降解菌,并对菌种分类、理化特征和降解酒糟的特性进行研究。pH值、温度和酒精胁迫性试验进一步确定了最佳酒糟纤维素降解菌为B2菌株,该菌株在pH值3.0、温度44 ℃、酒精含量为体积分数4%环境中生长良好。基于形态学、生理生化和分子生物学分析,鉴定B2菌株为枯草芽孢杆菌()。在单因素试验结果的基础上,采用Box-Benhnken响应面法进行优化,确定了B2菌株降解酒糟的最佳工艺条件为酒糟添加量71 g/L、温度37 ℃、pH值6.4、接种量8%,此时酒糟降解率为15.23%。该研究丰富了酒糟纤维素降解菌的微生物资源库,同时为酒糟的资源化利用提供技术参考。
纤维素;降解;废弃物;白酒糟;纤维素酶;枯草芽孢杆菌;筛选;酒糟处理
0 引 言
白酒糟是粮谷物和糠壳等混合物经固态发酵、蒸馏制得白酒后的副产物,并富含纤维素、蛋白质等有机物[1]。中国每年能产生3 000万t左右的白酒糟[2-4],由于缺乏有效的处理方法,不仅造成了酒糟浪费,而且丢弃的酒糟会对环境产生污染[5-6]。目前,对白酒糟进行资源化利用的主要方式是动物饲料原料,但是对酒糟进行脱毒等处理会使成本增加,也没有直接证据表明酒糟饲料具有良好品质。此外中国白酒酿造基地分布广,也有很多是小作坊,对酒糟实现集中收集和处理尚存在难度。因此,开发酒糟处理方式,实现酒糟就地处理,提高经济和环境效益,显得十分重要。
白酒糟的纤维素含量占白酒糟干质量的20%左右[1,7],酒糟中纤维素的降解成为了酒糟资源化利用的关键一步。纤维素是多个葡萄糖分子通过-1,4-糖苷键连接而成的一种多糖,广泛存在植物中[8-9]。而纤维素酶是一种包括内切葡聚糖酶(Endoglucanase)、外切葡聚糖酶(Exoglucanase)、-葡萄糖苷酶(-glucosidase)的复合酶,它可以将纤维素水解成葡萄糖供酵母菌等微生物利用。实际上微生物纤维素酶在造纸、纺织、生物燃料、食品与饲料工业、农业等行业都有潜在的应用前景[10]。然而,长期以来,缺乏纤维素酶高产菌株是纤维素酶大规模工业化生产和应用的瓶颈[11]。
目前,各国研究者已经从温泉[12]、牛粪[13]、土壤[14]、腐烂木材[15]等筛选产纤维素酶菌,结果表明产纤维素酶菌有细菌中的芽孢杆菌、热杆菌、热酸菌、纤维弧菌等,真菌中的木霉、黑曲霉、青霉等,放线菌中的小单孢菌、链霉菌等,古菌中的嗜热菌等[10,16]。有学者从酒醅[17-18]、大曲[19]、白酒糟[20]中筛选产纤维素酶菌,但纤维素酶活不高。考虑到酒醅和大曲中的微生物,尤其是酱香型白酒中的,是经过了高温、高酸、高浓度酒精等因素胁迫,从中筛选到优良菌株具有潜力,然而酱香型白酒作为重要的产纤维素酶菌生物资源库,却没有相关研究报道。关于微生物降解白酒糟的研究,其中兰小艳等[21]利用白腐菌使酒糟中的纤维素降解率达到了9.5%,从而提高酒糟的利用价值;何颂捷等[22]从酒醅和泥窖中筛选到一株羧甲基纤维素钠酶活为49.31 U/mL的贝莱斯芽孢杆菌,经固态发酵酒糟的降解率为22.1%,虽然指出该菌株存在潜在应用价值,但是并没有报道该菌株对环境的耐受性以及温度、pH值等因素对降解酒糟的影响,尚不足指导菌株的实际应用。总体来看,目前研究集中在产纤维素酶菌筛选、鉴定与特性研究,对所筛选菌进行白酒糟降解应用研究较少,尚未有白酒糟降解工艺研究报道。
本研究结合刚果红染色与酶活力复筛试验,从酒醅、大曲和土壤中分离筛选产纤维素酶菌,结合菌株鉴定结果和胁迫性试验,最终确定酒糟降解微生物。在单因素试验基础上,采用响应面法评价了酒糟降解处理条件,旨在获得优良菌株,为酒糟的无害化处理和资源化利用提供技术参考。
1 材料与方法
1.1 样品来源
酱香型酒醅、清香型酒醅、浓香型大曲分别于2019年3月从贵州省某酒厂、重庆某酒厂、四川某酒厂采集,土壤采集于贵阳市十里河滩风景区的小竹林。
1.2 培养基
1)富集培养基:CMC-Na 10.0 g,蛋白胨1.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO47H2O 0.5 g,蒸馏水1 000 mL,pH值 6.8。
2)分离培养基:CMC-Na 10.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO47H2O 0.5 g,琼脂20.0 g,蒸馏水1 000 mL,pH值6.8。
3)纯化培养基:CMC-Na 10.0 g,NaCl 5.0 g,CaCl20.1 g,KH2PO41.0 g,(NH4)2SO42.0 g,MgSO47H2O 0.5 g,蛋白胨3.0 g,酵母浸粉3.0 g,琼脂20.0 g,蒸馏水1 000 mL,pH值6.8。
4)液体生长培养基:纯化培养基不添加琼脂。
5)滤纸条液体培养基:(NH4)2SO41.0 g,MgSO47H2O 0.5 g,KH2PO41.0 g,酵母膏0.1 g,蒸馏水1 000 mL,另外在培养基中加入滤纸条(1 cm × 6 cm),每个三角瓶放3条。
6)产酶培养基:CMC-Na10.0 g,蛋白胨3.0 g,酵母膏0.2 g,(NH4)2SO44.0 g,KH2PO44.0 g,MgSO47H2O 0.3 g,蒸馏水1 000 mL,pH值 6.8。
7)酒糟降解培养基:将产酶培养基的CMC-Na换为酒糟。
以上培养基均采用湿热灭菌方式,121 ℃,20 min。
1.3 主要试剂与仪器
羧甲基纤维素钠(CMC-Na)、微晶纤维素、水杨苷、刚果红均来自上海源叶生物公司;DNA提取试剂盒、琼脂糖及引物,北京擎科生物技术公司;UV754N分光光度计,上海仪电公司;离心机,上海菲恰尔公司;恒温水浴锅,巩义予华仪器公司;PCR仪,美国ABI公司;电泳仪,北京六一仪器厂;凝胶成像仪,上海培清科技公司。
1.4 方法
1.4.1 分离与纯化
1)样品预处理
分别称取10.0 g样品于装有玻璃珠的100.0 mL无菌水中,摇床振荡(150 r/min)30 min以获得菌悬液。
2)富集培养
取5.0 mL菌悬液的上清液于盛有95.0 mL富集培养基的三角瓶中,摇床(28 ℃、150 r/min)培养48 h以获得富集培养液。
3)稀释涂布
用无菌水进行10倍梯度稀释富集液,分别取100L的10-3~10-7稀释度的菌液涂布于分离培养基上,每个浓度重复3次,28 ℃培养5 d。
4)纯化与保藏
从涂布平板上挑取单个菌落在纯化培养基上进行平板划线,并把纯化好的菌株置于4 ℃冰箱进行斜面保藏。
1.4.2 定性初筛
1)水解圈试验(刚果红染色试验)
将纯化过的菌株点种在CMC-Na分离培养基上,28 ℃培养5 d。菌株培养结束后,将8~10 mL的1 g/L的刚果红溶液从培养皿边缘缓慢倒入,轻轻摇动以使刚果红溶液覆盖整个平板,静置30 min后,倒掉培养皿中液体,用4~5 mL的1 mol/L的NaCl溶液润洗平板一次,然后向培养皿加入8~10 mL的1 mol/L的NaCl溶液,静置“脱色”30 min后倒掉培养皿中的液体,观察并测量菌落和水解圈的直径。
2)滤纸条崩解试验
将菌株接种到盛有10 mL液体生长培养基的试管中,28 ℃培养1 d以获得种子液,再分别将5 mL种子液接种于装有95 mL滤纸条液体培养基中,摇床(28 ℃、150 r/min)培养2 d,第3 天将培养基转移至28 ℃培养箱培养,然后每天定期观察并记录滤纸条降解情况。
1.4.3 酶活力复筛
1)粗酶制备
将菌株接种到液体产酶培养基中,在28 ℃、150 r/min的摇床中培养3 d后,取发酵液进行离心处理(8 000 r/min、10 min),所得上清液为粗酶液。
2)酶活力单位定义
1个酶活力单位(1U)是在50 ℃、pH值 4.8的条件下,底物每分钟被分解产生1mol葡萄糖所对应的酶量[23]。
3)酶活测定与计算
分别以羧甲基纤维素钠、微晶纤维素、水杨苷作为内切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶的分解底物,还原糖作为检测指标,并采用DNS法[24]测定。酶活计算如式(1)所示:
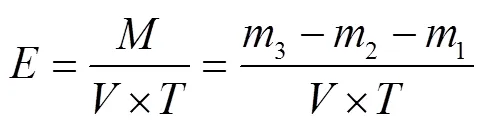
式中为酶活力,U/mL;为粗酶体积,mL;为酶解时间,min;为酶实际水解生成的还原糖量,mol;123分别为初始底物溶液中还原糖量、初始粗酶液中还原糖量、酶解后总体系还原糖量,mol。
1.4.4 酒糟降解及降解率测定
同1.4.2节中制备种子液,将种子液以5%接种量接种到酒糟降解培养基中作为试验组,对照组不接种,均设置3个平行,先于28 ℃、150 r/min的摇床中培养2 d,后于28 ℃静置培养8 d。参照文献[25-26]将发酵瓶中的样品用蒸馏水全部洗涤出来,再做抽滤处理,最后将酒糟置于烘箱烘干至恒质量。酒糟降解率的计算如式(2)所示:

1.4.5 形态学与生理生化鉴定
参考《常见细菌系统鉴定手册》[27]和《伯杰细菌鉴定手册》[28]对菌株进行形态学和生理生化鉴定。
1.4.6 分子生物学鉴定
根据细菌基因提取试剂盒方法提取菌株的DNA;细菌扩增引物(27F:5'-AGTTTGATCMTGGCTCAG-3';1492R:5'-GGTTACCTTGTTACGACTT-3');PCR扩增条件:98 ℃预变性5 min,98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸20 s,30个循环,72 ℃再延伸5 min。PCR扩增产物于4 ℃保存,并当天送至成都擎科梓熙生物技术有限公司测序。测定的基因序列在GenBank中进行BLAST相似性比对,采用MEGA5.05中的邻接法构建系统发育树,确定菌株的系统发育学地位,并将序列提交至GenBank,获得GenBank accession number(基因库登入号)。
1.4.7 pH、温度及酒精胁迫性试验
pH胁迫性试验:将菌浓度为1×102~2×102CFU/mL的菌悬液涂布于pH值不同的纯化培养基平板上,28 ℃培养3 d,然后观察菌的生长情况,以pH值6.8的平板为对照,给出生长良好、生长一般、生长弱或不生长3个评价等级,每个梯度设置3个平行,下同。温度胁迫性试验:将菌悬液涂布于纯化培养基(pH值6.8)平板上,于不同温度下培养3 d,以28 ℃的平板为对照。酒精胁迫性试验:将菌悬液涂布于乙醇终浓度不同的纯化培养基(pH值6.8)平板上,28 ℃培养3 d,以不添加乙醇的平板为对照;其中乙醇添加到平板中的方式是待培养基冷却至50 ℃左右,后用过滤除菌方式把乙醇添加到培养基中。
1.4.8 酒糟降解单因素试验
根据酒糟添加量、培养温度、pH值、接种量先后顺序进行试验,静置培养10 d,酒糟降解率为检测指标。经过预试验,初始条件设为:28 ℃,pH值 6,接种量为1%;进行酒糟添加量单因素试验时,在初始条件基础上,酒糟添加量设为因变量(20、40、60、80、100、120 g/L);进行温度单因素试验时,在酒糟添加量单因素试验基础上(取最佳酒糟添加量),温度设为因变量(23、28、31、34、37、40、43 ℃),以此类推,再分别考查pH值(4、4.5、5、6、7、8)和接种量(1%、2%、4%、6%、10%、15%)对酒糟降解率的影响。
1.4.9 酒糟降解响应面优化
利用Design -Expert 11软件进行响应面法(RSM)中的Box-Benhnken试验设计,以酒糟降解率为响应值,并利用该软件对数据进行拟合和方差分析,并得到多元回归方程模型;最后利用该软件对方程模型进行求解,以确定最佳条件,预测最佳响应值,根据实际试验结果对模型进行验证,以检查模型准确性。
1.5 试验设计与数据处理
用R语言的ggplot2包(3.2.1版本)绘图;基于R语言的agricolae包(1.3-2版本)中的LSD.test函数进行统计分析(方差分析、多重比较),采用Bonferroni校正的LSD法进行显著性检验;Design-Expert 11软件(Statease, Inc., Minneapolis, MS,USA)用于响应面试验设计(Box–Behnken Design);Adobe illustrator CC 2014软件用于矢量图形处理。
2 结果与分析
2.1 菌株分离与筛选
2.1.1 分离与定性初筛
从酱香型酒醅、清香型酒醅、浓香型高温大曲、竹林里的土壤腐殖质样品中,共分离出39株疑似产纤维素酶的菌株,经过刚果红染色法检测,有19株菌能够产生水解圈,其中A5、A9、B1、B2、C2、D12水解圈相对大且清晰(图1a、1b)。刚果红染色法检测产纤维素酶菌原理是通过在培养基中添加纤维素或纤维素衍生物,若微生物能够产生纤维素酶并能够分解一定量底物,那么经过刚果红染色检测就能在菌落周围形成透明圈(水解圈或清除区),通常可以根据透明圈直径大小或透明圈与菌落的直径比来揭示微生物产纤维素酶能力相对强弱。然而,也有研究发现透明圈直径大小可能与其所产生的CMC-Na酶活力无明显的相关性[26],仅通过刚果红染色法选择以上6株菌作为最佳产纤维素酶备选菌存在一定风险。由于滤纸条崩解试验可以反映菌株所分泌各种纤维酶的综合酶活力水平[29],因此结合滤纸崩解试验进一步定性判断19株菌产纤维素酶能力。滤纸崩解试验结果如表1所示,结果表明A5、A9、B1、B2、C2、D12菌株崩解滤纸形成段数较多,与刚果红染色结果基本一致。C2菌株来自C系列样品(浓香型高温大曲),其在C系列中表现最好,所以暂时保留C2菌株进行下一步研究。
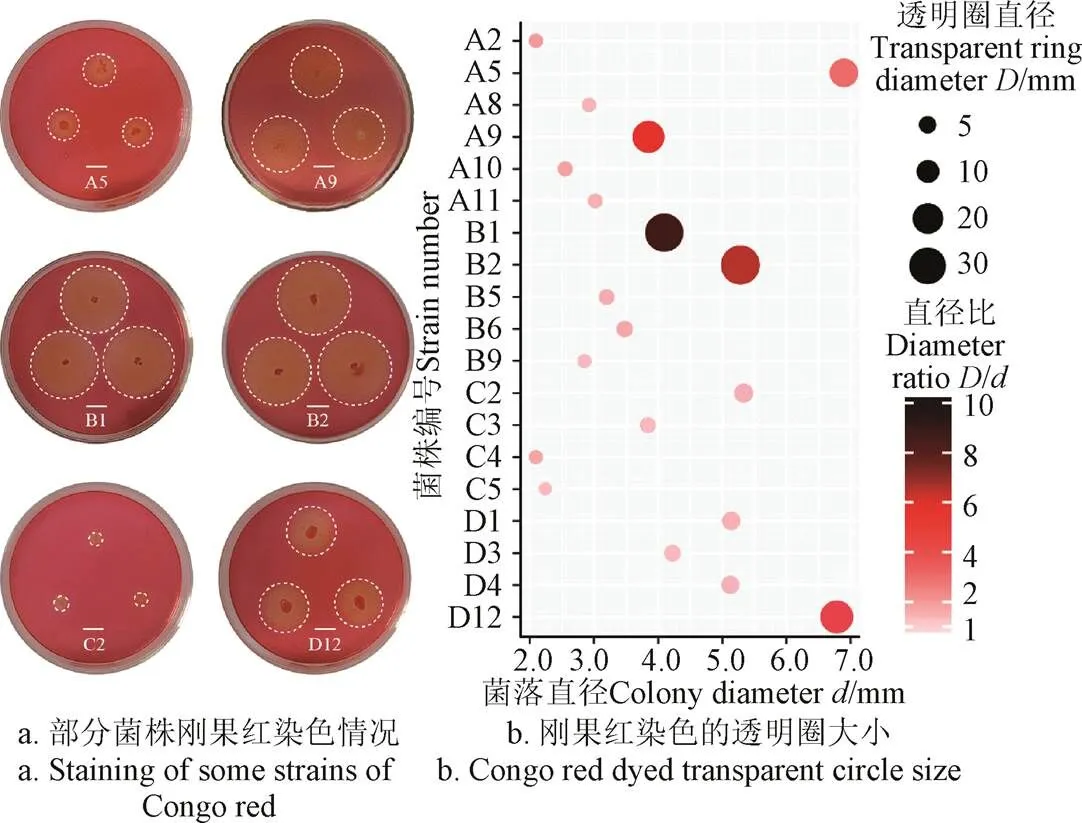
图1 刚果红染色定性筛选结果
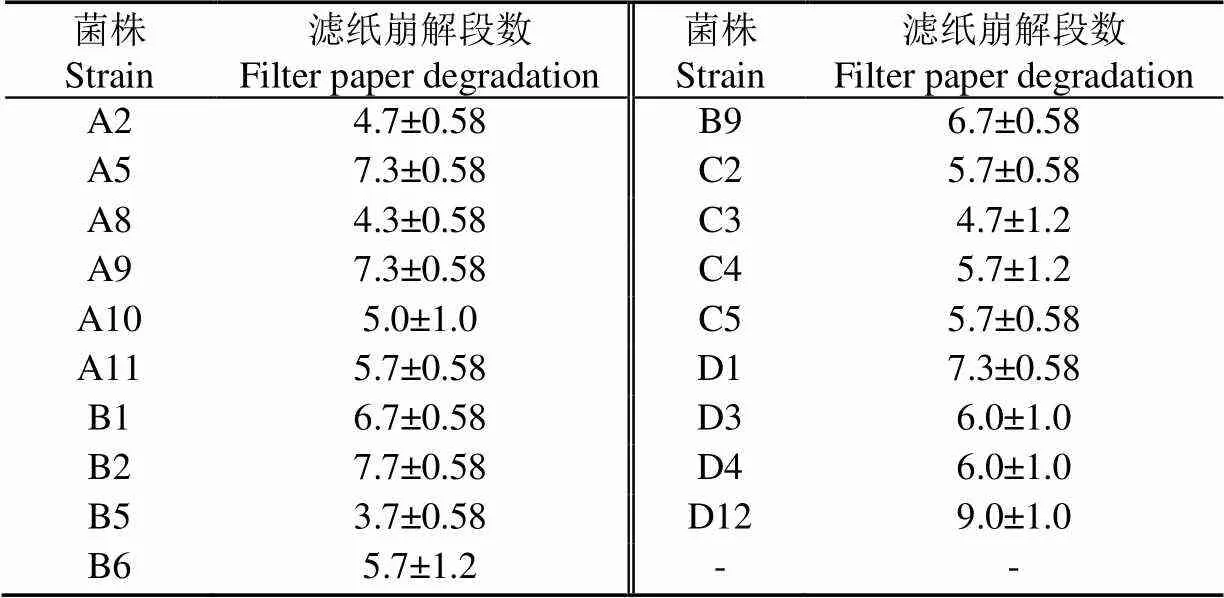
表1 菌株分解滤纸条情况
综上因素,选择A5、A9、B1、B2、C2、D12菌株进一步进行酶活力复筛。
2.1.2 酶活力复筛
酶活力复筛结果如表2所示,B1、B2菌株的3种纤维素酶活均显著高于其他菌株(<0.05),而C2菌株酶活显著低于其他菌株,这与刚果红染色定性结果基本一致。
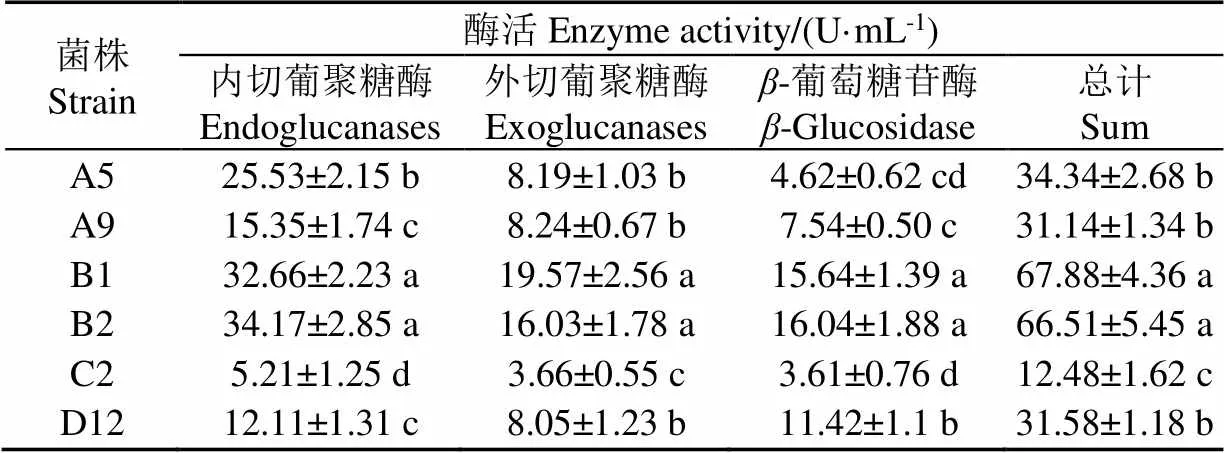
表2 复筛时6株菌纤维素酶活力值
注:同列不同小写字母表示差异显著(<0.05),下同。
Note: Different lowercase letters in the same column indicate significantdifferences (<0.05), and the following is the same.
2.2 菌株鉴定
2.2.1 形态学与生理生化鉴定
形态学鉴定,如图2所示。菌株A5、C2的菌落呈圆形,质地光滑,C2菌落呈黄色;A9菌株的菌落呈放射状,菌落表面湿润; B1、B2菌株的菌落表面干燥带有褶皱;D12菌株的菌落周围形成“黑色素”,培养3 d后,明显能闻到强烈的泥腥味。在1 000倍油镜观察下,A5、A9、B1、B2、C2菌株的细胞形态为杆状,细胞长约为1~6m,细胞宽约为0.5~2m,D12菌株与一般杆状细菌相比,细胞长度明显偏长,细胞长约为5~15m,D12菌株与霉菌相比细胞宽度偏短。革兰氏染色结果显示,A5、A9、B1、B2菌株为阳性,C2、D12菌株为阴性。生理生化鉴定,如图3所示。参考《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》,初步鉴定A5、A9、B1、B2为芽孢杆菌属,C2为鞘氨醇单胞菌属,D12为放线菌中的链霉菌属。
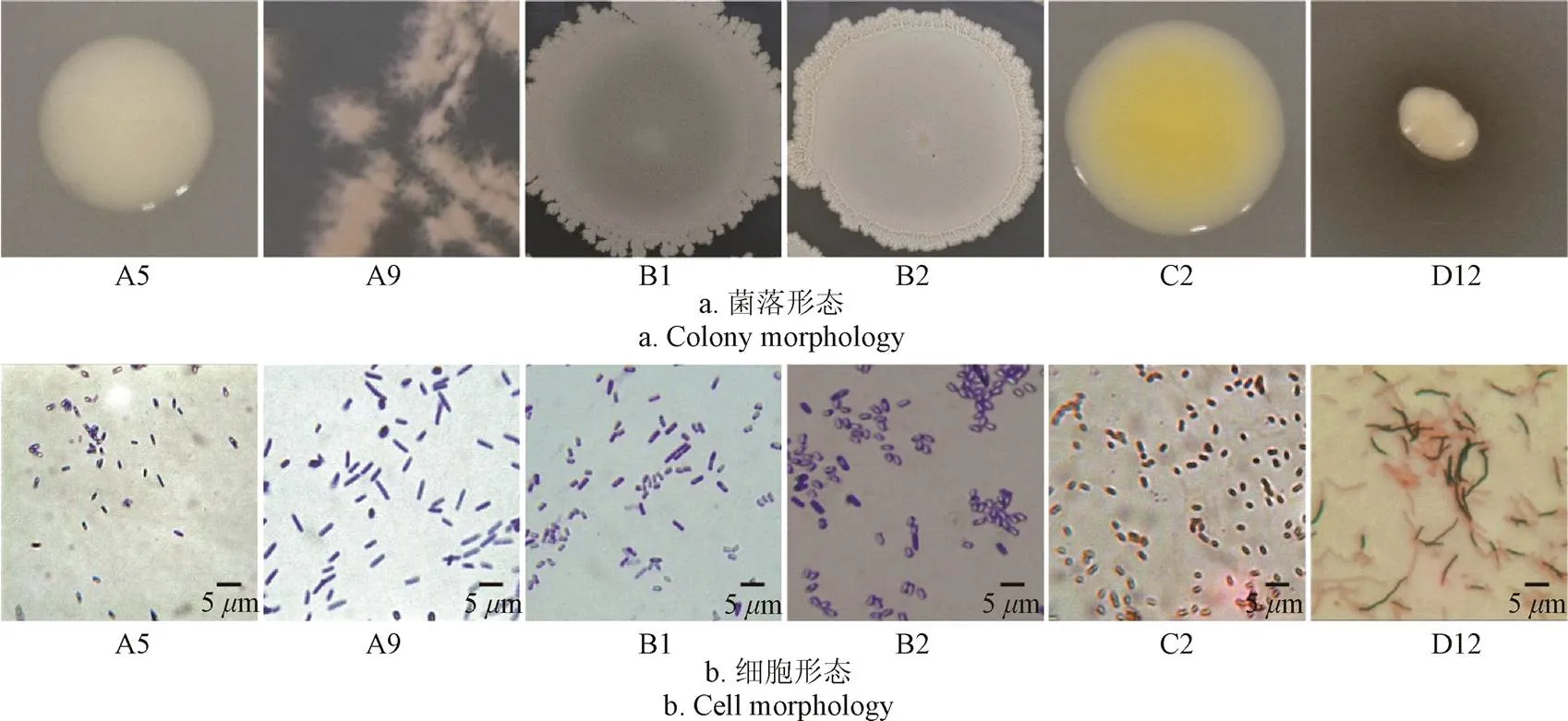
图2 6株菌的菌落和细胞形态
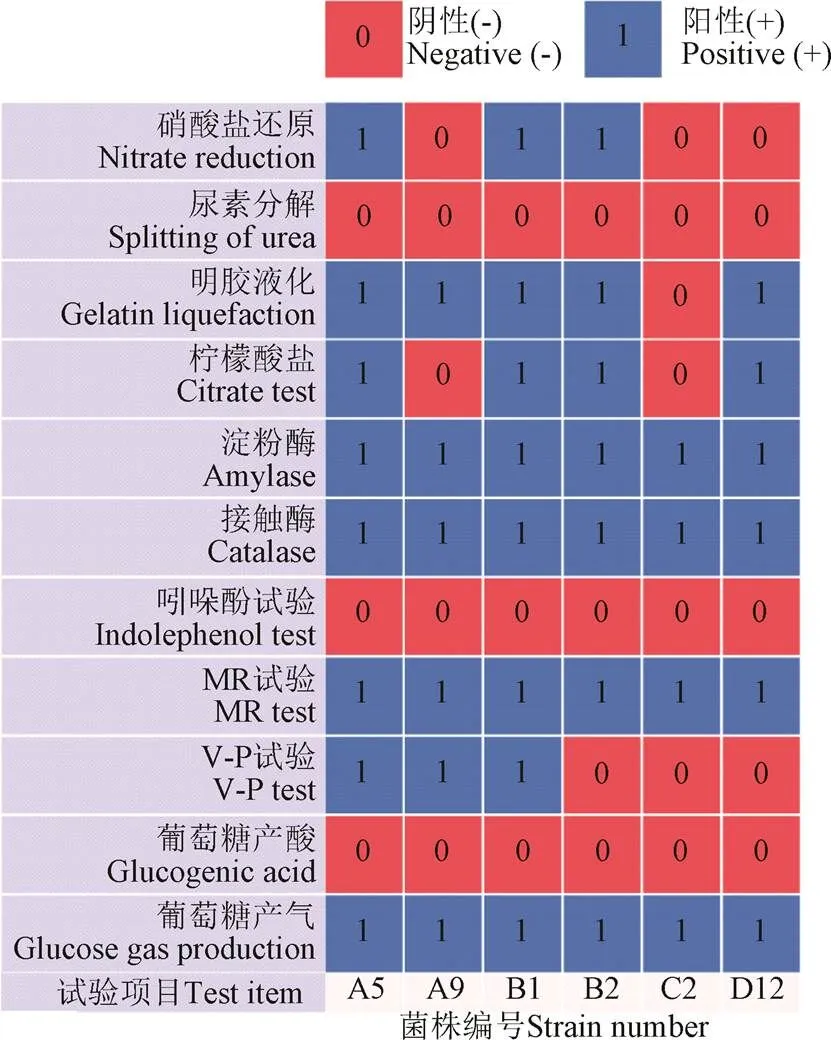
图3 6株菌的生理生化特征
2.2.2 分子生物学鉴定
将菌株的16S rDNA序列测定结果提交至GenBank做BLAST比对(表3)。利用MEGA 5.05的邻接法(Neighbor-Joining)构建系统发育树,如图4所示。
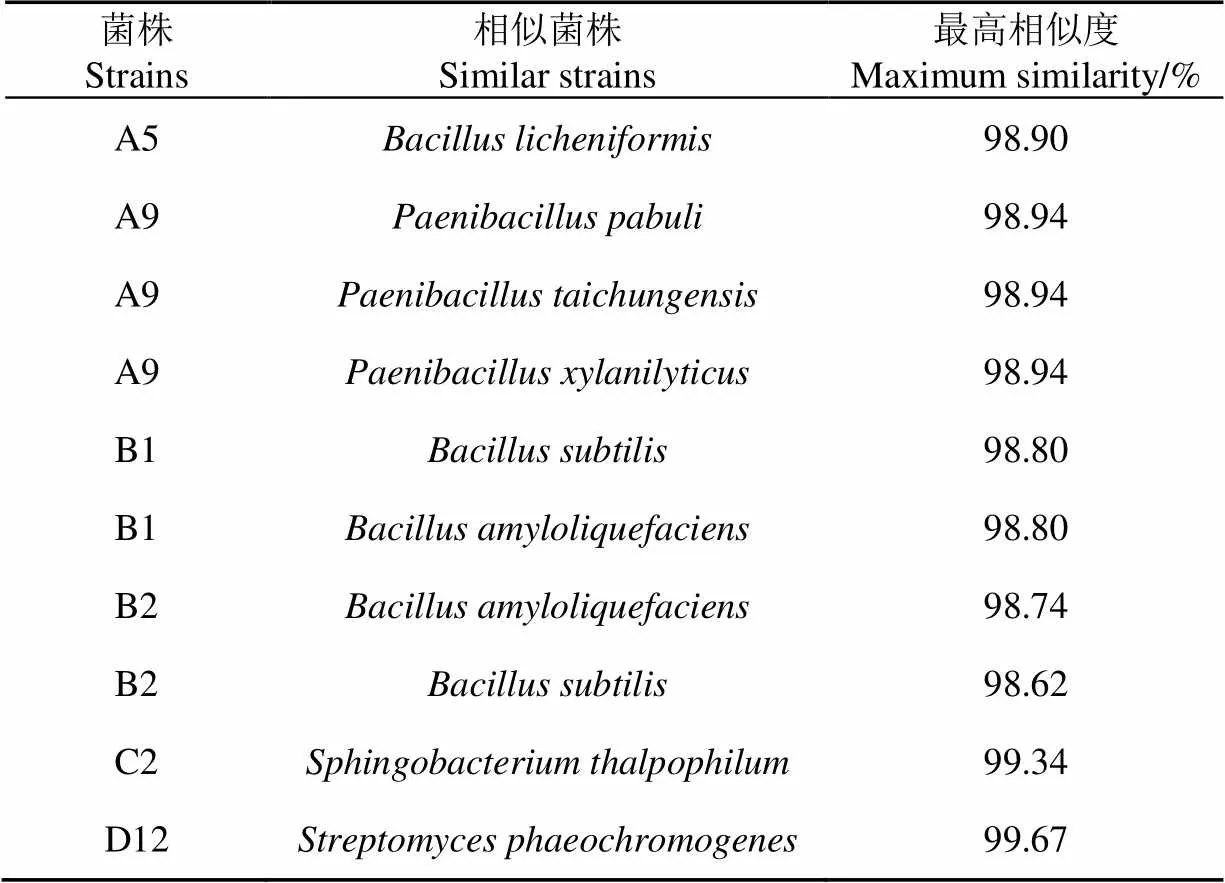
表3 菌株相似性比对结果
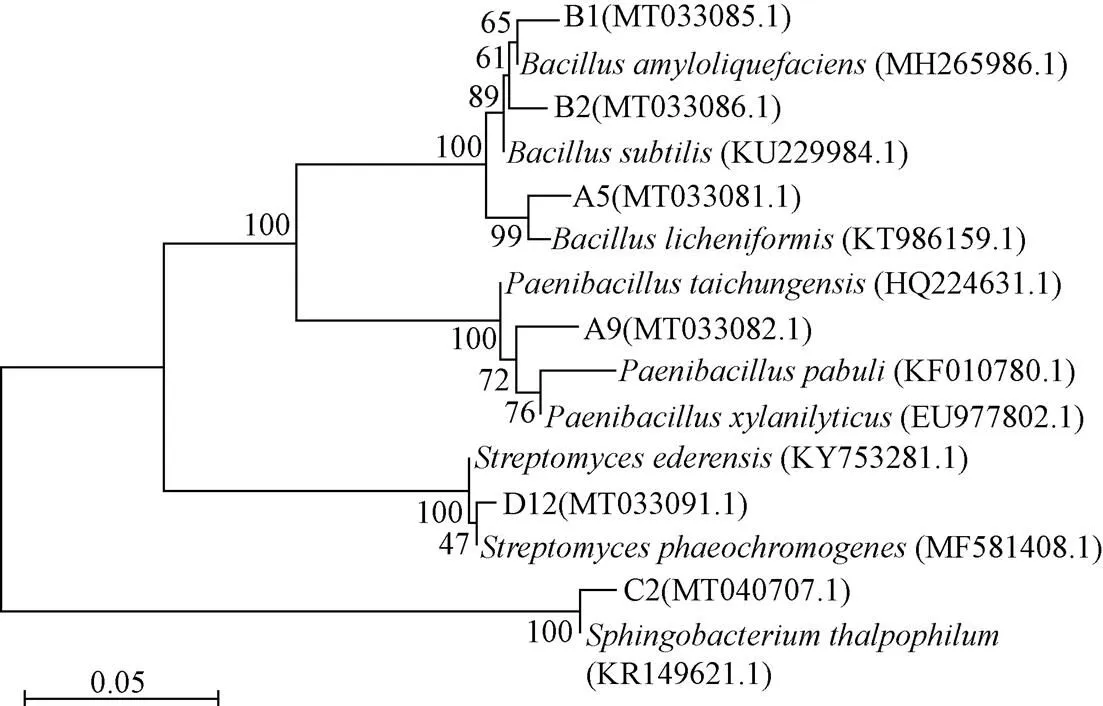
图4 基于菌株16S rDNA序列的系统发育树
结合形态学和生理生化鉴定,A5菌株鉴定为(地衣芽孢杆菌),A9菌株初步鉴定为(台中类芽孢杆菌),B1菌株初步鉴定为(解淀粉类芽孢杆菌),B2菌株初步鉴定为(枯草芽孢杆菌)、C2菌株鉴定为(嗜温鞘氨醇杆菌),D12菌株鉴定为(暗产色链霉菌)。根据鉴定结果,将基因序列及相关信息提交至GenBank,获得基因库登入号,见图4括号中的编号。
2.3 pH、温度及酒精胁迫性分析
为了筛选产纤维素酶能力强,且具有良好耐受性的菌株,结合筛选试验和菌株鉴定结果,选取A9、B2、D12菌株进行胁迫性分析,结果如图5所示。因A5、C2菌株产纤维素酶能力较差,而B1与B2菌株来自同一个样品,故本试验不考虑A5、B1、C2菌株。在pH胁迫性试验中,可以发现B2菌株在pH值4.0环境中生长良好,考虑到白酒糟酸度高问题,虽然酸度与pH值并不能等同,但是对pH值具有良好耐受的菌株在酒糟中更容易生存和繁殖,这将利于微生物进行分解代谢等活动。在温度胁迫性试验组中,3株菌在40 ℃下生长良好,而B2菌株仍能在44 ℃下良好生长。在乙醇耐受性试验中,3株菌在乙醇体积分数为4%的培养基中,生长已经受到限制,体积分数为2%的乙醇对B2和D12菌株的生长没有明显限制。综上分析,选择B2菌株作为酒糟降解试验菌。
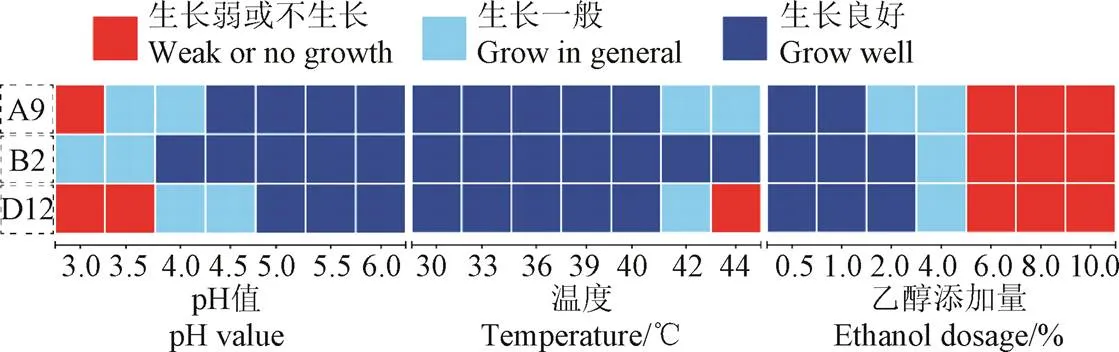
图5 菌株对pH值、温度、乙醇的胁迫性
2.4 单因素试验
如图6a所示,酒糟添加量对酒糟降解率影响显著,酒糟添加量较少时或较高时,酒糟降解率均偏低,这可能是培养液中营养物质失衡造成的,在酒糟添加量为60 g/L时,酒糟降解率达到最大值。如图6b所示,在28~37 ℃内,温度对酒糟降解率的影响差异不显著,在温度为34 ℃时,酒糟降解率达到最大值。与Chang研究相似,Chang等在30 ℃培养条件下从土壤中筛选产纤维素酶的芽孢杆菌,结果表明在30~37 ℃内,芽孢杆菌对木质纤维素降解率差异不明显,在37 ℃时降解率最大[30]。如图6c所示,较低pH值或较高pH值都不利于酒糟降解,pH值为6时,酒糟降解达到最大值。如图6d所示,接种量对酒糟降解率的影响随接种量增加而呈现先增加后减少趋势,但是增加和减少的幅度均较小,在接种量为6%时,酒糟降解率达到最大值。
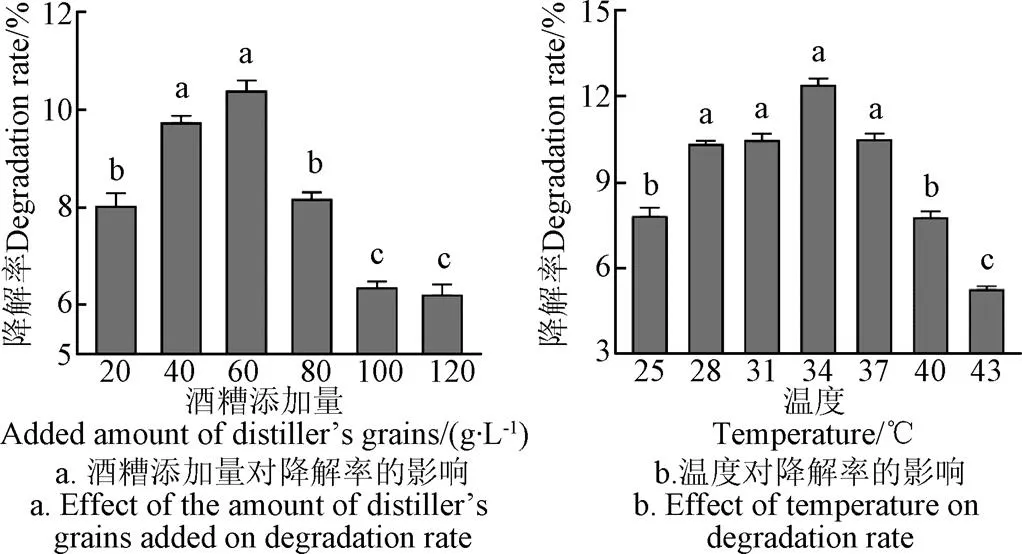
注:图6a中,温度28 ℃,pH值6,接种量1%;图6b中,酒糟添加量60 g·L-1,pH值6,接种量1%;图6c中,酒糟添加量60 g·L-1,温度34 ℃,接种量1%;图6d中,酒糟添加量60 g·L-1,温度34 ℃,pH值6。
Note: In fig.6a, temperature is 28 ℃, pH value is 6, inoculation size is 1%; In fig.6b, added amount of distiller's grains is 60 g·L-1, pH value is 6, inoculation size is 1%; In fig.6c,added amount of distiller's grains is 60 g·L-1, temperature 34 ℃, inoculation size 1%; In fig.6d, added amount of distiller's grains is 60 g·L-1, temperature 34 ℃, pH value is 6.
图6 B2菌株降解酒糟的单因素条件优化
Fig.6 Optimization of single factor conditions for lees degradation by strain B2
2.5 响应面优化
2.5.1 响应面试验设计
根据单因素试验结果,选择最大响应值及邻近的水平,或拐点及邻近水平作为响应面分析的各因素的3个水平[31]。采用Box-Behnken设计,响应面试验的因素与水平设计见表4。
2.5.2 响应面试验结果
采用四因素三水平的响应面试验设计,酒糟的的降解率作为响应值,试验结果如表5所示。
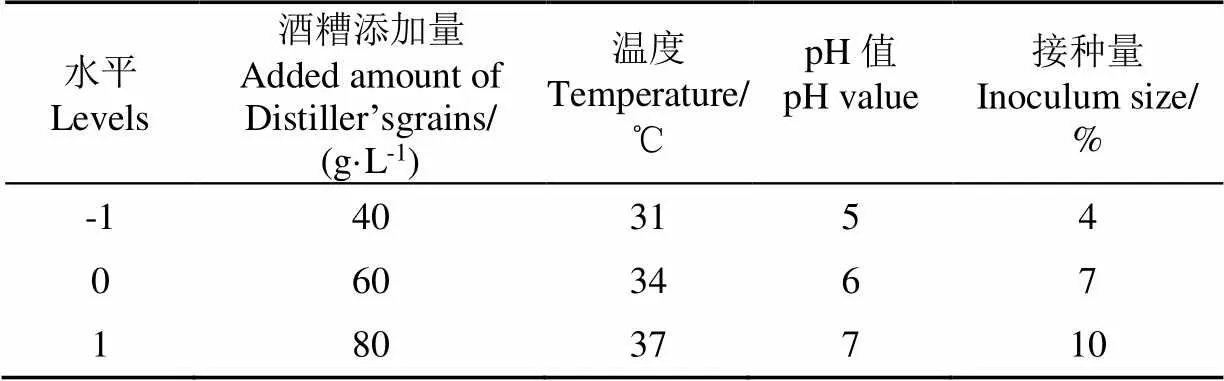
表4 响应面试验因素与水平
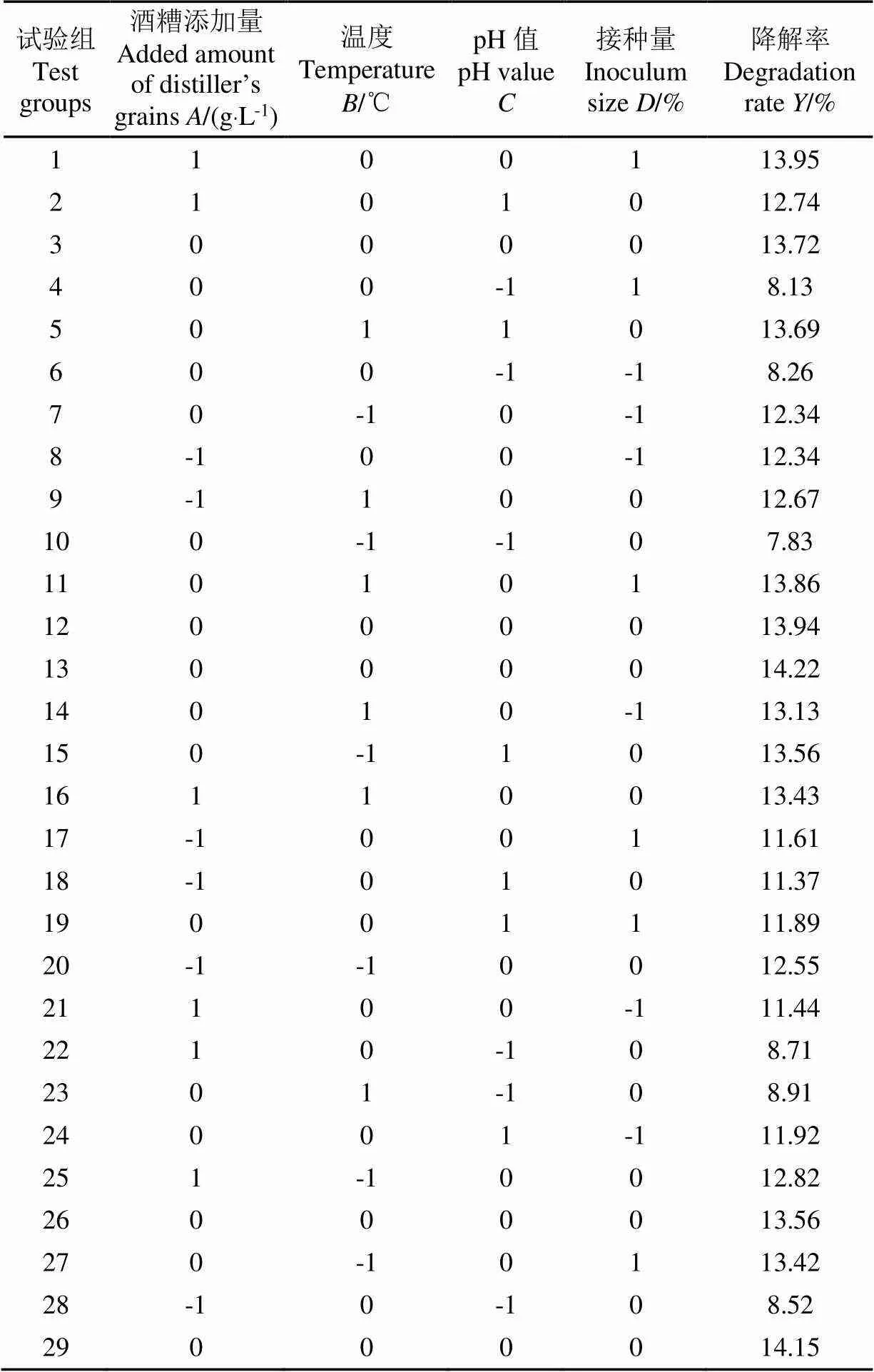
表5 Box-Behnken试验设计及响应值
2.5.3 模型构建及分析
利用Design-Expert 11软件对试验结果进行二次多项式回归方程模型构建,以编码因子表示的方程(Coded Equation)为
=13.920 0+0.335 8+0.264 2+2.070 0+
0.285 8+0.122 5+0.295 0+0.810 0−
0.237 5−0.087 5+0.025 0−0.819 02−
0.061 52−2.900 02−0.801 52(3)
式中各项系数的绝对值表示单因素对酒糟降解率的影响程度,正负反映影响方向。模型的方差分析结果,如表6所示。
模型的值<0.001,说明该拟合模型极显著。失拟项值为0.102 6(>0.05),表明失拟检验不显著,说明该模型可用于酒糟降解的优化[32-33]。回归模型的决定系数2=0.971 9,说明此方程对试验拟合度结果比较好,误差小;回归模型的调整决定系数2Adj=0.943 8,说明该模型能解释94.38%响应值的变化[34]。变异系数CV=4.06%,表明试验的重复性好,试验结果可靠[35]。综上所述,可以采用该模型的试验结果进行分析和预测,以及确定酒糟降解的最优参数条件。另一方面,由模型中的回归系数显著性检验可知,一次项对酒糟降解率影响显著(<0.05),一次项对酒糟降解率影响极显著(<0.001);交互项对酒糟降解率影响高度显著(<0.01);二次项2、2和2对酒糟降解率影响极显著(<0.001)。值可以反映各试验因素对试验指标的重要性,值越大,表明对试验指标的影响越大[31]。比较4个因素的值大小可知,>>>,进而可知各因素对酒糟降解率的影响主次顺序为: pH值、酒糟添加量、接种量、温度,这与上文对模型方程各项系数分析结果一致。
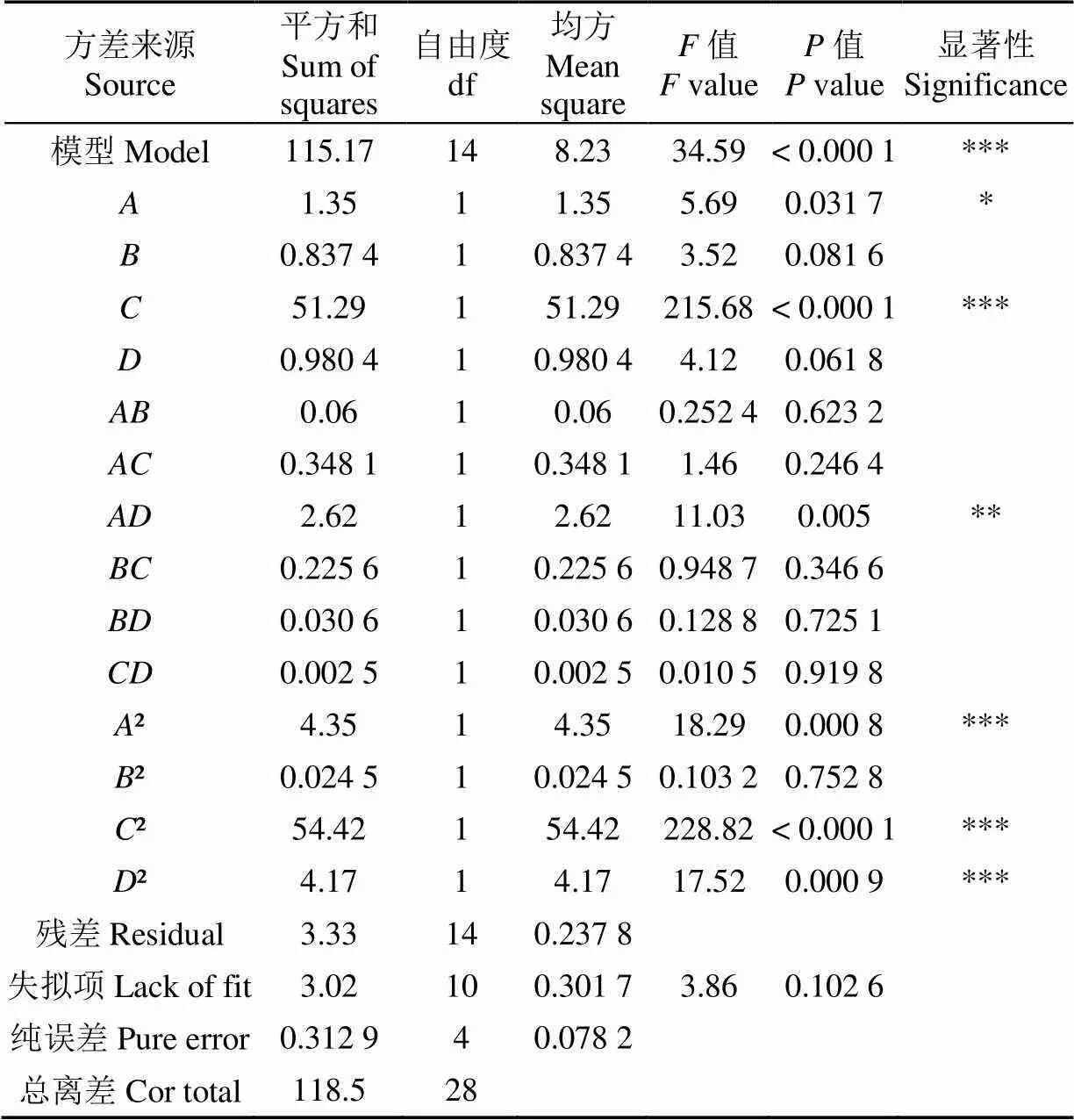
表6 响应面模型方差分析
注:* 差异显著(<0.05);** 差异高度显著(<0.01);*** 差异极显著(<0.001)。2=0.971 9,2Adj=0.943 8,CV=4.06%。
Note: * significant difference,<0.05; ** highly significant difference,<0.01;*** extremely significant difference,<0.001.2=0.971 9,2Adj=0.943 8, CV=4.06%.
响应面分析3D图(图7),可直观地看出各因素之间的相互作用。各3D响应曲面图均表现出某2个因素对酒糟降解率的相对影响,其余因素均保持在0水平[32]。结合表6中交互项的显著性分析,可知酒糟添加量与接种量的交互作用高度显著。等高线是响应面在水平方向的投影,在图7a或7b或7c中做酒糟添加量所在轴的平行线,以方便分析,可以发现酒糟添加量对降解率的影响是:降解率先随酒糟添加量增加而增加,后当酒糟添加量继续增加时,降解率反而减少,但是变化的幅度不是很大,这与单因素试验结果大致相同。同理,分析温度、pH值、接种量对降解率影响,结果均与单因素试验结果基本一致。
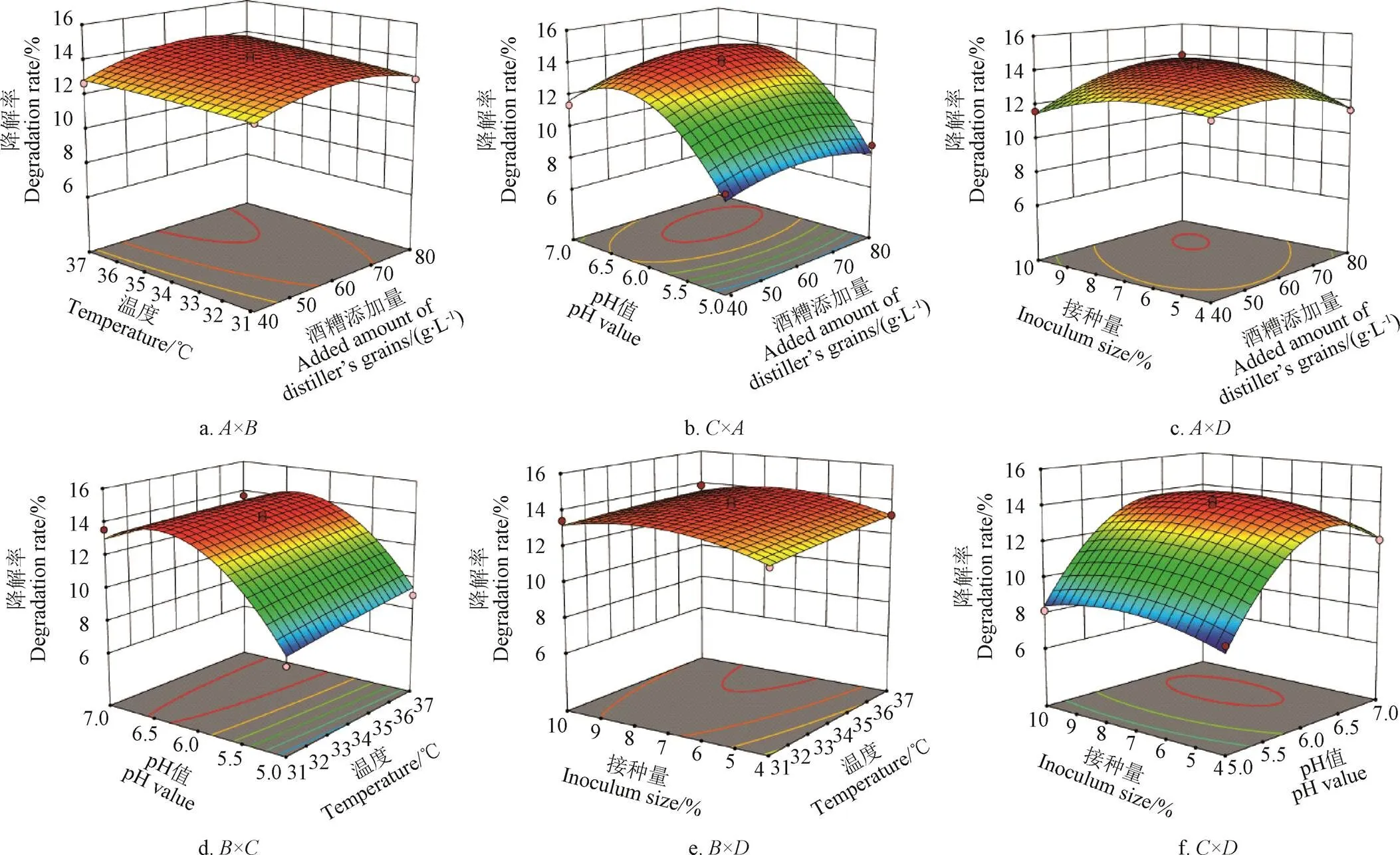
图7 各因素交互作用对降解率影响的响应面图
2.5.4 最佳条件确定及RSM模型验证
利用Design-Expert 11软件且基于单因素编码水平为[-1,1]定义域对回归方程求最大值,结果表明酒糟添加量为70.817 9 g/L,温度为37.000 0 ℃,pH值为6.345 0,接种量为8.203 1%,此时酒糟降解率为14.600 4%。为验证RSM模型可靠性,采用上述条件作为酒糟降解最佳工艺条件,考虑到实际操作的便利,将工艺条件修正为酒糟添加量71 g/L、温度37 ℃、pH值6.4、接种量8%。以修正过的工艺条件进行验证试验,重复6次,实际测得的酒糟降解率平均值为15.23%,相对误差为4.31%,表明该模型可以指导实践。
3 讨 论
目前关于白酒糟降解与利用的研究较少,很多酒糟被丢弃或是被填埋在地下,这对环境产生了一定污染[5]。虽然目前对酒糟进行处理存在成本高问题,但是在绿色发展大背景下,实现白酒糟合理处理、保护环境与节约资源却十分必要。
由微生物生产的纤维素酶在工业中有着广泛的应用,尽管前人已经筛选出了较多的纤维素降解菌,但能真正用于酒糟处理的菌株却很少。明红梅等[20]从白酒糟中筛选出一株CMC-Na酶活为13.71 U/g的地衣芽孢杆菌和一株酶活为9.25 U/g的枯草芽孢杆菌;李永博等[18]从浓香型酒醅中筛选出一株枯草芽孢杆菌,产酶条件优化后CMC-Na酶活为38.84 U/mL;何颂捷等[22]从酒醅和窖泥中筛选出1株CMC-Na酶活为49.31 U/mL的贝莱斯芽孢杆菌和一株CMC-Na酶活为31.81 U/mL解淀粉芽孢杆菌;宋丽丽等[11]从白酒糟中筛选出一株CMC-Na酶活为36.73U/mL的巨大芽孢杆菌。由于产酶条件不同,尤其是一些文献的酶活测定方法不太合理,因此通过对比CMC-Na酶活来评价筛选出来的B2菌株产酶能力,并不太合理。纤维素水解是基于内切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶协同作用,一些研究者仅以CMC-Na为底物来测定内切葡聚糖酶活,进而来评价菌株的产纤维素酶能力,这种做法应该值得商榷。基于单因素试验和响应面优化结果,发现控制体系中的pH值对酒糟降解十分重要,对指导酒糟降解或处理具有较大参考意义。
真菌具有水解酶体系完善、纤维素酶分泌量大等优点[25]。木霉菌属与曲霉菌属作为产纤维素酶真菌的主要代表,研究得比较多。关于酒糟降解或者是从酿酒环节中的样品筛选产纤维素酶真菌的研究相对较少。兰小艳等[21]采用白腐菌使酒糟纤维素含量降低了9.5%,提高酒糟的利用价值。洋河酒厂将从大曲中筛选的产纤维素酶霉菌进行甲基磺酸乙酯(EMS)诱变处理,然后与糖化酶、活性干酵母混合使用,出酒率提高了3.89%[36]。细菌由于具有较高的生长速度、对基因工程具有较高的相容性和可行性等优点[8],产纤维素酶细菌也受到了重视。然而,细菌水解纤维素效率低的问题也很突出,基于纤维素降解需要众多酶协同作用的机制,构建复合菌系降解纤维素成为了研究热点。李静等[26]构建由3种菌组成的复合菌系,结果较单菌株秸秆降解率提高了50.71%。王海滨等[29]构建由5种菌组成的复合菌系,结果显著提高了滤纸酶活力和对苦参残渣及稻秆的降解效果。日本学者Chang[30]用芽孢杆菌和乳酸菌联合处理水稻秸秆,结果发现纤维素酶活性显著提高,木质素和半纤维素含量相应降低。目前纤维素降解机制并不清楚,其中协同作用模型被更多学者接受。根据协同作用理论[37],纤维素的降解过程大致分为4个步骤,首先是纤维素酶分子吸附到纤维素表面,接着是内切葡聚糖酶在葡聚糖链的随机位点水解底物产生寡聚糖;然后是外切葡聚糖酶从葡聚糖链的非还原端进行水解,形成纤维二糖主要水解产物;最后是-葡萄糖苷酶将纤维素二糖水解为葡萄糖。此外,真菌分泌的多为胞外纤维素酶,不用依附于纤维素表面后才降解纤维素[38]。一些研究表明植物中含有的木质素会对纤维素酶产生不可逆吸附,使一部分酶失活[39]。综上所述,本文后期可以通过构建复合菌系来模拟真菌完善的酶体系和减少纤维素酶产生的不可逆吸附,为协同作用提供有利条件,进而提高酒糟的降解效果。
4 结 论
1)采用刚果红平板筛选法,从酱香型酒醅、清香型酒醅、浓香型大曲、竹林里的土壤腐殖质中共分离出39株菌。结合菌株产生的内切葡聚糖酶、外切葡聚糖酶、-葡萄糖苷酶的酶活,复筛出6株菌。基于形态学、生理生化和分子生物学分析,6株产纤维素酶菌分别被鉴定为地衣芽孢杆菌、台中类芽孢杆菌、解淀粉类芽孢杆菌、枯草芽孢杆菌、嗜温鞘氨醇杆菌、暗产色链霉菌。pH、温度和酒精胁迫性试验表明枯草芽孢杆菌(B2)具有良好的耐受性,在pH值3.0、温度44 ℃、酒精体积分数为4%环境中生长良好。
2)将枯草芽孢杆菌B2菌株应用于酒糟降解工艺研究,在单因素试验结果的基础上,采用Box-Benhnken响应面法进行工艺优化,确定了酒糟降解最佳工艺条件为:酒糟添加量71 g/L、温度37 ℃、pH值 6.4、接种量8%;在此条件下,酒糟降解率为15.23%。
[1] 刘志云,钟晓霞,姚焰础,等. 白酒糟生物饲料及其在猪生产上的应用现状[J]. 动物营养学报,2020,32(1):15-20.
Liu Zhiyun, Zhong Xiaoxia, Yao Yanchu, et al. Biological feed of white distiller's grains and its application status in swine production[J]. Chinese Journal of Animal Nutrition, 2020, 32(1): 15-20. (in Chinese with English abstract)
[2] 裴久文,方勇,高学志,等.. X1固态发酵改善酒糟品质[J]. 生物学杂志,2019,36(6):64-68.
Pei Jiuwen, Fang Yong, Gao Xuezhi, et al. Improvement of distiller's grains quality by. X1 under solid-state fermentation[J]. Journal of Biology, 2019, 36(6): 64-68.(in Chinese with English abstract)
[3] 高铭坤,温广宇,钱芳. 微生物对白酒酒糟的转化利用研究进展[J]. 食品与机械,2018,34(2):191-194.
Gao Mingkun, Wen Guangyu, Qian Fang. Advances in microbial conversion and utilization of distiller grains[J]. Food & Machinery, 2018, 34(2): 191-194. (in Chinese with English abstract)
[4] 马霞,董炎炎,于海燕. 酒糟浸出液发酵产细菌纤维素工艺优化[J]. 农业工程学报,2015,31(8):302-307.
Ma Xia, Dong Yanyan, Yu Haiyan. Optimization of bacterial cellulose fermentation technology with distiller's grains[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(8): 302-307. (in Chinese with English abstract)
[5] Ao T, Li R, Chen Y, et al. Anaerobic thermophilic digestion of Maotai-Flavored distiller's grains: Process performance and microbial community dynamics[J]. Energy & Fuels, 2019, 33(9): 8804-8811.
[6] 张黎骅,张文,吕珍珍,等. 响应面法优化酒糟微波间歇干燥工艺[J]. 农业工程学报,2011,27(3):369-374.
Zhang Lihua, Zhang Wen, Lu Zhenzhen, et al. Optimization of intermittent microwave drying technology for lees by response surface methodology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(3): 369-374. (in Chinese with English abstract)
[7] 李倩,裴朝曦,王之盛,等. 不同类型酒糟营养成分组成差异的比较研究[J]. 动物营养学报,2018,30(6):2369-2376.
Li Qian, Pei Chaoxi, Wang Zhisheng, et al. Comparative study on nutrients compositions of different types of distiller's grains[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2369-2376. (in Chinese with English abstract)
[8] Akhtar N, Aanchal, Goyal D, et al. Biodiversity of cellulase producing bacteria and their applications[J]. Cellulose Chemistry and Technology, 2016, 50(9/10): 983-995.
[9] Ben Hmad I, Gargouri A. Neutral and alkaline cellulases: Production, engineering, and applications[J]. Journal of Basic Microbiology, 2017, 57(8): 653-658.
[10] Kuhad R C, Gupta R, Singh A. Microbial cellulases and their industrial applications[J]. Enzyme Research, 2011, 2011: 280696.
[11] 宋丽丽,闻格,霍姗浩,等. 白酒酒糟中产纤维素酶细菌的分离筛选和酶学性质研究[J]. 食品与发酵工业,2020,46(7):43-49.
Song Lili, Wen Ge, Huo Shanhao, et al. Screening, identification and enzymatic property of a cellulase- producing bacterium in distiller's grains[J]. Food and Fermentation Industries, 2020, 46(7): 43-49. (in Chinese with English abstract)
[12] Irfan M, Tayyab A, Hasan F, et al. Production and characterization of organic solvent-tolerant cellulase fromAK9 isolated from hot spring[J]. Applied Biochemistry and Biotechnology, 2017, 182(4): 1390-1402.
[13] Croos A M B, Rajendran S, Ranganathan K. Isolation of a cellulase producingfrom cow dung and determination of the kinetic properties of the crude enzyme[J]. Journal of the National Science Foundation of Sri Lanka, 2019, 47(2): 261-267.
[14] Reddy K V, Vijayalashmi T, Ranjit P, et al. Characterization of some efficient cellulase producing bacteria isolated from pulp and paper mill effluent contaminated soil[J]. Brazilian Archives of Biology and Technology, 2017, 60: e17160226
[15] Paudel Y P, Qin W. Characterization of novel cellulase-producing bacteria isolated from rotting wood samples[J]. Applied Biochemistry and Biotechnology, 2015, 177(5): 1186-1198.
[16] Acharya S, Chaudhary A. Bioprospecting thermophiles for cellulase production: A review[J]. Brazilian Journal of Microbiology, 2012, 43(3): 844-856.
[17] 刘茂柯,唐玉明,熊洪,等. 白酒酒醅纤维素降解菌的多样性分析及其分离筛选[J]. 食品与发酵工业,2018,44(4):35-41.
Liu Maoke, Tang Yuming, Xiong Hong, et al. Characterization of the diversity and activity of cellulose-degrading bacteria in Zaopei used for Chinese Baijiu production [J]. Food and Fermentation Industries, 2018, 44(4): 35-41.(in Chinese with English abstract)
[18] 李永博,暴金磊,万敏,等. 酒醅中高产纤维素酶菌株的筛选及其酶学性质[J]. 食品工业科技,2017,38(24):109-113.
Li Yongbo, Bao Jinlei, Wan Min, et al. Study on screening of high-yield cellulase strains in the fermented grains and its enzymatic properties[J]. Science and Technology of Food Industry, 2017, 38(24): 109-113. (in Chinese with English abstract)
[19] 龚丽琼,邓朝霞,黄祖新,等. 高温大曲中筛选产纤维素酶的耐高温芽孢杆菌[J]. 福建师范大学学报:自然科学版,2012,28(3):106-112.
Gong Liqiong, Deng Chaoxia, Huang Zuxin, et al. Screening of a thermostable cellulase-secreting bacillus from high temperature Daqu[J]. Journal of Fujian Normal University (Natural Science Edition), 2012, 28(3): 106-112. (in Chinese with English abstract)
[20] 明红梅,邹伟,陈晓旭,等. 白酒糟高温纤维素分解菌的筛选、产酶分析与鉴定[J]. 饲料研究,2015(11):24-27.
[21] 兰小艳,陈雪玲,张敬慧,等. 酒糟中纤维素的降解及再利用研究[J]. 畜牧与饲料科学,2018,39(4):21-22.
Lan Xiaoyan, Chen Xueling, Zhang Jinghui, et al. Investigation on degradation and reuse of cellulose in distiller's grains [J]. Animal Husbandry and Feed Science, 2018, 39(4): 21-22.(in Chinese with English abstract)
[22] 何颂捷,左勇,张鑫,等. 降解白酒酒糟中纤维素的细菌的分离鉴定[J]. 食品与发酵工业,2019,45(24):64-70.
He Songjie, Zuo Yong, Zhang Xin, et al. Isolation and identification of bacteria degrading cellulose in distillers' grains[J]. Food and Fermentation Industries, 2019, 45(24): 64-70.(in Chinese with English abstract)
[23] 邹宗胜,王婧雅,赵运英,等. 高产纤维素酶突变株的筛选及其产酶条件优化[J]. 食品科学,2019,40(6):48-54.
Zou Zongsheng, Wang Jingya, Zhao Yunying, et al. Screening ofand optimization of fermentation conditions for higher cellulase production[J]. Food Science, 2019, 40(6): 48-54. (in Chinese with English abstract)
[24] Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[25] 付丽,朱红雨,杜明楠,等. 秸秆降解菌株的筛选、鉴定及生物学特性研究[J]. 中国农业大学学报,2018,23(12):39-49.
Fu Li, Zhu Hongyu, Du Mingnan, et al. Screening, identification and biological characteristics of straw-degrading bacteria strains[J]. Journal of China Agricultural University, 2018, 23(12): 39-49.(in Chinese with English abstract)
[26] 李静,张瀚能,赵翀,等. 高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J]. 应用与环境生物学报, 2016,22(4):689-696.
Li Jing, Zhang Hanneng, Zhao Chong, et al. Isolation and screening of cellulose decomposing microbe and the straw decomposing effect of complex microbial system[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(4): 689-696. (in Chinese with English abstract)
[27] 蔡妙英,东秀珠. 常见细菌系统鉴定手册[M]. 北京:科学出版社.
[28] 布坎南,吉本斯. 伯杰细菌鉴定手册[M]. 北京:科学出版社,1984.
[29] 王海滨,韩立荣,冯俊涛,等. 高效纤维素降解菌的筛选及复合菌系的构建[J]. 农业生物技术学报,2015,23(4):421-431.
Wang Haibin, Han Lirong, Feng Juntao, et al. Screening of highly efficient cellulose degradation microbes and construction of composite strains[J]. Journal of Agricultural Biotechnology, 2015, 23(4): 421-431. (in Chinese with English abstract)
[30] Chang Y, Choi D, Takamizawa K, et al. Isolation ofstrains capable of decomposing alkali lignin and their application in combination with lactic acid bacteria for enhancing cellulase performance[J]. Bioresource Technology, 2014, 152: 429-436.
[31] 陶陶,贺凡,姬小明,等. 响应面法优化闪式提取葫芦巴多糖及其保润性能研究[J]. 精细化工,2016,33(6):666-673.
Tao Tao, He Fan, Ji Xiaoming, et al. Response surface methodology for optimization of flash extraction for fenugreek (.) polysaccharides and research of its humectant properties [J]. Fine Chemicals, 2016, 33(6): 666-673. (in Chinese with English abstract)
[32] Wang P, Chang J, Yin Q, et al. Effects of thermo-chemical pretreatment plus microbial fermentation and enzymatic hydrolysis on saccharification and lignocellulose degradation of corn straw[J]. Bioresource Technology, 2015, 194: 165-171.
[33] 任天宝,马孝琴,徐桂转,等. 响应面法优化玉米秸秆蒸汽爆破预处理条件[J]. 农业工程学报,2011,27(9):282-286.
Ren Tianbao, Ma Xiaoqin, Xu Guizhuan, et al. Optimizing steam explosion pretreatment conditions of corn stalk by response surface methodology[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(9): 282-286. (in Chinese with English abstract)
[34] 王旭辉,徐鑫,山其米克,等. 玉米秸秆厌氧消化预处理方法及工艺优化[J]. 农业工程学报,2018,34(23):246-253.
Wang Xuhui, Xu Xin, Shan Qimike, et al. Optimization of pretreatment process for corn straw anaerobic digest[J]. Transactions of the Chinese Society of Agricultural Engineering(Transactions of the CSAE), 2018, 34(23): 246-253. (in Chinese with English abstract)
[35] 黄皓,王珍妮,李莉,等. 甘油水溶液提取米糠多酚绿色工艺优化及多酚种类鉴定[J]. 农业工程学报,2019,35(4):305-312.
Huang Hao, Wang Zhenni, Li Li, et al. Optimization of green extraction process and identification of polyphenols variety from rice bran using glycerol/water ystem[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 305-312. (in Chinese with English abstract)
[36] 杨建梅,王晓慧,王永伟,等. 大曲中高产纤维素酶菌株的选育及其在绵柔型白酒丢糟中的应用[J]. 酿酒科技,2016(8):71-75.
Yang Jianmei, Wang Xiaohui, Wang Yongwei, et al. Breeding of a strain with high yield of cellulase from Daqu and its application in waste distiller's grains of Soft-Flavor Baijiu[J]. Liquor-Making Science & Technology, 2016(8): 71-75. (in Chinese with English abstract)
[37] Jeoh T, Cardona M J, Karuna N, et al. Mechanistic kinetic models of enzymatic cellulose hydrolysis a review[J]. Biotechnology and Bioengineering, 2017, 114(7): 1369-1385.
[38] Coughlan M P. The properties of fungal and bacterial cellulases with comment on their production and application[J]. Biotechnology and Genetic Engineering Reviews, 1985, 3(1): 39-110.
[39] 曲音波. 木质纤维素降解酶与生物炼制[M]. 北京:化学工业出版社,2011.
Screening of cellulose degrading bacteria in distiller’s grains and degradation technology of distiller's grains
Yang Gang1, Yang Diqin1, Cao Wentao1,2※, Wang Xiaodan1
(1.,550025,; 2.,550025,)
Distiller’s grains serve as the important by-products in ethanol production, particularly on white spirits in China. Normally, the key grain can be processed in a solid-state fermentation, thereby to distill a mixture of grains and bran husks. After the processing, the distiller's grains can be remained readily available rich in organic matter, such as cellulose and protein. China can produce about 30 million tons of distiller's grains every year, as the consumption of white spirits increases. The discarded distiller's grains have become the waste of raw materials, further to pollute the environment, due to the lack of effective treatment methods. It is necessary to explore much more efficient disposal of distiller's grains. This study aims to explore the decomposition of distiller's grains, in order to obtain microorganisms with strong capacity of cellulose degradation in distillates. 39 strains of bacteria were isolated from in Chinese maotai-flavor fermented grains, Chinese mild-flavor fermented grains, Chinese strong-flavor Daqu starter and the soil of bamboo forest, using sodium carboxymethyl cellulose as the only carbon source. Six strains were quantitatively screened using Congo red staining and filter paper strip disintegration experiments for qualitative preliminary screening, combined with the endoglucanase, exoglucanase, and-glucosidase enzyme activities produced by the strains. Based on morphological, physiological, biochemical, and molecular biological characterization, six cellulase-producing bacteria were identified as,,, and,,. The optimum lees cellulose-degrading strain was further determined the B2 strain () inthe tests of pH, temperature, and alcohol stress. Specifically,B2 strain has demonstrated a good tolerance, while grew well in an environment of pH value 3.0, at the temperature of 44 ℃, and the alcohol content of 4% by volume. According to the single-factor test, a Box-Benhnken response surface method was used to optimize the processing parameters in the treatments. The optimal process conditions were determined to be 71 g/L distiller's grains, the temperature of 37 ℃, pH value 6.4, and the inoculation size of 8%, for the degradation of distiller's grains. In addition, the degradation rate of distiller's grains can reach 15.23% in this case. The findings demonstrated that the selectedcan effectively decompose distiller's grains, and thereby be expected to provide a promising application potential in the disposal of distiller's grains.
cellulose; degradation; wastes; distiller's grains; cellulase;; screening; vinasse processing
阳刚,杨第芹,曹文涛,等. 白酒糟纤维素降解菌的优选及酒糟降解工艺[J]. 农业工程学报,2020,36(13):212-221.doi:10.11975/j.issn.1002-6819.2020.13.025 http://www.tcsae.org
Yang Gang, Yang Diqin, Cao Wentao, et al. Screening of cellulose degrading bacteria in distiller's grains and degradation technology of distiller's grains[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(13): 212-221. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.13.025 http://www.tcsae.org
2020-03-22
2020-05-20
贵州省科技支撑计划项目(黔科合支撑[2018]2314)
阳刚,主要从事酿酒微生物及生物建模研究。Email:GZ_university_YG@163.com
曹文涛,教授,主要从事白酒糟资源化利用及酿酒微生物应用研究。Email:452794932@qq.com
10.11975/j.issn.1002-6819.2020.13.025
Q939.96; TS261.1
A
1002-6819(2020)-13-0212-10
