云南省芒市草地贪夜蛾幼虫肠道可培养细菌种类及对抗生素的敏感性
2020-08-11张志红张凌英赵英杰苏造堂陈思颖肖关丽李维薇陈斌
张志红 张凌英 赵英杰 苏造堂 陈思颖 肖关丽 李维薇 陈斌


摘要:【目的】明确云南省芒市草地贪夜蛾幼虫肠道可培养细菌种类及优势种细菌对抗生素的敏感性,为草地贪夜蛾的绿色防控提供参考。【方法】采用常规分离培养法对云南省芒市玉米田草地贪夜蛾5龄幼虫肠道可培养细菌进行分离培养,采用形态特征和16S rDNA技术对细菌种类进行鉴定;采用纸片扩散法测定优势种细菌对10种抗生素的敏感性。【结果】云南省芒市玉米田草地贪夜蛾5龄幼虫肠道内可培养细菌有3门5科5属6种,分别为变栖克雷伯氏菌(Klebsiella variicola)、蒙氏肠球菌(Enterococcus mundtii)、鹑鸡肠球菌(E. gallinarum)、普羅威登斯菌(Providencia vermicola)、金黄微杆菌(Chryseomicrobium aureum)和Kocuria himachalensis,其中变栖克雷伯氏菌是草地贪夜蛾幼虫肠道的优势种细菌。变栖克雷伯氏菌对10种抗生素的敏感性测定结果表明,变栖克雷伯氏菌对诺氟沙星、环丙沙星、复方新诺明、氯霉素和头孢唑林敏感,表现为低耐药性;对庆大霉素和阿米卡星中等敏感,表现为中等耐药性;对青霉素、红霉素和氨苄西林的敏感性较弱,表现为强耐药性。【结论】云南省芒市草地贪夜蛾幼虫肠道可培养细菌组成具有多样性,其中变栖克雷伯氏菌为优势种细菌,该优势种细菌对青霉素、红霉素和氨苄西林存在明显的耐药性。
关键词: 草地贪夜蛾;肠道细菌;抗生素敏感性;云南省芒市
Abstract:【Objective】To determine the species of culturable bacteria in the intestine of larvae of Spodoptera frugiperda in Mangshi in Yunnan and the sensitivity of dominant bacteria to antibiotics, and provide reference for biocontrol of S. frugiperda. 【Method】Bacteria in the intestine of the 5th instar larvae of S. frugiperda in the corn field of Mangshi was isolated and cultured using routine isolation and culture method. The species were identified using the morphological characterisitics and 16S rDNA molecular techniques. The sensitivity of dominant bacteria to 10 antibiotics was determined using the paper diffusion method. 【Result】The culturable bacteria in the intestine of the 5th instar larvae of S. frugiperda in the corn field of Mangshi belonged to 3 phyla, 5 families, 5 genera and 6 species, they were Klebsiella variicola, Enterococcus mundtii,E. gallinarum,Providencia vermicola,Chryseomicrobium aureum and Kocuria himachalensis. Among them, K. variicola was the dominant bacteria species. The sensitivity of K. variicola to 10 antibiotics demonstrated that K. variicola showed a low resistance to norfloxacin, ciprofloxacin, cotrimoxazole, chloramphenicol and cefazolin, moderate resistance to gentamicin and amikacin, and high resistance to penicillin, erythromycin and ampicillin. 【Conclusion】The composition of culturable bacteria in the intestinal tract of larvae of S. frugiperda in Mangshi, Yunnan shows diversity, K. variicola is the dominant bacteria species, it shows an evident resistant to penicillin, erythromycin and ampicillin.
Key words: Spodoptera frugiperda; gut bacteria; antibiotic sensitivity; Mangshi, Yunnan
0 引言
【研究意义】昆虫肠道细菌被称为昆虫的第二套遗传密码(Zilber-Rosenberg and Rosenberg,2008),在昆虫生理和生态功能中发挥着重要作用(张振宇等,2017),食物种类和环境等均会影响昆虫肠道细菌的种类组成(McFrederick et al.,2017;高珊珊,2018)。草地贪夜蛾[Spodoptera frugiperda(J.E.Smith)]隶属于鳞翅目夜蛾科灰翅夜蛾属,是一种原产于美洲热带和亚热带地区的多食性害虫(郭井菲等,2019)。该虫于2019年1月首次入侵云南省普洱市江城县(杨学礼等,2019),到2019年10月已蔓延至我国26个省(自治区、直辖市)(姜玉英等,2019),并成为影响我国玉米生产的重要因素。因此,对草地贪夜蛾肠道细菌种类组成及其对抗生素敏感性的研究,不仅有利于草地贪夜蛾肠道细菌资源的开发利用,还能为该虫的综合防治提供依据。【前人研究进展】草地贪夜蛾肠道内含有丰富的细菌种类,且随采集地的不同而存在差异。当前,有关草地贪夜蛾肠道细菌的研究已有一些报道。美国学者Acevedo等(2017)采用传统微生物培养方法从草地贪夜蛾3龄幼虫肠道中分离出细菌,其主要种类为菠萝泛菌(Pantoea ananatis)、德维希肠杆菌(Enterobacter ludwigii)、奎尼沃纳沙雷氏菌(Serratia quinivo-rans)、解鸟氨酸拉乌尔菌(Raoultella ornithinolytica)、产酸克雷伯氏菌(Klebsiella oxytoca)和分散泛菌(P. dispersa); Almeida等(2017)采用分离培养法从巴西草地贪夜蛾肠道中发现7属10种细菌,其中铅黄肠球菌(Enterococcus casselifavus)和蒙氏肠球菌(E. mundtii)为优势种;顾偌铖等(2019)、唐运林等(2019)运用传统培养法分离重庆市巫山和巫溪地区的草地贪夜蛾幼虫肠道细菌,并通过16S rDNA测序鉴定出8个属的细菌,其中克雷伯氏菌属(Klebsiella)丰度最高,且多样性水平较高;李青晏等(2020)对采自云南蒙自的草地贪夜蛾的幼虫和成虫中肠细菌进行分离培养,发现草地贪夜幼虫与成虫肠道中主要优势菌存在差异,其中幼虫肠道中克雷伯氏菌属(Klebsiella)丰度最高,成虫肠道中不动杆菌属(Acinetobacter)丰度最高;张凌英等(2020)从云南省江城县玉米田中采集的草地贪夜蛾幼虫肠道中分离出8属12种内生菌,其中以肠球菌属(Enterococcus)为优势属、蒙氏肠球菌为优势种。【本研究切入点】云南省芒市周年种植玉米,为草地贪夜蛾周年繁殖提供了便利条件,然而,对于该区域草地贪夜蛾幼虫肠道内可培养细菌种类组成及其对抗生素的敏感性尚不清楚。【拟解决的关键问题】采用常规分离培养法对云南省德宏州芒市玉米田草地贪夜蛾5龄幼虫肠道可培养细菌进行分离培养,利用16S rDNA对细菌种类进行分子鉴定,明确该地区草地贪夜蛾幼虫肠道细菌种类,并测定优势种细菌对10种抗生素的敏感性,以期为草地贪夜蛾的绿色防控提供参考。
1 材料与方法
1. 1 试验材料
供试虫源:2019年8月26日于云南省德宏州芒市德宏经济作物技术推广站旁玉米田(东经98°34′30.31″,北纬24°25′41.6″,海拔915 m)采集草地贪夜蛾5龄幼虫。
主要试剂:2×Taq PCR MasterMix(北京全式金生物科技有限公司),Goldview核酸染料(上海赛百盛基因技术有限公司),引物Prime1(27F:5'-AGAG TTTGATCCTGGCTCAG-3')和Prime2(1492R:5'-C GGTTACCTTGTTACGACTT-3')[由英潍基(上海)贸易有限公司合成],琼脂糖[基因科技(上海)有限公司],抗生素药敏片10种[青霉素G纸片(10 μg/片)、诺氟沙星(10 μg/片)、红霉素(15 μg/片)、庆大霉素(10 μg/片)、环丙沙星(5 μg/片)、复方新诺明(23.75/1.25 μg/片)、氯霉素(30 μg/片)、阿米卡星(30 μg/片)、头孢唑林(30 μg/片)和氨苄西林(10 μg/片),均由杭州微生物试剂有限公司生产]。
LB培养基:胰化蛋白胨1.0 g,酵母提取物0.5 g,NaCl 1.0 g,琼脂2.0 g,蒸馏水100 mL,pH 7.0 (符运会等,2018)。
1. 2 草地贪夜蛾肠道细菌的分离及形态鉴定
选取草地贪夜蛾5龄幼虫5头,在灭菌处理过的指形管中饥饿处理24 h,用无菌水清洗1 min,再置于75%酒精中消毒3 min,最后于无菌水中清洗。用镊子从虫体尾部取出肠道,小心去除前肠、后肠和马氏管,然后置于1.5 mL离心管中,加入少量生理盐水,用枪头小心研磨至匀浆,后加水定容至1 mL(郑亚强等,2017),以此为原液备用。将原液离心1 min (2000 r/min),取上清液稀释至10-3、10-4、10-5和10-6浓度梯度,用移液枪分别取100 ?L溶液,分别加入LB培养基中用稀释涂布平板法涂布均匀,每个浓度重复3次,置于温度(25±1)℃、光周期L∶D=16 h∶8 h的光照培养箱[恒立(中国)实验室设备科技有限公司,型号RG-300]中培养48 h(孙博通等,2017)。统计各培养基上菌落颜色、形态和细菌菌落数量,挑取單菌落到新的LB培养基上,用平板划线法将其分离形成纯化单菌株。采用革兰氏染色法对细菌进行染色,在显微镜下观察纯化菌落的细胞形态。
1. 3 分离菌株的分子鉴定
向灭菌的1.5 mL PCR管中分别加入500 ?L无菌水,用灭菌接种针挑取已纯化的单个菌株于无菌水中,将菌液在快速振荡器上振荡至浑浊,于液氮冰冻10 min,沸水中水浴5 min,再离心2 min(12000 r/min,4 ℃),最后取出上清液于1.5 mL PCR管作为PCR模板备用。使用细菌通用引物(27F和1492R)扩增16S rDNA基因。PCR反应体系25.0 ?L: Template DNA 1.0 μL,上、下游引物各1.0 μL,2×Taq PCR MasterMix 12.5 μL、ddH2O 9.5 μL。扩增程序:94 ℃预变性5 min;94 ℃ 1 min,53 ℃ 1 min,72 ℃ 2 min,进行32个循环;72 ℃延伸10 min;4 ℃保存。将扩增产物送至生工生物工程(上海)股份有限公司测序。将测序所得的16S rDNA序列提交至NCBI(GenBank)数据库与已登录基因序列进行BLAST比对。
1. 4 抗生素敏感性试验
将鉴定得到的优势细菌按2%接种量接种于100 mL LB液体培养基中,37 ℃、180 r/min培养24 h。将培养好的菌液8000 r/min离心10 min,取上清液5 mL作为待测液(陈雅茜,2018)。吸取100 μL待测液均匀涂布于LB固体培养基上,加盖后室温下放置10 min,用无菌镊子将药敏纸片轻轻贴于培养基上,每种药敏片重复3次,置于温度(25±1)℃,光周期L∶D=16 h∶8 h的光照培养箱中培养48 h,十字交叉法测抑菌圈直径,根据如下标准判定细菌的抗生素敏感性水平(李文红等,2015):抑菌圈直径<10.00 mm为强耐药性,记为R;10.00 mm≤抑菌圈直径<15.00 mm为中等耐药性,记为I;抑菌圈直径≥15.00 mm为低耐药性,记为S。
1. 5 统计分析
观察和记录各培养基上菌落颜色、形态和大小各异细菌菌落的数量,利用DPS 16.05数据处理系统中多重比较Duncans法对各种菌落数量进行差异显著性分析(唐启义,2010)。根据培养基上各菌株的培养情况,计算各菌株的相对多度。
相对多度(%)=某种菌的菌落数/总菌落数×100
2 结果与分析
2. 1 草地贪夜蛾5龄幼虫肠道中可培养细菌的培养性状及形态
从LB培养基上得到8株细菌,其中共有6种颜色、形状、大小各异的细菌菌落(表1)。菌落形态基本为圆形且边缘整齐;颜色有乳白色、姜黄色和橙色;有3株菌株呈半透明状,4株呈不透明状,1株菌株中央不透明边缘半透明,均有光泽;革兰氏染色发现有4株呈阴性,4株为阳性。菌体形态有2种,其中杆状有3株,球形有5株。
2. 2 草地贪夜蛾5龄幼虫肠道细菌的16S rDNA鉴定结果
将从草地贪夜蛾肠道中分离出的8株可培养细菌,运用16S rDNA序列分析法进行鉴定,将拼接好的16S rDNA序列提交到NCBI数据库中进行BLAST同源性比对,同源性大于97%的聚为统一单元(何彩,2012)。由表2可看出,有2株菌与鹑鸡肠球菌(E. gallinarum)的相似性在98.00%以上,1株菌与蒙氏肠球菌(E. mundtii)的相似性为99.38%,1株菌与金黄微杆菌(Chryseomicrobium aureum)的相似性为99.15%,2株菌与变栖克雷伯氏菌(K. variicola)的相似性在99.05%以上,1株菌与普罗威登斯菌(Providencia vermicola)的相似性为99.28%,1株菌与Kocuria hima-chalensis的相似性为99.00%。综合形态学和16S rDNA鉴定结果,草地贪夜蛾5龄幼虫肠道细菌隶属于3门5科5属6种,分别为变栖克雷伯氏菌、普罗威登斯菌、鹑鸡肠球菌、蒙氏肠球菌、金黄微杆菌和K. hi-machalensis。
2. 3 草地贪夜蛾5龄幼虫肠道中可培养细菌种类的相对多度
从各分离菌株在LB培养基上培养生长的相对多度来看,以变栖克雷伯氏菌的相对多度最高,为44.00%,K. himachalensis最低,为6.67%,变栖克雷伯氏菌是草地贪夜蛾5龄幼虫肠道中的优势种(表3)。6种菌株在LB培养基上的数量不同,存在显著差异(F=8.728,P<0.01)。
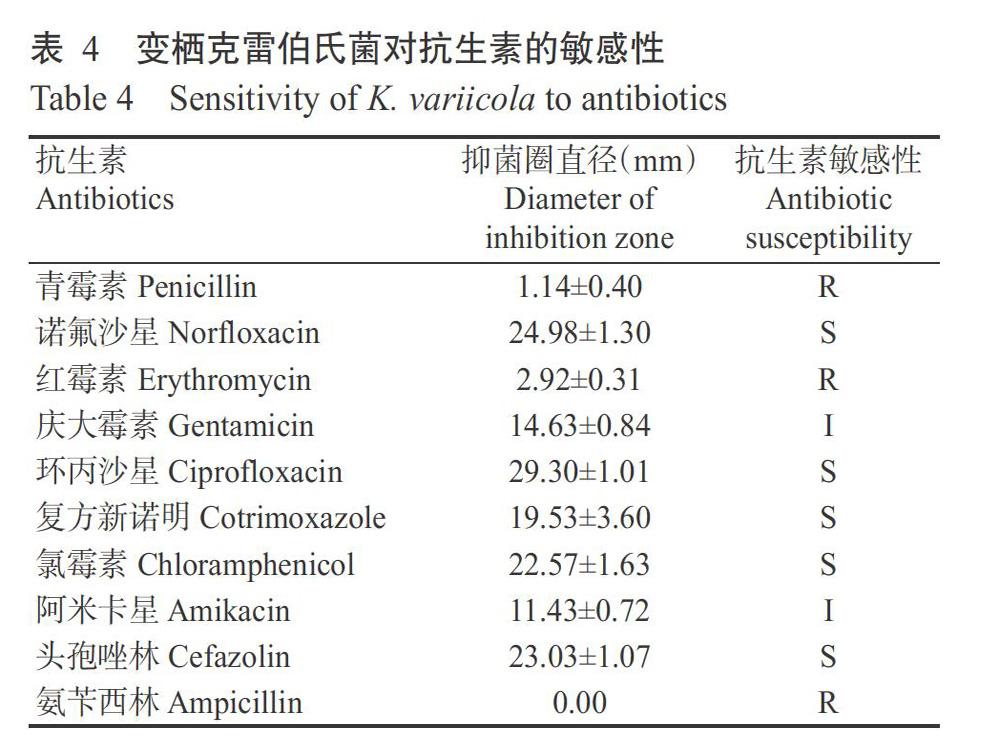
2. 4 变栖克雷伯氏菌对10种抗生素的敏感性测定结果
由表4和图1可知,供试10种抗生素对变栖克雷伯氏菌的抑菌圈直径大小依次为环丙沙星>诺氟沙星>头孢唑林>氯霉素>复方新诺明>庆大霉素>阿米卡星>红霉素>青霉素>氨苄西林。根据敏感性判定标准,变栖克雷伯氏菌对诺氟沙星、环丙沙星、复方新诺明、氯霉素和头孢唑林敏感,表现为低耐药性;对庆大霉素和阿米卡星中等敏感,即中等耐药性;对青霉素、红霉素和氨苄西林的敏感性较弱,表现为强耐药性。
3 讨论
昆虫肠道细菌组成及结构受多方面因素的影响,其中昆虫的取食对昆虫肠道细菌的影响最大(杨云秋等,2018)。本研究运用传统的微生物培养法从云南省德宏州芒市玉米田草地贪夜蛾5龄幼虫肠道中分离得到8株细菌,隶属于3门5科5属6种,其中克雷伯氏菌属细菌为优势属细菌。已有众多研究从草地贪夜蛾幼虫肠道中分离到克雷伯氏菌属(Acevedo et al.,2017;顾偌铖等,2019;唐运林等,2019;张凌英等,2020)。克雷伯氏菌普遍存在于玉米茎叶、根部及土壤中,对植物生长及代谢具有促进作用(李梦娇等,2014;韦俊宏等,2019;徐淑霞等,2019)。Dantur等(2015)证明小蔗杆草螟(Diatraea saccha-ralis)肠道内变栖克雷伯氏菌属具有较强的水解能力,能降解甘蔗渣和其他甘蔗残余废物。草地贪夜蛾幼虫肠道内克雷伯氏菌是否来源于所取食的玉米,以及是否在草地贪夜蛾对取食玉米的降解中发挥重要功能值得进一步探究。此外,本研究分离到的金黄微杆菌和K. himachalensis两种细菌在已有报道的文献中并未分离到,究其原因可能与地理位置、宿主植物、培养基种类及昆虫龄期等差异有关,但具体原因有待进一步探究。本研究仅利用培养法研究了云南省芒市草地贪夜蛾5龄幼虫肠道可培养细菌种类,因而对于不可培养细菌种类尚不清楚。因此,为了弄清该地区草地贪夜蛾幼虫肠道内细菌多样性,有必要采用高通量测序法对不可培养细菌种类进行研究。本研究中分离培养的肠道优势细菌对主要抗生素药敏测定结果表明,变栖克雷伯氏菌对诺氟沙星、环丙沙星、复方新诺明、氯霉素和头孢唑林敏感,对庆大霉素和阿米卡星中等敏感,对青霉素、红霉素和氨苄西林敏感性较弱,存在天然耐药现象。肠杆菌科细胞能产生大环内酯2'?磷酰转移酶及红霉素酯酶破坏红霉素的结构,从而产生耐药性(韦立志等,2019)。导致肠杆菌科细菌对属于β?内酰胺类抗生素的青霉素耐药的主要原因是肠杆菌科细菌能产生碳青霉烯酶,可将β-内酰胺类的抗生素进行水解(李想等,2020)。而肠杆菌科细菌对同属于β?内酰胺类抗生素的头孢唑林敏感,推测该菌产生的碳青霉烯酶为D类碳青霉烯酶,该酶不能水解头孢菌素類抗生素,但对苯唑西林等青霉素类抗生素的水解活性很强(鄂心蕊等,2019)。肠道天然耐药性菌株为进一步研究草地贪夜蛾所携带的天然耐药性基因及该基因的解毒抗性机制提供了良好的研究素材。
4 结论
云南省芒市草地贪夜蛾幼虫肠道可培养细菌种类组成多样,主要包括变栖克雷伯氏菌、蒙氏肠球菌、鹑鸡肠球菌、普罗威登斯菌、K. himachalensis和金黄微杆菌,其中变栖克雷伯氏菌为优势种。优势细菌变栖克雷伯氏菌对诺氟沙星、环丙沙星、复方新诺明、氯霉素和头孢唑林敏感,表现为低耐药性;对庆大霉素和阿米卡星中等敏感,表现为中等耐药性;对青霉素、红霉素和氨苄西林的敏感性较弱,表现为强耐药性。
参考文献
陈雅茜. 2018. 3株芽孢杆菌益生特性的初步研究与鉴定[D]. 太原:山西大学. [Chen Y Q. 2018. Primary study of probiotic characteristics and identification of 3 Bacillus strains[D]. Taiyuan: Shanxi University.]
鄂心蕊,席健峰,徐义,范缜,李慧玲,王勇. 2019. 耐碳青霉烯类肺炎克雷伯菌耐药机制的研究进展[J]. 山东化工,48(23): 80-81. [E X R,Xi J F,Xu Y,Fan Z,Li H L,Wang Y. 2019. Advances in research on resistance mechanism of carbapenem-resistant Klebsiella pneumoniae[J]. Shandong Chemical Industry,48(23): 80-81.]
符运会,屈建航,张璐洁,马文文,卢斌斌,李海峰. 2018. 不同培养基凝固剂对水体沉积物中可培养细菌多样性的影响[J]. 南方农业学报,49(9): 1787-1793. [Fu Y H,Qu J H,Zhang L J,Ma W W,Lu B B,Li H F. 2018. Effects of different medium coagulators on diversity of culturable bacteria in water sediments[J]. Journal of Southern Agriculture,49(9): 1787-1793.]
高珊珊. 2018. 三种鳞翅目玉米穗虫幼虫肠道细菌多样性研究[D]. 泰安:山东农业大学. [Gao S S. 2018. Diversity of intestinal bacteriae in three Lepidopteran larvae dama-ging maize ears[D]. Taian: Shandong Agricultural University.]
顾偌铖,唐运林,吴燕燕,邹祥明,张祯,牛小慧,王泽乐,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2019. 重庆巫山地区采食玉米的草地贪夜蛾肠道细菌的分离鉴定补遗[J]. 西南大学学报(自然科学版),41(8): 1-5. [Gu R C,Tang Y L,Wu Y Y,Zou X M,Zhang Z,Niu X H,Wang Z L,Chen J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2019. Addendum of gut bacteria isolation and identification of Spodoptera frugiperda feeding on maize in Wushan,Chongqing[J]. Journal of Southwest University(Natural Science Edition),41(8): 1-5.]
郭井菲,何康来,王振营. 2019. 草地贪夜蛾的生物学特性、发展趋势及防控对策[J]. 应用昆虫学报,56(3): 361-369.[Guo J F,He K L,Wang Z Y. 2019. Biological characteris-tics,trend of fall armyworm Spodoptera frugiperda,and the strategy for management of the pest[J]. Chinese Journal of Applied Entomology,56(3): 361-369.]
何彩. 2012. 粘虫幼虫肠道细菌群的分子鉴定[D]. 杨凌:西北农林科技大学. [He C. 2012. Molecular identification of the intestinal bacterial community of Mythimna separata(Walker) larvae[D]. Yangling: Northwest A & F University.]
姜玉英,刘杰,谢茂昌,李亚红,杨俊杰,张曼丽,邱坤. 2019. 2019年我国草地贪夜蛾扩散为害规律观测[J]. 植物保护,45(6): 10-19. [Jiang Y Y,Liu J,Xie M C,Li Y H,Yang J J,Zhang M L,Qiu K. 2019. Observation on law of diffusion damage of Spodoptera frugiperda in China in 2019[J]. Plant Protection,45(6): 10-19.]
李梦娇,彭晟,徐绍忠,余代宏, 赵明富,文国松. 2014. 克雷伯氏菌在农业与环境治理上的应用[J]. 生物技术进展,4(6): 415-420. [Li M J,Peng S,Xu S Z,Yu D H,Zhao M F,Wen G S. 2014. Application of Klebsiella spp. in agriculture and environmental management[J]. Current Biotechnology,4(6): 415-420.]
李青晏,唐运林,蒋睿轩,张永红,朱峰,白兴荣,顾偌铖,吴燕燕,吴玉娇,陈洁,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2020. 云南地区草地贪夜蛾肠道细菌的分离及鉴定[J]. 西南大学学报(自然科学版),42(1):1-8. [Li Q Y,Tang Y L,Jiang R X,Zhang Y H,Zhu F,Bai X R,Gu R C,Wu Y Y,Wu Y J,Chen J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2020. Isolation and identification of gut bacteria of Spodoptera frugiperda feeding on maize in Yunnan,China[J]. Journal of Southwest University(Natural Science Edition),42(1): 1-8.]
李文红,金道超,金剑雪,程英,李凤良. 2015. 基于幼虫粪便的小菜蛾肠道细菌分离鉴定及其抗生素敏感性分析[J]. 昆虫学报,58(5): 546-552. [Li W H,Jin D C,Jin J X,Cheng Y,Li F L. 2015. Isolation,identification and antibiotic susceptibility testing of gut bacteria from larval feces of the diamondback moth,Plutella xylostella(Lepidoptera:Plutellidae)[J]. Acta Entomologica Sinica,58(5): 546-552.]
李想,李萍,韓奎文. 2020. 肠杆菌科细菌感染的耐药性分析及分布特点[J]. 智慧健康,6(1): 9-10.[Li X,Li P,Han K W. 2020. Drug resistance analysis and distribution characteristics of Enterobacteriaceae bacterial infections[J]. Smart Healthcare,6(1): 9-10.]
孙博通,蓝波妙,王倩,夏晓峰,尤民生. 2017. 斜纹夜蛾幼虫肠道细菌分离鉴定及其功能初步分析[J]. 生物资源,39(4): 264-271. [Sun B T,Lan B M,Wang Q,Xia X F,You M S. 2017. Isolation and preliminary functional ana-lysis of the larval gut bacteria from Spodoptera litura[J]. Biotic Resources,39(4): 264-271.]
唐啟义. 2010. DPS数据处理系统[M]. 北京:科学出版社. [Tang Q Y. 2010. Data processing system[M]. Beijing: Science Press.]
唐运林,吴燕燕,顾偌铖,邹祥明,张祯,牛小慧,王泽乐,陈洁,吴玉娇,李田,李春峰,韦俊宏,潘国庆,周泽扬. 2019.重庆地区草地贪夜蛾肠道细菌的分离鉴定[J]. 西南大学学报(自然科学版),41(7): 8-14. [Tang Y L,Wu Y Y,Gu R C,Zou X M,Zhang Z,Niu X H,Wang Z L,Chen J,Wu Y J,Li T,Li C F,Wei J H,Pan G Q,Zhou Z Y. 2019. Isolation and identification of gut bacteria of Spodoptera frugiperda that migrated to Chongqing area[J]. Journal of Southwest University(Natural Science Edition),41(7): 8-14.]
韦俊宏,唐运林,顾偌铖,吴燕燕,邹详明,张祯,陈洁,李春峰,潘国庆,周泽扬. 2019. 重庆地区玉米叶内生细菌的分离及其与草地贪夜蛾肠道菌的比较[J]. 西南大学学报(自然科学版),41(9): 17-23. [Wei J H,Tang Y L,Gu R C,Wu Y Y,Zou X M,Zhang Z,Chen J,Li C F,Pan G Q,Zhou Z Y. 2019. Isolation and identification of endophytic bacteria of maize leaf in Chongqing area and comparison between maize microbes and gut bacteria of Spodoptera frugiperda[J]. Journal of Southwest University(Natural Science Edition),41(9): 17-23.]
韦立志,李发娟,何乃奥. 2019. 大环内酯类抗生素作用机制及耐药机制和应用的研究进展[J]. 临床合理用药杂志,12(15): 175-178. [Wei L Z,Li F J,He N A. 2019. Research progress on the mechanism of anction,drug resistance and application of macrolide antibiotics[J]. Chinese Journal of Clinical Rational Drug Use,12(15): 175-178.]
徐淑霞,王晓雅,张来星,曹子敬,杜文涛,孙强,张继冉,吴坤. 2019. 克雷伯氏菌(Klebsiella) Z3的分离鉴定和对铬(Ⅵ)还原特性研究[J]. 河南农业大学学报,53(3):385-392. [Xu S X,Wang X Y,Zhang L X,Cao Z J,Du W T,Sun Q,Zhang J R,Wu K. 2019. Study on isolation,identification and Cr(Ⅵ) reducing characteristics of Klebsiella Z3[J]. Journal of Henan Agricultural University,53(3):385-392.]
杨学礼,刘永昌,罗茗钟,李依,王文辉,万飞,姜虹. 2019. 云南省江城县首次发现迁入我国西南地区的草地贪夜蛾[J]. 云南农业,(1): 72. [Yang X L,Liu Y C,Luo M Z,Li Y,Wang W H,Wan F,Jiang H. 2019. Spodoptera frugiperda that migrated to southwest China has been found for the first time in Jiangcheng County,Yunnan Province [J]. Yunnan Agriculture,(1): 72.]
杨云秋,张勇,陈亦然,张灿,赵天宇,龙雁华. 2018. 昆虫肠道细菌的功能和研究方法[J]. 安徽农业大学学报,45(3): 512-518. [Yang Y Q,Zhang Y,Chen Y R,Zhang C,Zhao T Y,Long Y H. 2018. Function and research methods of insect intestinal bacteria[J]. Journal of Anhui Agricultural University,45(3): 512-518.]
张凌英,苏造堂,徐天梅,张志红,郑亚强,桂富荣,陈斌. 2020. 云南普洱江城县草地贪夜蛾幼虫肠道中可培养细菌的分离及鉴定[J]. 环境昆虫学报,42(1):60-67. [Zhang L Y,Su Z T,Xu T M,Zhang Z H,Zheng Y Q,Gui F R,Chen B. 2020. Isolation and identification of culturable intestinal bacteria of Spodoptera frugiperda in Jiangcheng,Puer,Yunnan Province[J]. Journal of Environmental Entomology,42(1): 60-67.]
张振宇,圣平,黄胜威,赵永顺,张宏宇. 2017. 昆虫肠道微生物的多样性、功能及应用[J]. 生物资源,39(4): 231-239.[Zhang Z Y,Sheng P,Huang S W,Zhao Y S,Zhang H Y. 2017. Diversity,function and application of insect gut microbiota[J]. Biotic Resources,39(4): 231-239.]
郑亚强,杜广祖,李亦菲,陈斌,李正跃,肖关丽. 2017. 马铃薯块茎蛾肠道细菌分离鉴定及其对植物源大分子化合物的降解作用[J]. 环境昆虫学报,39(3): 525-532. [Zheng Y Q,Du G Z,Li Y F,Chen B,Li Z Y,Xiao G L. 2017. Isolation and identification of bacteria from larval gut of the potato tuberworm,Phthorimaea operculella(Zeller) and the degradation for plant-based macromolecular compounds[J]. Journal of Environmental Entomology,39(3): 525-532.]
Acevedo F E,Peiffer M,Tan C W,Stanley B A,Stanley A,Wang J,Jones A G,Hoover K,Rosa C,Luthe D,Felton G. 2017. Fall armyworm-associated gut bacteria modulate plant defense responses[J]. Molecular Plant-Microbe Interactions I,30(2):127-137.
Almeida L G,Moraes L A B,Trigo J R,Omoto C,C?nsoli F L. 2017. The gut microbiota of insecticide-resistant insects houses insecticide-degrading bacteria: A potential source for biotechnological exploitation[J]. PLoS One,12(3): e0174754.
Dantur K I,Enrique R,Welin B,Castagnaro A P. 2015. Isolation of cellulolytic bacteria from the intestine of Diatraea saccharalis larvae and evaluation of their capacity to degrade sugarcane biomass[J]. AMB Express,5:15.
McFrederick Q S,Thomas J M,Neff J L,Vuong H Q,Russell K A,Hale A R,Mueller U G. 2017. Flowers and wild megachilid bees share microbes[J]. Microbial Ecology,73(1): 188-200.
Zilber-Rosenberg I,Rosenberg E. 2008. Role of microorgani-sms in the evolution of animals and plants:The hologenome theory of evolution[J]. Fems Microbiology Reviews,32(5): 723-735.
(責任编辑 麻小燕)
