广州地区一株绿僵菌的鉴定及其对草地贪夜蛾的致病力测定
2020-08-11雷妍圆王德森薛志洪吕利华黄少华章玉苹
雷妍圆 王德森 薛志洪 吕利华 黄少华 章玉苹

摘要:【目的】尋找草地贪夜蛾(Spodoptera frugiperda)致病性昆虫病原真菌,以丰富广东省本地的昆虫病原真菌资源库,为开展草地贪夜蛾微生物防治提供研究材料。【方法】对采自广东省广州市增城区荔城镇玉米地的感菌草地贪夜蛾幼虫体表病原真菌进行微生物常规分离纯化,采用形态学和ITS-rDNA序列分析相结合的方法对病原真菌进行鉴定,通过3种不同培养基(PDA、SMAY和添加草地贪夜蛾蛹壳PDA培养基)测定病原真菌菌落生长速率和产孢量,并采用浸虫法研究病原真菌对草地贪夜蛾2龄幼虫的致病力。【结果】从感菌草地贪夜蛾幼虫上分离获得病原真菌,编号GZSF-1,经鉴定为莱氏绿僵菌(Metarhizium rileyi)。培养基类型对菌株GZSF-1菌丝生长和产孢存在显著影响(P<0.05),菌株在各培养基上的生长速率为0.76~2.10 mm/d,产孢量为0.33×106~21.67×106孢子/mL,其中在添加蛹壳PDA培养基上的生长速度最快且可获得最大产孢量。菌株GZSF-1接种草地贪夜蛾2龄幼虫后,随孢子悬浮液浓度的升高,幼虫的感病死亡率增加,当浓度达1×109孢子/mL时,幼虫的致死中时(LT50)为3.030 d,接菌7 d后幼虫的累计校正死亡率达100.00%。应用Probit模型,得到菌株GZSF-1对草地贪夜蛾2龄幼虫的致病力回归方程 y=-4.426+0.737x,菌株GZSF-1对草地贪夜蛾2龄幼虫第7 d的致死中浓度(LC50)为1.02×106孢子/mL。【结论】从田间感菌草地贪夜蛾上分离获得的病原真菌菌株GZSF-1为莱氏绿僵菌,该菌株对草地贪夜蛾幼虫具有较好的生防潜力,具有进一步研究的价值。
关键词: 莱氏绿僵菌;草地贪夜蛾;鉴定;生物学特性;致病力;广州市
Abstract:【Objective】The pathogenic fungi against Spodoptera frugiperda were screened to enrich the resource of entomopathogenic fungi in Guangdong for S. frugiperda biocontrol. 【Method】Fungi infected S. frugiperda larvae were collected from corn field in Licheng Town, Zengcheng District, Guangzhou City, Guangdong Province. The strain were isolated by using conventional separation and purification method, the species was identified based on morphological and ITS-rDNA sequence analysis, growth and sporulation of the strain were observed on three different culture media(PDA,SMAY, and PDA medium containing puparium powder), and the pathogenicity of the strain to S. frugiperda larvae was studied in laboratory by immersing 2nd instar larvae into serial concentrations of conidial suspension. 【Result】The pathogen isolated form the infected larvae was identified as Metarhizium rileyi, numbered as GZSF-1. The type of culture media had significant influence on mycelial growth and sporulation of strain GZSF-1(P<0.05). The growth rate of the strain on different media was 0.76-2.10 mm/d, and sporulation was 0.33×106-21.67×106 conidia/mL. The strain GZSF-1 had good adaptability to PDA medium contained puparium powder with the fastest growth rate and largest sporulation. The mortality rates of the 2nd instar larvae caused by infection of M. rileyi strain GZSF-1 increased with the rising of concentration of conidial suspension. When the concentration reached 1×109 conidia/mL, the median lethal time(LT50) was 3.030 d. The corrected accumulative mortality for 2nd instar larvae after 10 d was 100.00%. The regression equation of the pathogenicity of strain GZSF-1 to 2nd instar larvae was y=-4.426+0.737x by using Probit model. The median lethal concentration(LC50) value of strain GZSF-1 to 2nd instar larvae on day 7 was 1.02×106 conidia/mL. 【Conclusion】The pathogen strain GZSF-1 isolated form the infected larvae was identified as M. rileyi. It has potential biocontrol effects against S. frugiperda and worth further research.
Key words: Metarhizium rileyi; Spodoptera frugiperda; identification; biological characteristics; pathogenicity; Guangzhou City
0 引言
【研究意义】草地贪夜蛾(Spodoptera frugiperda)是联合国粮农组织发出全球预警的重大迁飞性害虫,其幼虫具有寄主范围广泛、取食能力强等特点,可危害包括禾本科、菊科和豆科在内的300余种植物,尤其对玉米的危害最严重(Casmuze et al.,2010;Early et al.,2018;Montezano et al.,2018;姜玉英等,2019;张磊等,2019)。草地贪夜蛾于2019年入侵我国西南、华南等地,至目前发生区域已涉及全国26个省(自治区、直辖市),灾害形势严峻(姜玉英等,2019;廖永林等,2019;王磊等,2019;杨普云等,2019;罗举等,2020)。广东省为草地贪夜蛾的周年繁殖区域,是草地贪夜蛾入侵我国的北迁虫源地之一,防控任务艰巨。据最新的2020年1—3月广东省越冬虫情调查,在粤东、粤西、粤北及珠三角地区多个县(市)的玉米地里均可捕获一定数量的草地贪夜蛾卵、幼虫、蛹和活雄蛾,田间发生量较高,对粮食生产安全构成长期性威胁(齐国君等,2020)。目前草地贪夜蛾防控主要依赖化学农药,但过度依赖和滥用农药易对人、畜和非靶标生物造成伤害,还使害虫产生抗药性,增加防治难度(Yu et al.,2003;Ríos-Díez and Saldamando-Benjumea,2011;Carvalho et al.,2013;李永平等,2019)。利用昆虫病原真菌开展“以菌治虫”是农业害虫生物防治的核心措施之一,也是推动农药减量控害的关键手段。草地贪夜蛾入侵我国的时间较短,对其微生物防治研究起步较晚,调查采集我国草地贪夜蛾昆虫病原真菌种类并评估其防治潜能,可推动微生物杀虫剂的研究与利用,对草地贪夜蛾的可持续防控具有重要作用(Shah and Pell,2003;张礼生和陈红印,2014;Rivero-Borja et al.,2018;陈万斌等,2019;张维等,2019)。【前人研究进展】莱氏绿僵菌(Metarhizium rileyi)(原称莱氏野村菌[Nomuraea rileyi(Farlow) Samson])在世界范围内分布广泛,是侵染草地贪夜蛾及其他夜蛾科害虫的重要病原真菌(Sanchez-Pe?a,2000;Martins et al.,2005;Fronza et al.,2017;Erika et al.,2018)。据报道,墨西哥、巴西、印度等国家多个地区的田间调查均发现自然状态下被莱氏绿僵菌侵染的草地贪夜蛾幼虫(Ordó?ez-García et al.,2015;Mallapur et al.,2018;Shylesha et al.,2018;Cruz-Avalos et al.,2019;Sharanabasappa et al.,2019),尤其是3龄幼虫的感菌率最高(Habib and Patel,1990;Ruiz-Nájera et al.,2013)。一些有生防潜力的菌株,如哥伦比亚的莱氏绿僵菌分离株Nm-07,因其对草地贪夜蛾2龄幼虫100%的致死率而被选择用于菌剂研发(Bosa et al.,2004)。国内利用莱氏绿僵菌防治草地贪夜蛾的研究刚起步,正逐渐显示出潜在的优势。郑亚强等(2019)在草地贪夜蛾入侵之初报道了云南省玉米种植区该虫感菌幼虫的发生,并对莱氏绿僵菌进行了分离鉴定,以高浓度(1.0×108孢子/mL)的萊氏绿僵菌ZYSP19070接种草地贪夜蛾3龄幼虫,7 d后致死率达100%。【本研究切入点】目前,从广东省本地草地贪夜蛾原寄主上分离到病原真菌的报道较少,除程东美等(2019)报道分离出草地贪夜蛾僵虫主要致病菌为白僵菌外,尚未见其他相关研究报道。【拟解决的关键问题】采用常规分离法对广州地区野外采集的感菌草地贪夜蛾幼虫体表病原真菌进行分离纯化,采用形态学鉴定和ITS-rDNA序列分析对病原真菌进行鉴定,明确其病原种类,并对病原真菌的培养特性及其对草地贪夜蛾2龄幼虫的致病力进行评价,以丰富广东省本地的昆虫病原真菌资源库,为开展草地贪夜蛾微生物防治提供研究材料。
1 材料与方法
1. 1 供试虫源及病原菌分离培养
草地贪夜蛾幼虫采集于广东省广州市白云区钟落潭镇广东省农业科学院白云基地粤甜28甜玉米(Zea mays L.)植株上,在实验室用玉米叶和果穗饲养至化蛹,待其羽化产卵后建立实验室种群作为供试虫源。室内饲养条件为温度(28±1)℃,相对湿度60%~90%,光周期L∶D=14 h∶10 h。
昆虫病原真菌采自广东省广州市增城区荔城镇玉米地草地贪夜蛾幼虫僵虫,将带菌虫体置于灭菌培养皿(d=9 cm),在超净工作台中用接种针轻轻挑起少量孢子,采用划线法接种于麦芽糖萨氏琼脂酵母(SMAY)培养基(麦芽糖40 g/L、蛋白胨10 g/L、酵母浸膏2 g/L、琼脂20 g/L、蒸馏水1000 mL),于温度(28±1)℃,光周期L∶D=12 h∶12 h,光照强度3000 lx的恒温培养箱中培养。培养6 d后,挑取少量孢子至新的培养基纯化培养15 d,将分离纯化的菌株分生孢子置于20%的甘油中,于-80 ℃冰箱中保存备用。
1. 2 菌落培养形态观察
将分离获得的菌株分别接种于马铃薯葡萄糖琼脂(PDA)培养基(马铃薯200 g/L、葡萄糖20 g/L、琼脂20 g/L、蒸馏水1000 mL)、SMAY培养基和添加草地贪夜蛾蛹壳的PDA培养基(在PDA内,按每100 mL加入0.4 g草地贪夜蛾蛹壳粉末),各培养基pH均控制在7.0。将培养基置于温度(28±1)℃、光周期L∶D=12 h∶12 h、光照强度3000 lx的恒温培养箱中培养30 d。采用光学显微镜(Axio Scope A1,Zeiss)和扫描电镜(S-3400N,Hitachi)观察菌落形态特征、产孢结构和分生孢子形态等显微结构,在电镜视野下测量分生孢子的长、宽,测量孢子数为20~30个。
1. 3 菌株分子生物学鉴定
以分离获得的菌株基因组DNA为模板,采用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行菌株ITS-rDNA序列PCR扩增。PCR反应体系50 μL:I-5TM 2×High-Fidelity Master Mix 25 μL,DNA模板1 μL,上、下游引物各2 μL(10 μmol/L),ddH2O 20 μL。扩增程序:98 ℃预变性2 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 15 s,进行35个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后送北京擎科新业生物技术有限公司测序。
1. 4 培养基对菌株生物学特性的影响
参照雷妍圆等(2010)的方法,将分离获得的菌株分别接种于PDA、SMAY和添加蛹壳PDA培养基平板中心(各培养基量为15 mL/皿),置于温度(28±1)℃、光周期L∶D=12 h∶12 h、光照强度3000 lx的恒温培养箱中培养。每个培养基为一个处理,3次重复。采用十字交叉法每5 d定时定向测量菌落直径,共测量4次,计算生长速率(mm/d)。培养30 d后,用直径6 mm的灭菌打孔器在菌落中心至边缘1/2处打取菌块,浸入装有10 mL灭菌0.05%吐温-80溶液的烧杯(50 mL)中,振荡获取孢子,点样血球计数板,靜置后计数,计算产孢量(孢子/mL)。
1. 5 菌株对草地贪夜蛾2龄幼虫的致病力测定
以灭菌0.05%吐温-80溶液配制1.00×105、1.00×106、1.00×107、1.00×108和1.00×109孢子/mL共5个浓度梯度的分离菌株孢子悬浮液,每个浓度为一个处理,以灭菌0.05%吐温-80溶液处理为对照(CK)。采用浸虫法处理草地贪夜蛾幼虫,选取个体大小一致的草地贪夜蛾2龄幼虫,放入不同浓度供试孢子悬浮液浸渍10 s后挑出,置于滤纸上吸去多余水分,移至皿底垫有湿润滤纸片的培养皿(d=7.5 cm)中集体饲养(5头/皿),皿内放入新鲜玉米叶供其取食(王道通等,2020)。处理后的幼虫置于人工气候箱中饲养[温度(26±1)℃,相对湿度(80±5)%,光周期L∶D=14 h∶10 h]。每处理30头幼虫,3次重复,持续观察7 d。从处理后第2 d开始,每天定时记录幼虫死亡数,对死亡幼虫进行保湿观察,虫体表面长出白色菌丝或绿色分生孢子的视为感菌致死。
1. 6 统计分析
对分离获得的菌株ITS-rDNA测序结果进行编辑,去除序列两端质量差的碱基,将优化好的ITS序列提交到NCBI网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi),通过BLAST程序进行比对,得到与目的菌株具有同源性的多个菌株相应序列,从中下载同源性较高的序列,使用MEGA 7.0的邻接法(Neighbor-joining method,NJ),运行1000次bootstrap验证,构建系统发育进化树(Kumar et al.,2004),结合菌株形态生物学特征,确定菌株的系统分类地位。
试验数据经Excel 2013整理后,使用SPSS 20.0进行处理分析,统计各处理幼虫的累计死亡率和累计校正死亡率。利用Duncans新复极差法对试验数据进行差异显著性分析,采用Probit方法计算致死中时(LT50),求回归方程及计算致死中浓度(LC50)。
累计死亡率(%)=处理死亡总虫数/处理总虫数×100
累计校正死亡率(%)=(处理累计死亡率-对照累计死亡率)/(1-对照累计死亡率)×100
2 结果与分析
2. 1 菌株的分类鉴定
田间感菌草地贪夜蛾幼虫发现于玉米叶片及花穗上,感菌虫体呈白色或浅青色(图1-A和图1-B)。采用常规分离法从感菌草地贪夜蛾幼虫分离获得病原真菌,编号为GZSF-1。将菌株GZSF-1分别接种至不同培养基上培养30 d,该菌株在PDA培养基上菌落正面白色,呈短绒毛状凸起,中心至边缘1/2处有一宽约3 mm的白色环(图1-D),背面淡黄色,边缘至中心1/2处有多条深褐色辐射纹;以SMAY和添加蛹壳PDA培养基培养,菌落正面培养初期呈乳白色,约4~6 d后开始产孢,产孢后菌落变为淡绿色,培养后期孢子层逐渐加厚,形成灰绿色的孢子层(图1-E和图1-F)。分生孢子梗直立,着生于营养菌丝,营养菌丝光滑,具分隔,菌丝直径2~3 μm,未见孢梗束;分生孢子长椭圆形,表面光滑,一端略膨大,一端稍尖细,大小为5.34 μm×1.73 μm(图1-G),部分呈链状分布(图1-H),部分脱落后聚集成堆(图1-I)。
使用PCR扩增目的菌株的ITS-rDNA序列片段,测序结果显示扩增片段为596 bp,将该序列在GenBank数据库中进行BLAST比对,选取相关序列,使用MEGA 7.0将其在NCBI数据库中比对得到的序列下载,经ClustalW多重对比并采用Neighbor-joining法构建系统发育进化树(图2)。由图2可看出,与菌株GZSF-1的ITS序列同源性最高的为莱氏绿僵菌(Metarhizium rileyi NIPHM MRF-1)(GenBank登录号MK697304.1),其ITS序列相似性均在99%以上,处于进化树最小分支,亲缘关系最近。结合菌株培养和形态学鉴定结果,鉴定菌株GZSF-1为莱氏绿僵菌。
2. 2 菌株GZSF-1的培养特性
由表1可知,培养基类型对莱氏绿僵菌菌株GZSF-1的菌丝生长和产孢存在显著影响。菌株GZSF-1在PDA培养基上生长初期(前10 d)平均生长速率为1.36 mm/d,后期(后10 d)生长稍有加快,为1.79 mm/d;在添加蛹壳PDA培养基上的生长速度最快,生长后期菌落生长速率达2.10 mm/d,显著高于在其他两种培养基(P<0.05,下同)上的生长速率;在SMAY培养基上的生长速度最慢,前、后10 d的生长速率仅为0.95和0.76 mm/d,显著慢于在其他两种培养基上的生长速率。菌株GZSF-1在添加蛹壳PDA培养基上的产孢量最多,为21.67×106孢子/mL,显著高于在PDA和SMAY培养基上的产孢量,在PDA培养基上的产孢量最少,仅0.33×106孢子/mL。
2. 3 室内回接菌株GZSF-1的草地贪夜蛾2龄幼虫感染症状
以分离纯化的莱氏绿僵菌菌株GZSF-1接种草地贪夜蛾2龄幼虫,在感菌初期,幼虫取食行为、虫体外部形态与健康幼虫无差别;接种后第2 d,幼虫取食明显减少或停止取食,行动迟缓;接种后第4 d开始出现感染致死个体,感菌幼虫体表菌丝增多,腹末开始长出白色菌丝和少量淡绿色分生孢子;接种9 d后幼虫体表覆盖菌丝和灰绿色分生孢子(图1-C),感染症状与田间病症一致。
2. 4 菌株GZSF-1对草地贪夜蛾幼虫的致病力
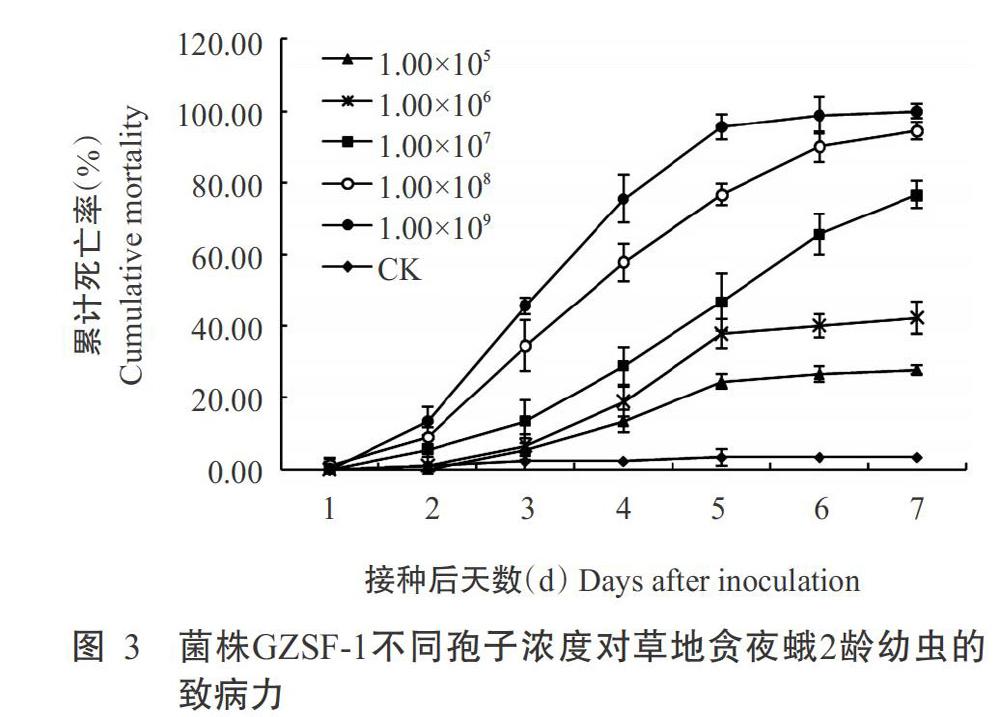
由图3可知,随着莱氏绿僵菌菌株GZSF-1孢子浓度的增加和处理时间的推移,草地贪夜蛾2龄幼虫的累计死亡率不断升高,接种后7 d,各浓度下幼虫的累计死亡率皆达最高值,其中以最高浓度孢子悬浮液(1.00×109孢子/mL)处理后幼虫的累计死亡率最高,达100.00%;孢子浓度为1.00×107、1.00×108和1.00×109孢子/mL时,分别在第6、4和4 d出现半数以上试虫死亡;孢子浓度为1.00×105和1.00×106孢子/mL时,幼虫累计死亡率均低于50.00%。
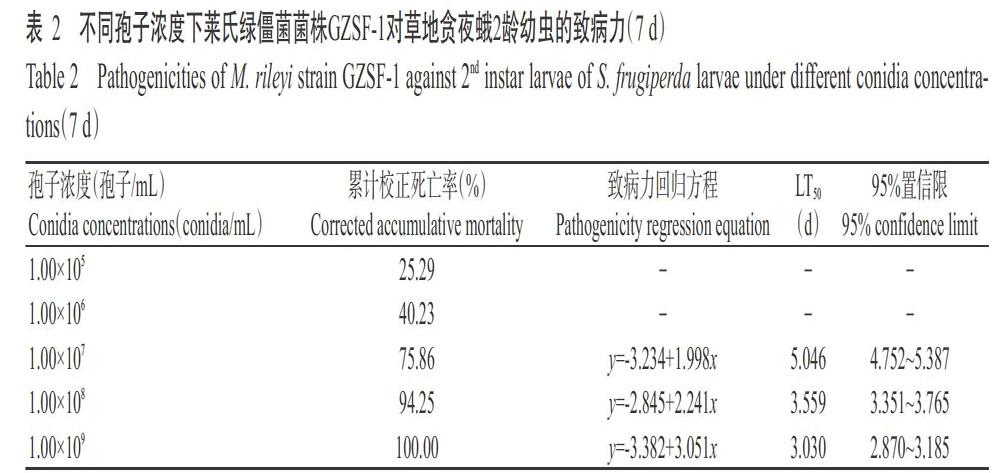
从表2可看出,莱氏绿僵菌菌株GZSF-1对草地贪夜蛾2龄幼虫的致病力存在时间—剂量效应,随孢子悬浮液浓度的增加,幼虫的LT50缩短;在浓度1.00×107~1.00×109孢子/mL内,幼虫LT50从5.046 d降至3.030 d;當浓度为1.00×105和1.00×106孢子/mL时,幼虫的最终死亡率低于50.00%,因此无法计算LT50值。应用Probit模型,得到菌株GZSF-1对草地贪夜蛾2龄幼虫的致病力回归方程 y=-4.426+0.737x,计算菌株GZSF-1处理的草地贪夜蛾2龄幼虫第7 d的LC50为1.02×106孢子/mL,95%置信区间为6.13×105~1.62×106孢子/mL。
3 讨论
研究昆虫病原真菌的最终目标是应用于农业害虫防治,而优良菌株的获得是第一步。本研究从田间采集的感菌草地贪夜蛾上分离获得一株对草地贪夜蛾具有致病性的病原真菌菌株GZSF-1,根据该菌株培养形态特征及ITS序列比对分析,鉴定其为莱氏绿僵菌。菌株GZSF-1对草地贪夜蛾2龄幼虫表现出较强的致病力,具有较高的致死率和较短的致死中时,高浓度(1.00×109孢子/mL)孢子悬浮液侵染下致死率达100.00%,LT50为3.030 d,与以往报道的草地贪夜蛾病原真菌相似,主要对低龄幼虫有一定的防治效果(García et al.,2011; Thomazoni et al.,2014; 郑亚强等,2019; Akutse et al.,2019; 雷妍圆等,2020)。相对于郑亚强等(2019)报道的云南曲靖地区一株莱氏绿僵菌ZYSP19070对草地贪夜蛾3龄幼虫100%的致死率(1.0×108孢子/mL),本研究试虫的虫龄较小且孢子浓度稍高。值得关注的是,菌株GZSF-1和ZYSP19070的原始寄主皆为草地贪夜蛾,田间也观察到该菌引起自然流行疾病,但相较于国内已报道的其他种类病原真菌的室内防效,莱氏绿僵菌对草地贪夜蛾的致病力不如非原寄主上分离的菌株(雷妍圆等,2020),其原因可能是多方面的,还需要进一步探究。
莱氏绿僵菌由于其生长繁殖受诸多因素影响,加之其产孢所需营养条件苛刻(Edelstein et al.,2004;杨新军等,2007;杜广祖等,2020),迄今为止未有商业化制剂开发。莱氏绿僵菌在培养基上初期生长为酵母状,后期向菌丝状转换。培养基若以单糖作为碳源,则主要进行繁殖生长并产生大量分生孢子;以寡糖和多糖作为碳源,则主要进行营养生长产生大量菌丝。有研究表明,适宜莱氏绿僵菌菌落生长的最佳碳源是蔗糖,最佳氮源是水解酪蛋白(孔琼等,2010);另有观点认为,适宜菌落生长的最佳碳源和氮源分别是葡萄糖和酵母浸膏(彭小东等,2013);最有利于产孢的碳源是葡萄糖(孔琼等,2010;彭小东等,2013;杨淑仪等,2016)。从本研究结果来看,莱氏绿僵菌在不同培养基上的生长状况存在较大差异。菌株GZSF-1在PDA培养基上生长较缓慢,培养30 d菌落仍以菌丝生长为主,产孢量低。在SMAY培养基上菌株产孢快,接菌后仅4 d肉眼可见菌落产生绿色孢子,但生长速度极其缓慢,说明对菌株GZSF-1而言,以麦芽糖作为碳源虽然促进了产孢,但不能满足菌落扩展和菌丝生长的要求。综合生长速率和产孢量2个指标来看,添加蛹壳PDA培养基既适合菌株GZSF-1的营养生长又适合其产孢,可能是添加了原寄主昆虫营养成分所致。莱氏绿僵菌对营养成分要求极高,且营养生长和生殖生长并不同步,这在本研究3种培养基上得到进一步印证。由于不同地理来源的菌株具有一定的生理差异,要开发利用该菌,还需针对其营养特异性需求进行最适培养基的后续研究。
虽然本研究从野外罹病虫体上分离获得一株有应用价值的病原真菌,但并不意味着具有无限的使用价值。从虫尸上分离的野生菌株多为异核体,在培养基中最初由于营养丰富,生长形成多量孢子,当营养大量消耗后,菌种常形成能忍耐贫瘠环境的次生菌丝体,这些次生菌丝体为菌丝分化出来的菌丝型同核体,转管时如果挑取了这些次生菌丝,就会形成产孢量降低的衰退菌种,进而导致对目标害虫的致病力明显下降,影响生防效果。从长远利用的角度,应通过控制菌种转管次数来保持菌株毒力及控制菌株变异。此外,对菌株进行室内培养时,除了选择适宜的培养基配方避免菌种退化外,还应给予合适的温湿度、光照时间和pH等条件,以保持菌株的稳定性(李锋,2002; 孔琼等,2010; 崔筱,2012)。从菌株分离、毒力保持到利用菌剂在田间环境中进行害虫防治,仍然面临着诸多问题。莱氏绿僵菌菌株GZSF-1在自然条件下可引起昆虫的田间流行病,而在自然条件下通常是多种病原微生物共存的状态,受多种生物及非生物因素的影响,本研究在室内环境下仅从单一菌株进行致病力评价,并未考虑多种致病性病原微生物间的叠加效应。虽然莱氏绿僵菌菌株GZSF-1对草地贪夜蛾幼虫具有较强的致病力,说明其在室内条件合适时可起到明显作用,但在实际防治中是否适应复杂的自然环境,以及如何挖掘菌株本身的潜力去适应外界条件,仍有待进一步探究。
4 结论
莱氏绿僵菌菌株GZSF-1对草地贪夜蛾幼虫具有较好的生防潜力,具有进一步研究的价值,但其产孢培养条件较苛刻,且适合在害虫低龄期应用。
参考文献:
陈万斌,李玉艳,王孟卿,刘晨曦,毛建军,陈红印,张礼生. 2019. 草地贪夜蛾的昆虫病原微生物资源及其应用现状[J]. 植物保护,45(6): 1-9. [Chen W B,Li Y Y,Wang M Q,Liu C X,Mao J J,Chen H Y,Zhang L S. 2019. Entomopathogen resources of the fall armyworm Spodoptera frugiperda,and their application status[J]. Plant Protection,45(6): 1-9.]
程东美,洪婉雯,孙辉,华宏伟,张子枫,徐汉虹,张志祥. 2019. 草地贪夜蛾幼虫僵虫发生率调查及致病菌分离鉴定[J/OL]. 环境昆虫学报,doi:10.3969/j.issn.1674-0858. 20190610002. [Cheng D M,Hong W W,Sun H,Hua H W,Zhang Z F,Xu H H,Zhang Z X. 2019. Survey on the cadaver rates of Spodoptera frugiperda and isolation of pathogenic strain[J/OL]. Journal of Environmental Entomology,doi:10.3969/j.issn.1674-0858.20190610002.]
崔筱. 2012. 虫生真菌—莱氏野生菌Nr1001菌株的生物学研究与应用[D]. 开封:河南大学. [Cui X. 2012. The biological research and application of one entomogenous fungi Nomuraea rileyi 1001[D]. Kaifeng: Henan University.]
杜广祖,张小娇,罗艳,陈斌,张立敏. 2020. 莱氏绿僵菌Nr0815分生孢子在化学农药中的相容性[J]. 河南农业科学,49(5):104-110. [Du G Z,Zhang X J,Luo Y,Chen B,Zhang L M. 2020.Storage compatibility of Metarhizium rileyi strain Nr0815 conidium in chemical pesticides[J]. Journal of Henan Agricultural Sciences,49(5):104-110.]
姜玉英,刘杰,朱晓明. 2019. 草地贪夜蛾侵入我国的发生动态和未来趋势分析[J]. 中国植保导刊,39(2): 33-35. [Jiang Y Y,Liu J,Zhu X M. 2019. Analysis on the occurrence dynamics of invasion and future trend of fall armyworm Spodoptera frugiperda in China[J]. China Plant Protection,39(2): 33-35.]
孔琼,袁盛勇,吴志刚,王传铭,李林刚,严芸. 2010. 营养物质对莱氏野村菌MZ060806生长的影响[J]. 西北农林科技大学学报(自然科学版),23(5): 1544-1547. [Kong Q,Yuan S Y,Wu Z G,Wang C M,Li L G,Yan Y. 2010. Effects of different nutrients on growth of Nomuraea rileyi MZ060806[J]. Journal of Northwest A & F University(Natural Science Edition),23(5): 1544-1547.]
雷妍圆,吕利华,何余容,梁淑仪. 2010. 玫烟色棒束孢的生物学特性与其对小菜蛾致病力的相关性[J]. 植物保护学报,37(3): 217-221. [Lei Y Y,Lü L H,He Y R,Liang S Y. 2010. Correlation between biological characteristics of Beauveria bassiana and its virulence to Plutella xylostella[J]. Acta Phytophylacica Sinica,37(3): 217-221.]
雷妍圆,吕利华,王裕华,王德森. 2020. 一株玫烟色虫草对草地贪夜蛾的致病性研究[J]. 环境昆虫学报,42(1): 68-75. [Lei Y Y,Lü L H,Wang Y H,Wang D S. 2020. Pathogenicity study of a strain of Cordyceps fumosorosea to Spodoptera frugiperda(Lepidoptera:Noctuidae)[J]. Journal of Environmental Entomology,42(1): 68-75.]
李鋒. 2002. 莱氏野村菌致病性和生物学特性的研究[D]. 北京:中国农业科学院. [Li F. 2002. Pathogencity and bio-logy of Nomuraea rileyi 1001[D]. Beijing: Chinese Aca-demy of Agricultural Sciences.]
李永平,张帅,王晓军,解晓平,梁沛,张雷,谷少华,高希武. 2019. 草地贪夜蛾抗药性现状及化学防治策略[J]. 植物保护,45(4): 14-19. [Li Y P,Zhang S,Wang X J,Xie X P,Liang P,Zhang L,Gu S H,Gao X W. 2019. Current status of insecticide resistance in Spodoptera frugiperda and stategies for its chemical control[J]. Plant Protection,45(4): 14-19.]
廖永林,李傳瑛,黄少华,潘志萍,杨斌,陈嘉瑞,王龙江,刘伟玲,章玉苹. 2019. 草地贪夜蛾首次入侵广东地区发生为害调查[J]. 环境昆虫学报,41(3): 497-502. [Liao Y L,Li C Y,Huang S H,Pan Z P,Yang B,Chen J R,Wang L J,Liu W L,Zhang Y P. 2019. Survey on the prevalence and damage of Spodoptera furgiperda first invasive in Guangdong[J]. Journal of Environmental Entomology,41(3): 497-502.]
罗举,马健,武明飞,齐国君,刘杰,唐健,胡高. 2020. 浙江入侵草地贪夜蛾的迁入虫源[J]. 中国水稻科学,34(1): 80-87. [Luo J,Ma J,Wu M F,Qi G J,Liu J,Tang J,Hu G. 2020. Original area of fall armyworm individuals newly invaded in Zhejiang Province[J]. Chinese Journal of Rice Science,34 (1): 80-87.]
彭小东,唐维媛,吕锡斌,赵雪岩,田辉,张义明. 2013. 不同营养物质对莱氏野村菌Nr16生长的影响[J]. 贵州农业科学,41(2):115-119. [Peng X D,Tang W Y,Lü X B,Zhao X Y,Tian H,Zhang Y M. 2013. Effects of different nutrient substances on growth of Nomuraea rileyi Nr16[J]. Guizhou Agricultural Sciences,41(2): 115-119.]
齐国君,黄德超,王磊,章玉苹,肖汉祥,石庆型,肖勇,苏湘宁,黄少华,邹寿发,陈科伟,周振标,钟宝玉,郑静君,张志祥,江腾辉,吕利华,陆永跃,张振飞. 2020. 广东省草地贪夜蛾冬季发生特征及周年繁殖区域研究[J/OL]. 环境昆虫学报,http://kns.cnki.net/kcms/detail/44.1640.q.20200429.1359.004.html. [Qi G J,Huang D C,Wang L,Zhang Y P,Xiao H X,Shi Q X,Xiao Y,Su X N,Huang S H,Zou S F,Chen K W,Zhou Z B,Zhong B Y,Zheng J J,Zhang Z X,Jiang T H,Lü L H,Lu Y Y,Zhang Z F. 2020. The occurrence characteristic in winter and year-round breeding region of the fall armyworm,Spodoptera frugiperda(J. E. Smith) in Guangdong Pro-vince[J/OL]. Journal of Environmental Entomology,http://kns.cnki.net/kcms/detail/44.1640.q.20200429. 1359.004.html.]
王道通,张蕾,程云霞,江幸福. 2020. 草地贪夜蛾幼虫龄期对自相残杀行为的影响[J]. 植物保护,46(3):94-98. [Wang D T,Zhang L,Cheng Y X,Jiang X F. 2020. Larval stage related cannibalism in the fall armyworm,Spodoptera frugiperda[J]. Plant Protection,46(3):94-98.]
王磊,陈科伟,钟国华,冼继东,何晓芳,陆永跃. 2019. 重大入侵害虫草地贪夜蛾发生危害、防控研究进展及防控策略探讨[J]. 环境昆虫学报,41(3): 479-487. [Wang L,Chen K W,Zhong G H,Xian J D,He X F,Lu Y Y. 2019. Pro-gress for occurrence and management and the strategy of the fall armyworm Spodoptera frugiperda(Smith)[J]. Journal of Environmental Entomology,41(3): 479-487.]
杨普云,朱晓明,郭井菲,王振营. 2019. 我国草地贪夜蛾的防控对策与建议[J]. 植物保护,45(4): 1-6. [Yang P Y,Zhu X M,Guo J F,Wang Z Y. 2019. Strategy and advice for managing the fall armyworm in China[J]. Plant Protection,45(4): 1-6.]
Cruz-Avalos A M,Bivián-Hernández M ?,Ibarra J E,Rincón-Castro M C D. 2019. High virulence of Mexican entomopathogenic fungi against fall armyworm,(Lepidoptera: Noctuidae)[J]. Journal of Economic Entomology,112(1): 99-107.
Early R,Gonzalez-Moreno P,Murphy S T,Day R. 2018. Forecasting the global extent of invasion of the cereal pest Spodoptera frugiperda,the fall armyworm[J]. NeoBiota,40: 25-50.
Edelstein J D,Lecuona R E,Trumper E V. 2004. Selection of culture media and in vitroassessment of temperature-dependent development of Nomuraea rileyi[J]. Neotropical Entomology,33(6): 737-742.
Erika P G,Carlos E,Carlos E C,Martha L C,Laura F V. 2018. Metarhizium rileyi biopesticide to control Spodoptera frugiperda: Stability and insecticidal activity under glasshouse conditions[J]. Fungal Biology,122(11): 1069-1076.
Fronza E,Specht A,Heinzen H,de Barros N M. 2017. Metarhizium (Nomuraea) rileyi as biological control agent[J]. Biocontrol Science and Technology,27(11):1243-1264.
García G C,González M M B,Bautista M N. 2011. Patogenicidad de aislamientos de hongos entomopatógenos contra Spodoptera frugiperda(Lepidoptera:Noctuidae) and Epilachna varivestis(Coleoptera: Coccinellidae)[J]. Revista Colombiana de Entomología,37(2): 217-222.
Habib M E M,Patel P N. 1990. Pathogenicity of Nomuraea rileyi (Farlow) Samson to larvae of Spodoptera frugiperda (J.E. Smith,1797),a pest of corn[J]. Revista de Agricultura (Piracicaba),65(1): 83-90.
Kumar S,Tamura K,Nei M. 2004. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics,5(2): 150-163.
Mallapur C P,Naik A K,Hagari S,Praveen T,Patil R K,Lingappa S. 2018. Potentiality of Nomuraea rileyi(Farlow) Samson against the fall armyworm,Spodoptera frugiperda(J E Smith) infesting maize[J]. Journal of Entomology and Zoology Studies,6(6): 1062-1067.
Martins T,Oliveira L,Garcia P. 2005. Larval mortality factors of Spodoptera littoralis in the Azores[J]. Biocontrol,50(5): 761-770.
Montezano D G,Specht A,Sosa-Gómez D R,Roque-Specht V F,Sousa-Silva J C. 2018. Host plants of Spodoptera frugiperda(Lepidoptera: Noctuidae) in the Americas[J]. African Entomology,26(2): 286-300.
Ordó?ez-García M,Rios-Velasco C,Berlanga-Reyes D I,Acosta-Mu?iz C H,Salas-Marina M ?,Cambero-Campos O J. 2015. Occurrence of natural enemies of Spodoptera frugiperda(Lepidoptera: Noctuidae) in Chihuahua,Mexico[J]. Florida Entomologist,98(3): 843-847.
Ríos-Díez J D,Saldamando-Benjumea C I. 2011. Susceptibility of Spodoptera frugiperda(Lepidoptera:Noctuidae) strains from central Colombia to two insecticides,methomyl and lambda-cyhalothrin: a study of the genetic basis of resistance[J]. Journal of Economic Entomology,104(5): 1698-1705.
Rivero-Borja M,Guzmán-Franco A W,Rodríguez-Leyva E,Santillán-Ortega C,Pérez-Panduro A. 2018. Interaction of Beauveria bassiana and Metarhizium anisopliae with chlorpyrifos ethyl and spinosad in Spodoptera frugiperda larvae[J]. Pest Management Science,74(9): 2047-2052.
Ruiz-Nájera R E,Ruiz-Estudillo R A,Sánchez-Yá?ez J M,Molina-Ochoa J,Skoda S R,Couti?o-Ruiz R,Pinto-Ruiz R,Guevara-Hernández F,Foster J E. 2013. Occurrence of entomopathogenic fungi and parasitic nematodes on Spodoptera frugiperda(Lepidoptera: Noctuidae) larvae collected in central Chiapas,México[J]. Florida Entomo-logist,96(2): 498-503.
Sanchez-Pe?a S R. 2000. Entomopathogens from two chihuahuan desert localitiesin Mexico[J]. BioControl,45(1): 63-78.
Shah P A,Pell J K. 2003. Entomopathogenic fungi as biological control agents[J]. Applied Microbiology and Biotechnology,61(5-6): 413-423.
Sharanabasappa,Kalleshwaraswamy C M,Poorani J,Maruthi M S,Pavithra H B,Diraviam J. 2019. Natural enemies of Spodoptera frugiperda(J.E. Smith)(Lepidoptera: Noctuidae),a recent invasive pest on maize in South India[J]. Florida Entomologist,102(3):619-623.
Shylesha A N,Jalali S K,Gupta A,Varshney R,Venkatesan T,Shetty P,Ojha R,Ganiger P C,Navik O,Subaharan K,Bakthavatsalam N,Ballal C R,Raghavendra A. 2018. Studies on new invasive pest Spodoptera frugiperda (J. E. Smith)(Lepidoptera: Noctuidae) and its natural enemies[J]. Journal of Biological Control,32(3):145-151.
Thomazoni D,Formentini M A,Alves L F A. 2014. Patogenicidade de isolados de fungos entomopatogênicos à Spodoptera frugiperda(Smith)(Lepidoptera: Noctuidae)[J]. Arquivos do Instituto Biológico,81(2): 126-133.
Yu S J,Nguyen S N,Abo-Elghar G E. 2003. Biochemical characteristics of insecticide resistance in the fall armyworm,Spodoptera frugiperda(J.E. Smith)[J]. Pesticide Biochemistry and Physiology,77(1): 1-11.
(責任编辑 麻小燕)
