梅毒患者外周血程序性死亡分子1的表达水平及临床价值研究
2020-08-11李东纯林毓岑余进胜罗世荣
林 洁,李东纯,林毓岑,余进胜,罗世荣
广东省惠州市惠东县人民医院检验科,广东惠州 516300
梅毒系苍白密螺旋体苍白亚种引起的性传播性疾病,临床表现多样,虽病程发展相对较慢,但可导致皮肤黏膜、心血管、神经、骨骼等多系统病变,不仅损害患者自身身心健康,而且危及下一代健康[1]。相关流行病学报道,我国梅毒发病率自2000年的6.43/10万增长至2013年的32.86/10万,年均增长率达13.37%,已成为重要的公共卫生问题[2]。程序性死亡分子1(PD-1)属CD28超家族成员,主要表达于活化的T淋巴细胞、B淋巴细胞表面,PD-1及其配体PD-L1或PD-L2相互作用,如与PD-L1结合后通过受体分子胞质尾部的酪氨酸激酶抑制基序激发抑制信号,从而介导负性调控[3-4]。但当前PD-1的临床研究多侧重于肿瘤疾病,甚至有以PD-1/PD-L1为治疗靶点的抗肿瘤药物,并取得一定治疗效果[5]。本研究以本院收治的60例梅毒患者为研究对象,对其外周血PD-1水平及临床意义进行分析,旨在为梅毒的临床诊治提供参考依据。
1 资料与方法
1.1一般资料 选择2018 年6 月至 2019 年 6 月在本院就诊的60例梅毒患者为研究对象(梅毒组)。纳入标准:(1)符合《中华人民共和国卫生行业标准WS273-2007》梅毒诊断要求;(2)患者知晓研究内容并签署研究知情同意书。排除标准:(1)合并梅毒以外的其他内外科疾病、感染性疾病、自身免疫性疾病;(2)既往使用抗菌药物、激素或免疫调节剂;(3)梅毒病程<2年;治疗及随访期间有不洁性生活。梅毒患者男33例,女27例;年龄22~61岁,平均(49.24±12.33)岁;<40岁27例,40~60岁20例,>60岁13例;梅毒快速血浆反应试验(RPR)滴度1∶1 13例,1∶2 15例,1∶4 21例,1∶8 11例;临床分期Ⅰ期19例,Ⅱ期41例。另选取本院同期30例体检健康志愿者作为对照组,其中男15例,女15例;年龄25~64岁,平均(20.27±12.01)岁。2组研究对象性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1仪器与试剂 PD-1酶联免疫吸附试验(ELISA)试剂盒购自上海瓦兰生物科技有限公司;酶标分析仪为Rayto RT-2100C型,流式细胞仪为CYTOMICS FC 500型,均购自美国Beckman Coulter公司;PE鼠抗人PD-1单克隆抗体购自美国BD公司;RPMI1640培养液购自美国Gibco公司;佛波酯、离子酶素购自美国Sigma公司。
1.2.2外周血PD-1水平检测 采集研究对象晨间空腹静脉血标本,乙二胺四乙酸抗凝,3 000 r/min、4 ℃条件下离心10 min分离血浆,ELISA检测外周血血浆中可溶性PD-1水平。
1.2.3流式细胞术检测细胞比例 采用流式细胞术检测外周血CD4+CD25+hight调节性T细胞(Treg)、CD4+CD25+lowTreg、CD4+CD25+lowTreg/CD4+CD25+hightTreg及其细胞上的PD-1水平。使用淋巴细胞分离液分离外周血单核细胞(PBMC),10%胎牛血清的RPMI1640培养液重悬调整细胞水平至(2.0~6.0)×107/mL,RPMI1640培养液1∶1体积稀释肝素钠抗凝的全血标本,滴加佛波酯、离子酶素充分混匀,终水平分别为10 μg/L、1 mg/L,37 ℃、5% CO2细胞培养箱培养4 h,用于PD-1分子检测。另取刺激后的肝素钠抗凝全血标本50 μL,分别滴加FITC-CD4/APC-CD25+、PE鼠抗人PD-1单克隆抗体,充分混匀后4 ℃下避光孵育30 min,加1.7% NH4Cl溶血剂混匀,室温静置5~10 min至溶血完全,1 500 r/min条件下离心5 min,弃上清液,PBS洗涤,300 μL PBS液重悬,FACSCanto检测,CYTOMICS FC500型流式细胞仪及配套分析数据,以CD4+T淋巴细胞设门读数。
1.3观察指标 (1)比较梅毒组、对照组外周血PD-1水平;(2)比较不同性别、年龄、RPR滴度、临床分期的梅毒患者外周血PD-1水平;(3)分析梅毒患者外周血PD-1与临床特征的相关性。

2 结 果
2.12组外周血PD-1水平比较 梅毒组外周血PD-1水平显著高于对照组[(56.09±8.13)pg/mLvs.(11.20±4.50)pg/mL],差异有统计学意义(t=-3.212,P=0.001)。
2.2不同临床特征的梅毒患者外周血PD-1水平比较 不同性别、年龄的梅毒患者外周血PD-1水平比较,差异无统计学意义(P>0.05);但RPR滴度为1∶8患者外周血PD-1水平显著高于1∶1、1∶2、1∶4患者,临床分期Ⅱ期患者外周血PD-1水平显著高于Ⅰ期患者,差异有统计学意义(P<0.05)。见表1。

表1 不同临床特征的梅毒患者外周血PD-1水平比较
2.3梅毒患者外周血PD-1与RPR滴度、临床分期的相关性分析 Spearman相关性分析结果显示,外周血PD-1与RPR滴度、临床分期呈正相关(r=0.659、0.433,P<0.01)。见图1。

注:A表示外周血PD-1与临床分期的相关性分析,B表示外周血PD-1与RPR滴度的相关性分析。
2.42组外周血CD4+CD25+hightTreg、CD4+CD25+lowTreg细胞比较 2组CD4+CD25+lowTreg细胞比较,差异无统计学意义(P>0.05),但梅毒组外周血CD4+CD25+hightTreg细胞显著高于对照组,CD4+CD25+lowTreg/CD4+CD25+hightTreg显著低于对照组,差异有统计学意义(P<0.05)。见表2。
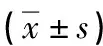
表2 2组外周血CD4+CD25+hightTreg、CD4+CD25+lowTreg细胞比较
2.52组外周血PD-1+/CD4+CD25+hightTreg、PD-1+/CD4+CD25+lowTreg细胞上的表达 梅毒组外周血PD-1+/CD4+CD25+hightTreg、PD-1+/CD4+CD25+lowTreg细胞上的表达显著高于对照组,差异有统计学意义(P<0.05)。见表3。
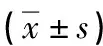
表3 2组外周血PD-1+/CD4+CD25+hightTreg、PD-1+/CD4+CD25+lowTreg细胞上的表达
3 讨 论
研究指出,PD-1及其配体PD-L1信号通路在帮助机体形成自身免疫耐受的同时,也被慢性感染病毒利用,通过这一通路削弱机体抗感染免疫,促进病毒的持续感染[6]。肖健等[7]报道,HIV感染患者CD8+T细胞PD-1存在过表达现象,不仅与病毒载量呈正相关,且体内阻断PD-1/PD-L1通路或可发挥CD8+T细胞功能,认为基于该信号通路或可为临床治疗HIV感染提供理论指导。梅毒同为慢性病毒感染性疾病,但笔者查阅文献未见PD-1在梅毒患者中的表达的报道。本研究结果显示,梅毒组外周血PD-1水平显著高于对照组,且虽不同性别、年龄的梅毒患者外周血PD-1水平比较,差异无统计学意义(P>0.05);但RPR滴度为1∶8患者外周血PD-1水平显著高于1∶1、1∶2、1∶4患者,临床分期Ⅱ期患者外周血PD-1水平显著高于Ⅰ期患者,差异有统计学意义(P<0.05)。Spearman相关性分析结果显示,外周血PD-1与RPR滴度、临床分期呈正相关。
既往研究报道,在病毒性感染疾病中,持续的病毒刺激可导致免疫损伤[8-9]。CD4+CD25+Treg细胞不仅可纠正持续病毒复制引起的免疫系统过度激活,也能抑制抵抗病毒复制的特异性免疫应答,发挥“双刃剑”的作用[10-11]。其中CD4+CD25+hightTreg作为高表达的CD4+Treg主要发挥抑制活性,可抑制自身反应性T细胞的增殖活化,其数量或功能的缺失与自身免疫性疾病的免疫平衡紊乱、疾病发生、发展密切相关[12-13]。在慢性病毒感染性疾病中,为进一步明确梅毒患者外周血PD-1的表达,本研究分析梅毒患者外周血CD4+CD25+hightTreg、CD4+CD25+lowTreg细胞及细胞表面PD-1的表达。结果显示,梅毒组与对照组CD4+CD25+lowTreg细胞比较,差异无统计学意义(P>0.05),但梅毒组外周血CD4+CD25+hightTreg细胞显著高于对照组,CD4+CD25+lowTreg/CD4+CD25+hightTreg显著低于对照组,差异有统计学意义(P<0.05),这与张明海等[14]的报道结论相似。且梅毒患者外周血PD-1+/CD4+CD25+hightTreg、PD-1+/CD4+CD25+lowTreg细胞上的表达显著高于对照组,差异有统计学意义(P<0.05)。由此可见,梅毒患者不仅外周血PD-1水平存在高表达现象,外周血CD4+CD25+hightTreg、CD4+CD25+lowTreg细胞及细胞表面PD-1也存在过度表达现象。
本研究也存在一定的局限性,除标本数量相对较少外,受标本采集时间影响,本研究未能进一步分析梅毒血浆固定患者外周血PD-1、CD4+CD25+Treg细胞及细胞表面PD-1的表达情况。另外,梅毒感染引起PD-1表达上调的确切机制、PD-1对CD4+CD25+Treg细胞的免疫调控机制等,或两者间的相互协调机制等仍未明确,笔者拟在下阶段工作中持续深入探究。
综上所述,梅毒患者不仅外周血PD-1存在过表达现象,与RPR滴度、临床分期呈正相关,且CD4+CD25+Treg细胞及细胞表面PD-1也存在过表达现象,但基于本研究局限性,其具体机制仍有待持续探究。
