脾切除小鼠肝脏和外周血免疫细胞的动态变化
2020-08-11赵奕威朱佳真王淑慧李宗芳
赵奕威,冉 轩,朱佳真,李 佳,王淑慧,李宗芳,2,江 维,2*
(1 西安交通大学第二附属医院生物诊断治疗国家地方联合工程研究中心,西安 710004;2 西安交通大学第二附属医院肿瘤病院;*通讯作者,E-mail:jiangweixjtu@163.com)
脾脏是最大的外周免疫器官,占全身淋巴细胞总量的25%,除了胚胎时期的造血功能、滤血功能、储血等功能外,还是重要的抗感染免疫和抗肿瘤免疫器官[1]。临床研究发现,因脾脏外伤而切除脾脏增加多种免疫相关疾病的发病风险,比如感染、肿瘤、2型糖尿病、肝脓肿等[2-5]。脾脏和肝脏的联系紧密,脾脏和肝脏不但通过门静脉直接联系,脾脏与肝脏之间还存在免疫对话。前期研究提示在肝病的发生发展中,脾脏作为直接与肝脏联系的免疫器官,直接参与肝病的发生发展[6]。但脾脏切除后肝脏及外周血的免疫状态发生的变化尚不清楚。因此,本研究旨在研究脾切除后小鼠肝脏和外周血免疫细胞的动态变化。
1 材料与方法
1.1 主要试剂
大鼠抗小鼠FITC-labeled CD3、大鼠抗小鼠PE-labeled CD4、大鼠抗小鼠APC-labeled CD8a、大鼠抗小鼠PE-labeled CD19、大鼠抗小鼠APC-labeled F4/80、大鼠抗小鼠FITC-labeled Ly6G、大鼠抗小鼠PE-labeled Ly6C、大鼠抗小鼠CD16/32、大鼠抗小鼠PE-cy7-labeled CD11b、大鼠抗小鼠FITC-labeled CD11c、大鼠抗小鼠Brilliant Violet 421TM-labeled CD45抗体购自美国Biolegend公司;大鼠抗小鼠PE-labeled MHCⅡ抗体购自美国eBioscience公司。
1.2 实验动物
6-8周龄雄性C57BL/6小鼠32只,体质量(20±2)g,为SPF级,购买于西安交通大学医学部实验动物中心,生产许可证号:SYXK(陕)2018-001,并饲养于西安交通大学医学部实验动物中心SPF标准动物房内。分为假手术组、脾切除1周组、脾切除2周组、脾切除4周组,每组8只;假手术组再分为3个亚组:假手术1周组(n=3)、假手术2周组(n=3)、假手术4周组(n=2)。其中假手术1周组和脾切除1周组于处死前1周行假手术或脾切除,假手术2周组和脾切除2周组于处死前2周行假手术或脾切除,假手术4周组和脾切除4周组于处死前4周行假手术或脾切除。所有小鼠在同一时间处死,取肝脏和外周血,并检测肝脏质量、计算肝脏指数,制备肝脏和外周血单细胞悬液(方法如下述),用流式细胞术检测肝脏和外周血免疫细胞的比例。实验经西安交通大学医学部伦理委员会批准。
1.3 脾切除及假手术
在紫外线灭菌后的环境下,腹腔注射4%的水合氯醛(0.1 ml/10 g体质量)麻醉小鼠,备皮并用碘伏消毒3遍,取腹部正中切口长约0.8 cm,暴露脾脏,轻轻翻出脾脏,分别用缝合线结扎脾脏上极和下极的血管,剪掉血管,脾脏即游离下来。观察血管结扎处无出血后,逐层缝合腹腔,碘伏消毒皮层后将小鼠放置于温暖的地方,保温复苏。假手术仅打开腹腔,不做脾切除术,直接缝合腹腔。
1.4 外周血及肝脏单细胞悬液制备
脾切除及假手术术后第1周、2周、4周处死小鼠后取其肝脏组织并称重,将获取的组织在70 μm细胞筛网上研磨,用含2%胎牛血清的PBS冲洗研磨后的组织,制备细胞悬液。将肝脏细胞悬液经70 μm尼龙筛网过滤,过滤后获取的细胞悬液在4 ℃、50g离心8 min,弃沉淀,取悬浮细胞,重复1次。悬浮细胞在4 ℃、450g离心8 min,弃上清,并重复1次,取沉淀细胞备用。眼球取血法采血于EDTA抗凝管中备用。将上述所取肝脏细胞悬液、血液1 ml并加入5 ml红细胞裂解液充分混匀,冰上孵育5 min,用含2%胎牛血清的PBS中止,4 ℃、350g离心5 min后取沉淀细胞并用1 ml PBS重悬,4 ℃、350g离心5 min;取其沉淀并用1 ml PBS重悬,计数,调细胞浓度为1×107-2×107个/ml,放置于冰上,备用。
1.5 流式细胞术检测肝脏和外周血免疫细胞的比例
每管吸取100 μl细胞悬液加入流式管中,用抗大鼠抗小鼠CD16/32抗体4 ℃孵育15 min,加入相应的抗体,4 ℃避光孵育30 min,后加入含1%胎牛血清的PBS 2 ml,4 ℃下350g离心5 min,弃去上清液;重复1次,最后加入0.5 ml PBS重悬,用FACS Canto Ⅱ flow cytometer(BD,美国)检测结果。
1.6 统计学分析
2 结果
2.1 肝脏质量的变化
造模期间,由于手术原因假手术组死亡1只小鼠、脾切除2周组死亡3只小鼠、脾切除4周组死亡1只小鼠。与假手术组小鼠相比,脾切除1周、2周、4周组肝脏质量与肝指数均无显著差异(P>0.05,见图1)。

图1 脾切除组与假手术组肝质量与肝指数比较Figure 1 Comparison of liver weight and liver index between splenectomy groups and sham operation group
2.2 肝脏免疫细胞的变化
与假手术组相比,脾切除4周组小鼠肝脏CD3+CD8+T细胞显著升高(13.97%±2.97%vs22.30%±3.14%,t= -5.092,P<0.01,见图2);脾切除1周、2周、4周组肝脏CD3+CD4+/CD3+CD8+均显著降低(t=2.785,2.45,-3.549,均P<0.05,见图2);而脾切除1周、2周、4周组肝脏CD3-CD19+B细胞、CD3+CD4+T细胞无显著差异(P>0.05,见图2)。

与假手术组相比较,* P <0.05,* * P <0.01图2 脾切除组与假手术组肝脏CD3 +CD8 +T细胞、CD3 +CD4 +/CD3 +CD8 +、CD3 -CD19 +B细胞以及CD3 + CD4 +T细胞的比较Figure 2 Comparison of CD3 +CD8 +T lymphocytes, the ratio of CD3 +CD4 +/CD3 +CD8 +, CD3 -CD19 +B lymphocytes, and CD3 +CD4 +T lymphocytes in liver between splenectomy groups and sham operation group
与假手术组相比,脾切除1周组肝脏CD11b+Ly6G+粒细胞显著升高(P<0.05,见图3),而脾切除1周、2周、4周组肝脏CD11b+Ly6Chi单核细胞、CD11b+Ly6Cmed单核细胞、CD11c+MHCⅡ+DC细胞、CD11bintF4/80hi枯否细胞、CD11bhiF4/80int巨噬细胞、CD11bhiF4/80intLy6Chi巨噬细胞、CD11bhiF4/80intLy6Clow巨噬细胞均无显著差异(P>0.05,见图3)。
2.3 外周血免疫细胞的变化
与假手术组小鼠相比,脾切除1周、2周、4周组外周血CD3-CD19+B细胞、CD3+CD4+T细胞、CD3+CD8+T细胞、CD3+CD4+/CD3+CD8+均无显著差异(P>0.05,见图4)。
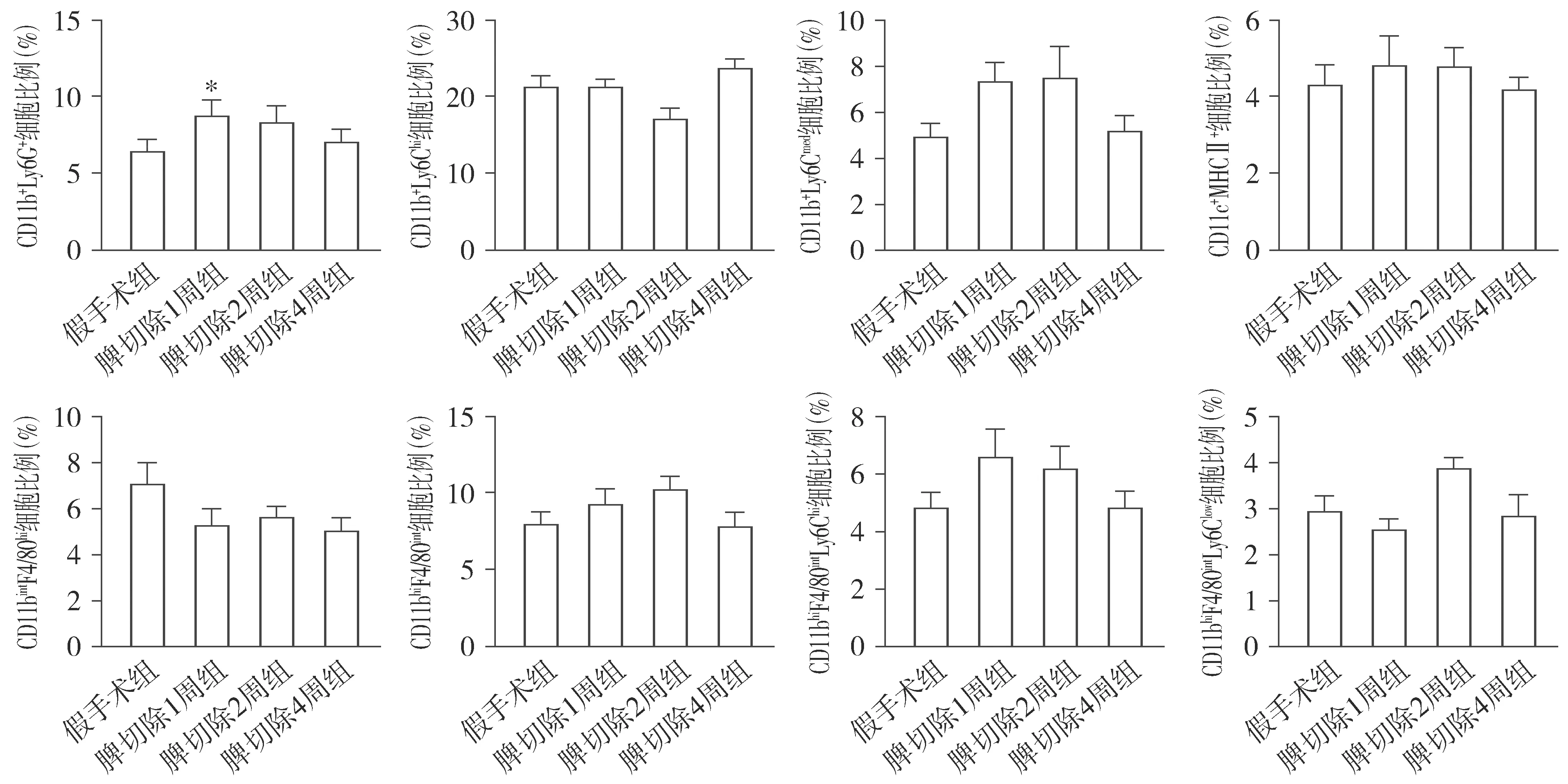
与假手术组相比较,* P <0.05图3 脾切除组与假手术组肝脏CD11b +Ly6G +粒细胞、CD11b +Ly6Chi单核细胞、CD11b +Ly6Cmed单核细胞、CD11c +MHCⅡ +DC细胞、CD11bintF4/80hi枯否细胞、CD11bhiF4/80int巨噬细胞、CD11bhiF4/80intLy6Chi巨噬细胞以及CD11bhiF4/80intLy6Clow巨噬细胞的比较Figure 3 Comparison ofCD11b +Ly6G +granulocytes,CD11b +Ly6Chimonocytes,CD11b +Ly6Cmed monocytes,CD11c +MHCⅡ +dendritic cells, CD11bintF4/80hikupffer cells, CD11bhiF4/80intmacrophages, CD11bhiF4/80intLy6Chimacrophages and CD11bhiF4/80inttLy6Clow macrophages in liver between splenectomy group and sham operation group

图4 脾切除组与假手术组外周血CD3 -CD19 +B细胞、CD3 +CD4 +T细胞、CD3 +CD8 +T细胞以及CD3 +CD4 +/CD3 +CD8 +的比较Figure 4 Comparison of CD3 -CD19 +B lymphocytes, CD3 +CD4 +T lymphocytes, CD3 +CD8 +T lymphocytes, and ratio of CD3 +CD4 +/CD3 +CD8 +in peripheral blood between splenectomy group and sham operation group
与假手术组比较,脾切除1周组外周血CD11b+Ly6G+粒细胞、CD11b+Ly6Chi单核细胞显著升高(P<0.05,见图5),而脾切除1周、2周、4周组外周血CD11b+Ly6Cmed单核细胞、CD11c+MHCⅡ+DC细胞无显著差异(P>0.05,见图5)。

与假手术组相比较,* P <0.05图5 脾切除组与假手术组外周血CD11b +Ly6G +粒细胞、CD11b +Ly6Chi单核细胞、CD11b +Ly6Cmed单核细胞以及CD11c +MHCⅡ +DC细胞的比较Figure 5 Comparison of CD11b +Ly6G +granulocytes, CD11b +Ly6Chimonocytes, CD11b +Ly6Cmed monocytes, and CD11c +MHCⅡ +dendritic cells in peripheral blood between splenectomy group and sham operation group
3 讨论
在病理状态下,脾切除直接影响外周血和肝脏组织的免疫细胞分布。文献报道切除晚期荷瘤小鼠的脾脏能够减少外周血和肿瘤组织髓源抑制性细胞(MDSC)的比例而升高CD8+T细胞的比例,延长小鼠的生存期[7]。脾切除能阻断慢性应激引起的外周血CD4+T细胞与CD8+T细胞比例的变化[8]。但上述研究均是在病理模型上进行,临床研究发现外伤脾切除增加多种免疫相关疾病的发病风险,比如感染、肿瘤、2型糖尿病、肝脓肿等,但脾脏切除后肝脏及外周血的免疫状态发生的变化尚不清楚[2-5]。因此,本文研究脾切除后小鼠肝脏和外周血免疫细胞的动态变化具有重要意义。本研究结果显示脾切除术后肝脏CD3+CD4+/CD3+CD8+持续降低,术后1周肝脏CD11b+Ly6G+粒细胞升高,而术后1周外周血CD11b+Ly6Chi单核细胞、CD11b+Ly6G+粒细胞升高,提示脾脏在维持机体免疫稳态中具有重要作用。
脾脏是机体最大的外周免疫器官,也是重要的髓外造血部位,参与多种疾病的发生发展,比如肝炎肝硬化、肿瘤、心脑血管疾病等[9-11]。脾脏和肝脏不仅在解剖学上通过门静脉直接联系,在免疫学上,肝和脾相互作用、相互影响,共同在清除病原、维持机体稳态中扮演重要角色[6]。前期研究结果[12-15]也表明肝脾之间相互影响,存在免疫对话;比如肝癌发生后,脾脏质量和脾指数明显增大,脾脏红髓增大、白髓减小,同时脾脏处于免疫抑制状态,脾脏中免疫抑制性细胞如MDSC、调节T细胞明显增多,而免疫活性细胞如CD3+T细胞、CD4+T细胞、CD8+T细胞、NK细胞明显降低,切除脾脏可降低肝癌组织中MDSC的比例。由此可看出,肝脏和脾脏之间存在着紧密的联系。本研究结果显示脾切除术后肝脏CD3+CD4+/CD3+CD8+持续降低,术后1周肝脏CD11b+Ly6G+粒细胞升高,提示脾脏在维持肝脏区域免疫稳态中仍具有重要作用。其机制可能是脾切除后脾脏清除机体病原微生物的功能缺失,由门静脉进入肝脏的病原物增多造成肝脏免疫细胞比例失调,但其具体机制仍需进一步研究。
脾脏作为重要的免疫器官清除微生物,而脾切除能增加感染的风险[15]。文献报道脾切除患者细菌性肝脓肿的发病风险增加,其原因可能是脾切除后机体免疫功能受损[4]。而脾脏具有滤血作用,脾脏过滤后的血液通过门静脉进入肝脏,然而脾切除后血液中的病原微生物直接进入肝脏,其可能增加肝脏病原物生物的数量,因此肝脏的免疫状态可能会发生改变,而CD3+CD8+T细胞是抵御病原微生物的重要细胞。该研究表明脾切除小鼠与假手术小鼠相比,肝脏质量与肝指数虽然无显著差异,但是脾切除术后4周肝脏CD3+CD8+T细胞显著升高,肝脾CD3+CD4+/CD3+CD8+在术后1周、2周、4周均显著降低。这可能是由于脾脏切除术后脾脏的滤血功能缺失,由门静脉进入肝脏的病原物增多造成,但其具体机制仍需进一步研究。
应激能增加外周血单核细胞、粒细胞等免疫细胞的比例[14,16],而脾切除手术相对与假手术而言恢复较慢,是一个应激源。该研究还显示脾切除术后1周外周血CD11b+Ly6Chi单核细胞、CD11b+Ly6G+粒细胞显著升高,而在术后2周、4周无显著差异。这可能是由于脾切除手术应激造成的术后1周外周血CD11b+Ly6Chi单核细胞、CD11b+Ly6G+粒细胞升高,但其具体原因仍需进一步探索。
