人工合成糖疫苗的研究进展与发展趋势
2020-08-10李格非熊德彩叶新山
李格非,熊德彩,叶新山
(北京大学药学院天然药物与仿生药物国家重点实验室,北京100191)
自18 世纪末英国医生爱德华詹纳开始接种牛痘起,疫苗作为最重要的防病和治病手段,在应对传染性疾病(例如天花、脊髓灰质炎、乙肝等)的威胁中起到了关键性的作用,同时也展现出对一系列重大疾病[如肿瘤、获得性免疫缺陷综合征(艾滋病,AIDS)等]的治疗潜力。为了应对新出现的和不断变异的病原微生物对人类健康的威胁,需要我们不断开发新型疫苗。近年来,随着糖合成化学和糖化学生物学的发展,糖类在免疫过程中的作用越来越受到关注[1]。多种糖类亚单位疫苗包括多糖疫苗和糖蛋白疫苗等也被陆续开发出来,并显示出低毒副作用、高安全性等优势[2]。尤其在应对细菌性脑膜炎和肺炎的全球性爆发上,抗菌性糖蛋白疫苗成为现代医学史上的最成功的案例之一。本文将根据不同的病原微生物种类,结合近3年内最新的研究成果和本课题组的部分工作,介绍相关糖疫苗的研究进展与发展趋势,以期为新型疫苗的开发提供思路。
1 针对细菌感染的多糖疫苗
部分革兰阴性菌和多数革兰阳性菌表面都覆盖着一层荚膜结构,它主要由带负电荷的酸性多糖构成,也是重要的保护性抗原。早期的荚膜多糖疫苗主要通过细菌培养和纯化的方式制成。然而在1970年以前,抗生素的快速发展在一定程度上限制了多糖疫苗的广泛应用和深入研究。近年来,随着越来越多的耐药菌株出现,糖疫苗在抗菌领域的作用才重新受到重视[3]。预计到2020年,全球的糖复合物疫苗市场将达到100 亿美元。根据中国临床试验数据库的统计,目前临床上的细菌多糖疫苗主要有流脑疫苗、b 型流感嗜血杆菌多糖疫苗、伤寒Vi 疫苗和肺炎链球菌多糖疫苗(PPV)等(见表1)。

表1 国内抗细菌感染多糖疫苗的临床进展Table 1 Clinical progress of polysaccharide vaccines against bacterial infectious diseases
临床研究结果表明,这类直接提取的细菌荚膜多糖疫苗虽然安全有效,但是本质上还属于T 细胞非依赖性抗原[7],由于在人体免疫系统中无法与抗原呈递细胞作用,只能激活B 细胞,无记忆细胞形成,因此对婴幼儿和有免疫缺陷的成人的免疫效果不佳[8]。为了增强多糖疫苗的免疫效果,目前的方案是将天然荚膜多糖与蛋白载体结合,或对其进行部分化学修饰(例如磺酸化、乙酰化等),使其变为T 细胞依赖性抗原,以提高免疫原性。需要选择对人体无毒性、不引起过敏反应并能增强多糖免疫效用的蛋白质作为载体,例如白喉类毒素、破伤风类毒素等。同时,某些糖蛋白疫苗还可以作为二联疫苗使用,如b 型流感嗜血杆菌多糖与白喉类毒素结合疫苗可以获得对2 种疾病的免疫力。
另一方面,革兰阴性菌表面特殊的脂多糖抗原也为糖疫苗的设计提供了可能性[9]。脂多糖的核心结构由3~5 个单糖组成,再聚合成20~40 个重复单元的多糖结构。脂多糖本身具有毒性,不能直接用于人体免疫。而通过水解得到的多糖片段由于相对分子质量(10000~30000)较小,免疫应答微弱,也起不到有效的保护效果。因此,目前还没有以脂多糖为基础的糖疫苗产品。然而针对没有荚膜抗原结构的革兰阴性菌引发的感染,例如细菌性痢疾、副伤寒甲等,就需要利用人工合成的脂多糖制备疫苗。
1.1 伤寒疫苗
伤寒目前仍是每年引起2000 万人次感染和20万人死亡的严重肠道传染病之一[10]。感染者经粪-口途径传播伤寒沙门菌是其主要传染途径。由于注射型全菌疫苗存在严重的接种反应,目前多使用Vi多糖疫苗(见图1)进行保护。但由于耐药性菌株的增加,现有疫苗的免疫效果越发不理想。此外,多糖疫苗属于T 细胞非依赖性抗原,不能诱导细胞免疫,对2 岁以下婴幼儿的免疫效果也不好[11]。为了增强Vi 多糖疫苗的免疫效果,多采用载体蛋白结合疫苗的改进方式。至2019年,已经有3 种Vi 多糖-破伤风类毒素结合疫苗(Vi-TT vaccine)[12]获批上市。另外还有2 种结合不同载体蛋白的疫苗——Vi-CRM197(Vi 多糖-白喉毒素突变体)[13]和Vi-DT(Vi 多糖-白喉类毒素)[14]也分别处于临床Ⅰ期与Ⅱ期阶段。这些结合了蛋白载体的多糖疫苗均展现出安全性和远高于Vi 多糖本身的免疫效果。最近,笔者所在课题组在Vi 糖抗原的构效关系研究中也取得了一定进展[15]。课题组利用化学合成手段制备了结构均一的、重复单元数为5 →10 的Vi 糖抗原片段。通过体外anti-Vi 抗体结合实验,证实了六糖是最小的Vi 抗原表位。这一发现将有助于Vi 寡糖疫苗的开发。
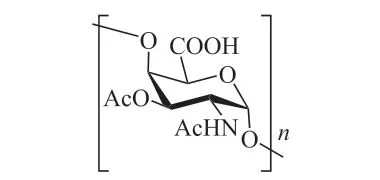
图1 伤寒Vi 糖抗原重复单元Figure 1 The repeating unit of the typhoid Vi polysaccharide vaccine
1.2 结核疫苗
结核病是由结核杆菌引起的严重危害人类健康的主要传染病。世界卫生组织(WHO)发布的《2018年全球结核病控制报告》显示,中国的结核病患病人数居全球第2 位,属于高负担国家。目前,接种卡介苗依然是防治结核病的唯一手段。然而其免疫效果存在广泛争论,不但不能预防原发性感染和肺部潜伏感染,而且对于成人的免疫保护效果不佳。加之越来越多耐药菌株的出现,急需更加安全有效的新疫苗。
在导致结核病的结核分枝杆菌(Mycobacterium tuberculosis)中,存在多种类型的糖抗原结构[16],主要包括构成细胞壁的阿拉伯半乳聚糖(arabinogalactan,AG)、 脂阿拉伯甘露聚糖(lipoarabinomanna,LAM) 以 及 由3 位 甲基化半乳糖和6 位甲基化葡萄糖组成的脂多糖(lipopolysaccharide),这些糖分子成为结核糖疫苗设计的基础。Wang 等[17]通过化学糖基化方法合成了一系列LAM 的片段结构,并将其结合到匙孔血蓝载体蛋白(keyhole limpet hemocysnin,KLH)上(见图2A)。初步免疫研究表明,这种糖蛋白可以诱发小鼠的相关抗体响应,证实了LAM 寡糖在结核疫苗应用中的理论可行性。随后,他们又将免疫佐剂单磷酰基脂质A(monophosphoryl lipid A,MPLA)及其衍生物引入到LAM 型糖缀合物疫苗的设计中,并在腹膜注射了该疫苗的小鼠体内检测到强烈的IgG 抗体响应,进一步证实了糖疫苗在结核疫苗开发中的巨大潜力[18]。另一方面,在结构更为复杂的AG 抗原人工合成中,笔者所在课题组也取得了重大突破[19]。利用硫苷的预活化一釜合成策略,首次合成出含有92 个单糖结构的分支AG 多糖抗原(见图2B),这也为结核糖疫苗的开发打开了一个新的方向。近期,脂多糖抗原研究也取得了一定进展。De 等[20]利用核磁、LC-MS 等技术详细研究了结核分枝杆菌中分离的脂多糖结构,发现其主要糖链是由α-(1→4)连接的6位甲基化葡萄糖单元组成,非还原端的糖单元6 位存在乙酰化修饰,且这种乙酰化对于T 细胞的活化起着至关重要的作用。这些发现为脂多糖基疫苗的设计提供了结构基础。
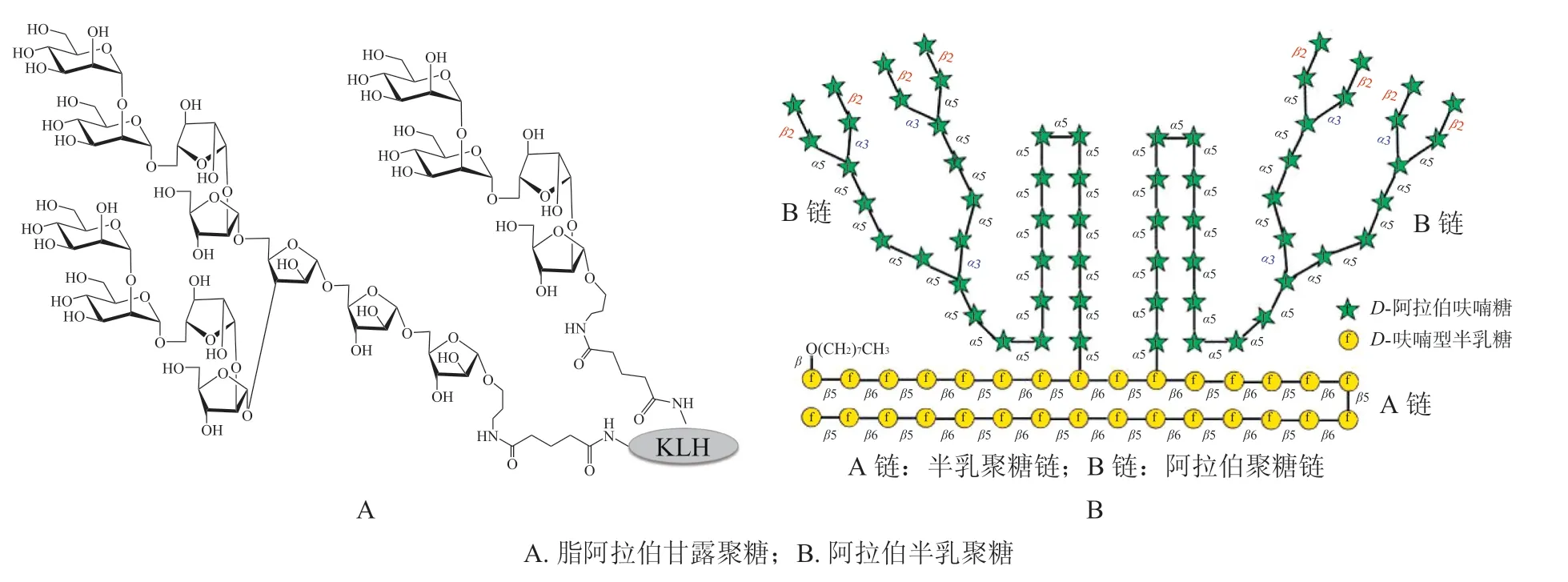
图2 人工合成的结核疫苗多糖抗原Figure 2 Synthetic polysaccharide antigens of the vaccine for tuberculosis
2 艾滋病糖疫苗
AIDS 是由人免疫缺陷病毒(HIV)引起的危害极大的传染病。HIV 病毒主要攻击人体的CD4+T淋巴细胞,使机体丧失免疫功能。从20 世纪80年代开始,美国就开始了HIV 疫苗的研制,但至今还没有有效的疫苗出现。在HIV 入侵宿主细胞的过程中,首先要通过病毒表面的糖蛋白gp120 与细胞表面受体CD4 结合,同时gp120 也被认为可以遮蔽HIV 表面的蛋白表位,进而避免被人体免疫系统识别[21]。基于此,初代糖疫苗的设计方案就是合成gp120 的类似物来诱发体液免疫。由于gp120 蛋白表面的糖基化率很高,表明糖链在HIV 感染过程中发挥着重要作用,进而可以利用这些特征糖链来设计新的抗HIV 疫苗。例如,能够有效中和HIV的2G12 抗体,就是以HIV 表面gp120 上的甘露寡糖簇(oligomannose cluster)作为识别靶标进而发挥抗病毒活性的[22]。这些发现为抗HIV 糖疫苗的研究带来了新的契机。Wang 等[23]通过模仿病毒表面高密度的糖链结构,合成了树枝状的甘露寡糖簇(见图3A),并通过糖基微阵列结合实验证明了这种人工合成的糖簇由于具有多价结合位点,可以有效在体外抑制gp120 与2G12 的结合,但却无法在体内诱导广泛中和HIV-1 抗体(broadly neutralizing antibody,bnAb)的形成,说明只有高抗原性还不足以诱导免疫原性。针对抗原性与免疫原性之间的屏障,笔者所在课题组设计了联合免疫策略[24],利用具有相同抗原表位的糖复合物BSA-(Man)4(见图3B)与重组gp120 共同免疫小鼠,可特异性地增强识别gp120 抗体中与(Man)4相关结构结合的抗体成分。虽然整体上bnAb的抗体滴度没有明显增加,但这种能够改变抗体响应特异性的策略也为HIV 疫苗的设计提供了有价值的参考。此外,gp120 的第三可变区(V3 peptide)作为HIV-1 的主要免疫原区在疫苗设计中也备受关注。Gianvincenzo 等[25]利用合成的负电性糖基金纳米粒子来调控V3 肽链的构象,使其变为能与中和抗体mAb 447-52D 有效结合的β折叠结构(见图3C),进而诱发抗体对gp120的识别,达到免疫激活的效果。同时这种糖基纳米粒子也被证实可以提高多肽抗原的酶解稳定性,进一步增强免疫效果。这些发现为新型HIV 疫苗的设计提供了新的思路。
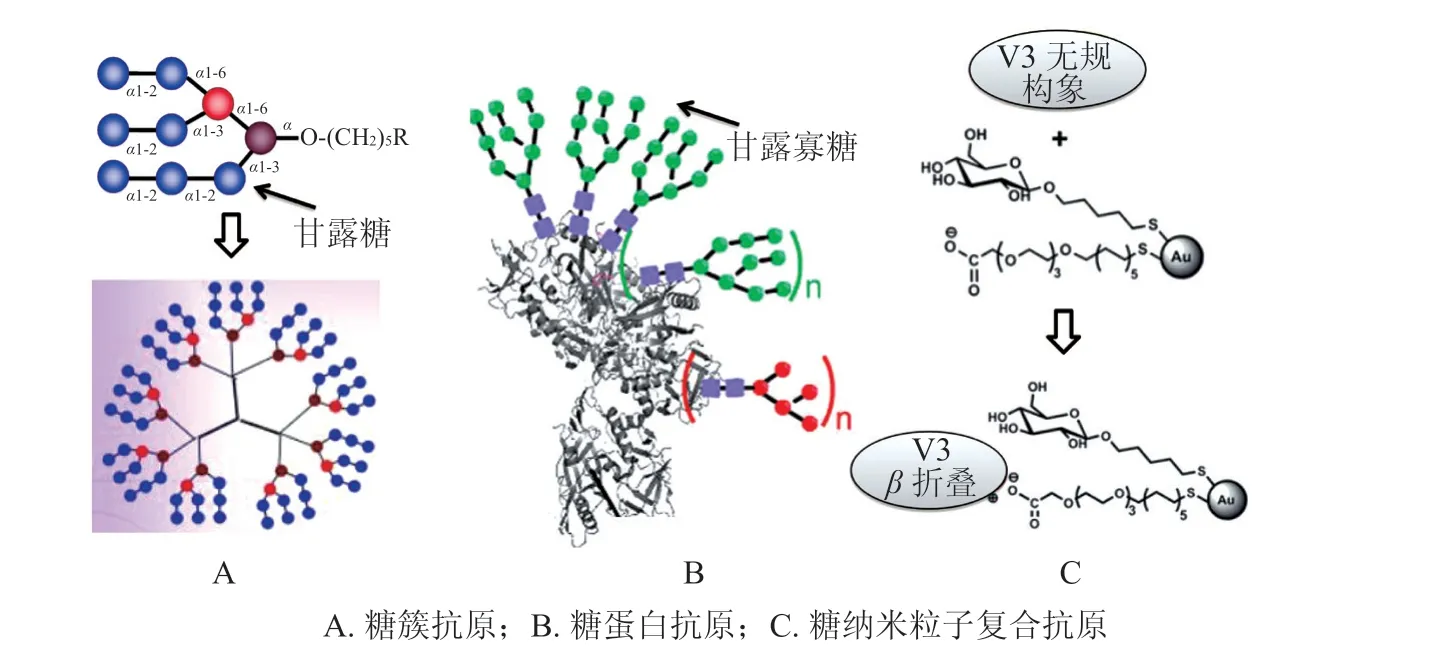
图3 用于HIV 疫苗研究的不同糖抗原设计方案Figure 3 Different design strategies as carbohydrate antigens for HIV vaccine
3 肿瘤糖疫苗
目前疫苗可预防的疾病仍以传染病为主,非传染性疾病的疫苗还处在探索阶段。而针对肿瘤的糖疫苗主要是治疗性疫苗。与正常细胞不同,肿瘤细胞表面的糖链会发生过度唾液酸化和支化等变异。这些特殊的糖链结构参与了肿瘤细胞的免疫逃逸和转移等重要过程,因此也被称为肿瘤相关糖抗原(tumor-associated carbohydrate antigen,TACA,见图4)[26]。在机体内,跨膜受体Dectin-1 可以在糖链刺激下,激发细胞因子的产生,进而起到抗肿瘤的作用。早期临床研究证实,对肿瘤病人注射糖疫苗来诱导相关抗体的产生,可以延长生存期[27]。通过人工合成和改造这些糖抗原,就有望获得用于肿瘤治疗的糖疫苗。但是肿瘤细胞表面的糖抗原免疫原性较弱,只能与B 细胞作用并引起短暂无免疫记忆的IgM 抗体。因此,解决天然糖抗原的免疫耐受就成为肿瘤糖疫苗研究的关键问题[28]。
常用的解决方案是把糖抗原通过共价键结合到特定的载体上(见图5A),从而实现从非T 细胞依赖(T-independent,TI)抗原到T 细胞依赖(T-dependent,TD)抗原的转化。常见的载体蛋白有KLH、白喉毒素突变蛋白(CRM197),脑膜炎外膜蛋白(meningococcal outer membrane protein complex,OMPC),破伤风类毒素(tetanus toxoid,TT) 和 白 喉 类 毒 素(diphtheria toxoid,DT)[29]。分别用于黑色素瘤和乳腺癌的KLH-GM2及KLH-STn 糖蛋白类治疗性肿瘤疫苗已经进入Ⅲ期临床试验阶段。纳米粒子也是一种常用的糖抗原载体(见图5B)。相较于生物大分子载体,纳米尺度赋予这类糖疫苗一些独特的性能,例如可以更容易地透过组织屏障,并能够实现单细胞水平上的免疫调控[30]。其中,金纳米粒子因其制备简单、可通过巯基进行表面修饰等优点,成为最常用的载体材料。通过对三氧化二铁纳米颗粒进行表面镀金,还可以得到具有磁性的肿瘤糖疫苗[31]。以外,一些特殊的载体也被用于抗肿瘤糖疫苗的制备。Reuven 等[32]用血红细胞负载N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc),用于肿瘤的免疫治疗(见图5C)。这里,血红细胞既展现出良好的生物相容性又能在体循环中保留较长的时间,而Neu5Gc 作为一种非人源性的唾液酸分子,只出现在特定的肿瘤细胞上。动物实验表明这种糖疫苗可以在Neu5Gc 阳性肿瘤的荷瘤小鼠体内诱导产生抗Neu5Gc IgG 抗体,从而有效抑制肿瘤生长。另外,一些特殊结构的高分子材料也被用于肿瘤疫苗的研究。Kuamer 等[33]将甘露糖结合到双亲性的高分子上,利用其自组装得到了能有效激活抗原递呈细胞的糖纳米胶束(见图5D)。此外,在最近的糖复合物疫苗研究中,外膜囊泡(outer membrane vesicle,OMV)作为一种新兴的载体,展现出无毒、固有佐剂特性等特点,也备受关注[34]。虽然相同的糖抗原在连接不同载体时会表现出完全不同的免疫行为,但考虑到载体本身的细胞毒性、生物相容性、代谢途径等因素,目前获批的糖缀合物疫苗都是以蛋白作为载体的[35]。因此,开发合适的连接臂和温和有效的蛋白修饰策略依然是糖蛋白疫苗研究中的热点[36]。
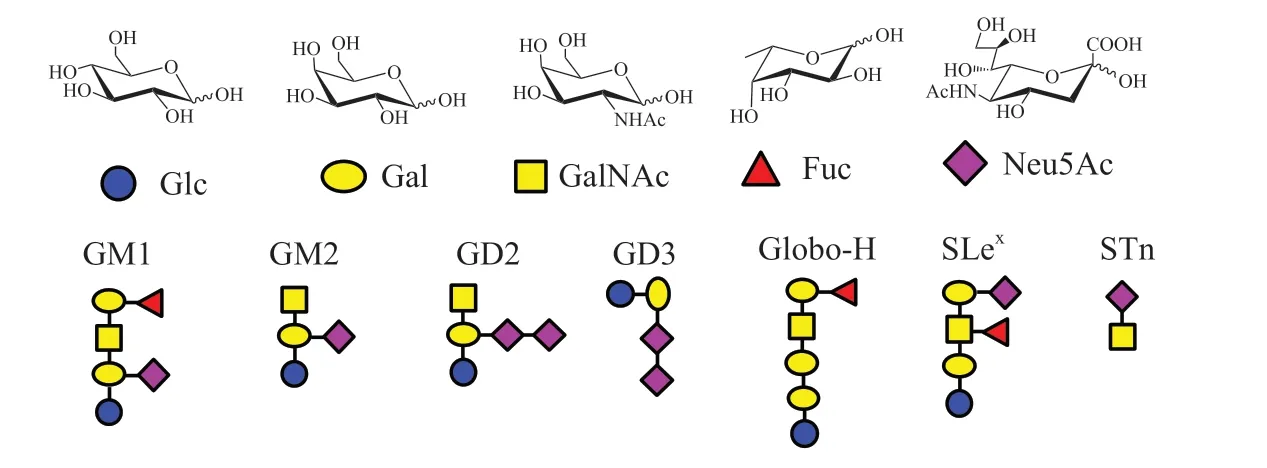
图4 代表性的肿瘤相关糖抗原结构Figure 4 Representative structures of tumor associated carbohydrate antigens
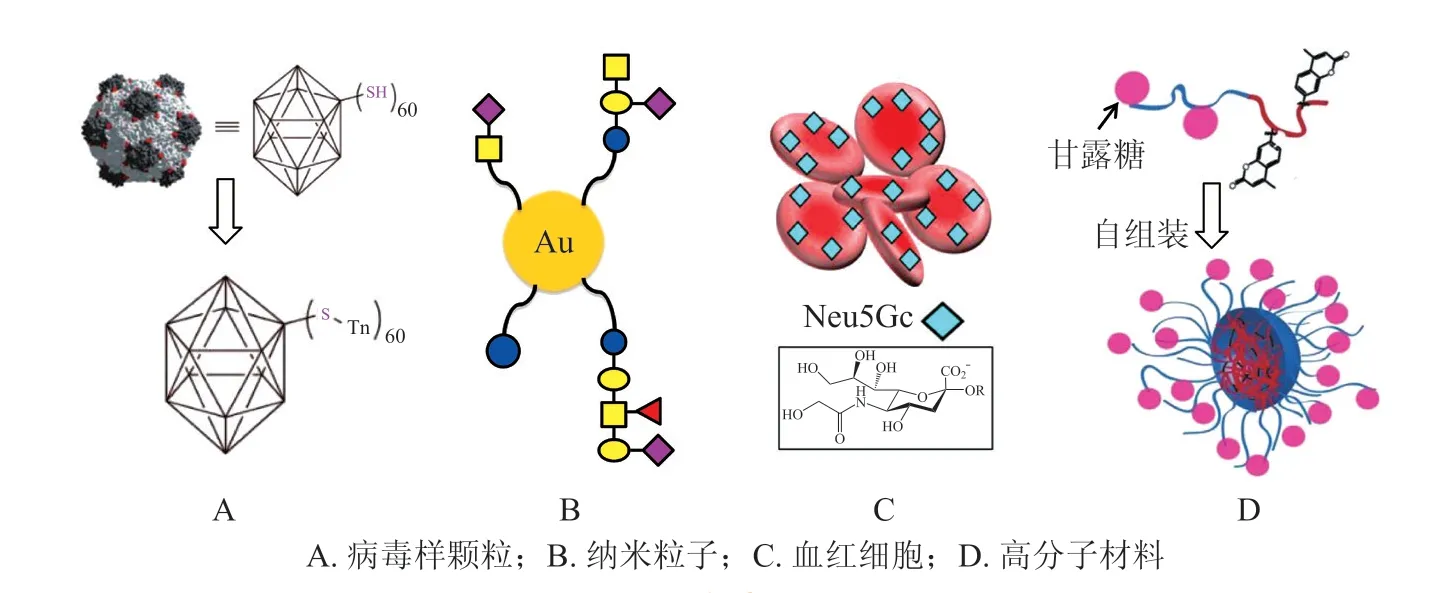
图5 用于抗肿瘤糖疫苗的不同载体Figure 5 Different carriers used for anti-tumor carbohydrate vaccines
除了利用载体效应提高肿瘤糖疫苗的免疫原性之外,另一个解决方案是对天然糖抗原进行适当修饰,使其诱导产生的抗体能够识别肿瘤细胞表面所表达的天然糖抗原,并且这种通过接种产生的抗体滴度需要超过人体针对天然糖抗原而产生的抗体滴度。基于以上考虑,笔者所在课题组在肿瘤糖疫苗的化学修饰中开展了一系列工作。2011年我们首次发现,通过氟原子的引入可以大幅度提高天然STn 抗原的免疫原性(见图6),诱发小鼠产生高于原始KLH-STn 疫苗6 倍以上的IgG 抗体[37]。这一结果促使我们将该策略应用到更多的肿瘤相关糖抗原的化学修饰中,包括GM3 抗原[38]、Thomsen-Friedenreich 抗原[39]和Tn 抗原类似物[40]。所有修饰后的糖疫苗均表现出高于本体的免疫原性,这为解决天然糖抗原的免疫耐受和抗肿瘤糖疫苗的开发提供了一条有效的途径。最近,Chang 等[41]将STn抗原与T 辅助淋巴细胞表位(T-helper cell epitope)结合,制成了无需载体蛋白的自佐(self-adjuvanting)抗肿瘤糖疫苗。其中,唾液酸上N-丙酰化改造的STn 可以在小鼠体内诱导产生更具特异性的IgG 抗体,进而更有效地识别肿瘤细胞表达的STn 抗原,提高了疫苗的抗肿瘤效力。此外,将多种肿瘤糖抗原连接到同一个载体蛋白上得到多价疫苗的方案也备受关注。O,Cearbhaill 等[42]开展了将5 价疫苗用于卵巢癌患者的Ⅰ期临床试验,证实了多价疫苗的安全性,并获得了与分别注射多种单价疫苗类似的免疫效果。
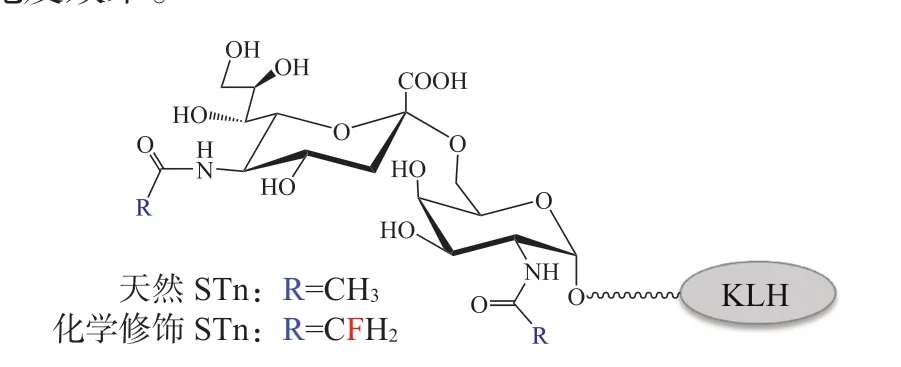
图6 天然的和化学修饰的STn 糖疫苗Figure 6 Native and modified STn carbohydrate vaccine
虽然抗肿瘤糖疫苗的研究取得了很多成绩,但是到目前为止,依然没有一种获FDA 批准上市。抗肿瘤糖疫苗的临床试验依然有很长的路要走。
4 结语与展望
病原体表面糖抗原的深入研究以及新的糖基化方法极大地提高了糖疫苗的应用前景。尤其在应对艾滋病、肿瘤等重大威胁方面,糖疫苗提供了新的解决方案。但需要指出的是,绝大多数的多糖抗原在激发机体的免疫应答过程中不能利用CD4+T 细胞和吞噬细胞的协同作用,只能作用于B 细胞,产生IgM 抗体。而且,机体对多糖产生免疫应答需要完善的脾脏功能,脾脏边缘区的B 淋巴细胞被认为是启动多糖免疫反应的关键[43]。然而对于脾脏发育不完全的婴幼儿,这种由多糖刺激所引发的免疫应答很有限,导致临床使用的多糖疫苗对2 岁以下婴幼儿的保护效果很不理想。如何克服低免疫应答,是糖疫苗研发过程中急需解决的问题。目前,天然糖抗原的化学修饰和引入具有T 细胞依赖抗原特征的载体材料,都被证实可以促进IgG 抗体的转化和记忆性T 细胞的形成,进而获得理想的免疫保护效果。
当前生物类新药的比例已经超过化学新药,开启了新药研发的新时代,最主要的原因还是得益于基因工程和蛋白质工程的快速发展,使得大规模制备生物产品成为可能。同样,对于糖疫苗的发展与应用,最大的瓶颈依然还是大规模的制备方法。只要解决结构均一性糖链的获得性问题,糖疫苗的发展必将突飞猛进。目前,多数糖疫苗的获得还是采用传统的从培养微生物中直接分离提取的方式。这就不可避免地带来抗原结构不均一性、免疫耐受性等问题。同时,由于无法获得结构单一的糖链结构,使得糖基疫苗的免疫学基础研究步履维艰。区别于蛋白质的生物合成过程,糖链的生物合成属于非模板控制过程,因而我们无法在体外通过引入特定的基因序列获得想要的糖链结构,这就要求我们必须开发出有效的化学手段来大规模合成复杂的糖链结构。近些年一批新的糖基化方法(化学-酶法[44])和先进合成策略(预活化一釜合成[45]、自动化合成[46]等)的出现必将加速糖疫苗的开发与应用。
除了化学偶联方法以外,近些年发展起来的生物偶联策略即在大肠埃希菌(E.coli)中通过糖工程手段制备重组糖缀合物疫苗(protein glycan coupling technology,PGCT),也为规模化制备糖疫苗提供了另一个平台[47]。相较于过程繁复的化学途径,生物策略具有更高的经济性和制备效率。该方法一般分为3 个阶段:首先在E.coli中表达出所需要的外源性糖链;其次是设计和表达载体蛋白;最后在宿主细胞中完成偶合。在此基础上,Kightlinger 等[48]还报道了一种无细胞表达(cell-free)的体外生物平台,用来构筑N-连接(N-linked)目标糖蛋白。在这个被称为体外快速表达糖基化技术(glycosylation pathway assembly by rapidin vitromixing and expressing,GlycoPRIME)的方法中,糖蛋白组装所需的全部原料包括目标糖链受体、糖基转移酶、载体蛋白等都先通过E.coli制备,再通过混合未经分离的溶菌液进行组装得到目标糖蛋白。该策略为糖蛋白的生物合成提供了另一条崭新的途径。
近期,在革兰阴性菌中天然释放的外膜囊泡(outer membrane vesicle,OVA)研究中提出的膜抗原通用模块(generalized modules for membrane antigens,GMMA)[49]概念,被认为是第3 代糖疫苗的制备基础[50]。GMMA 可以简单描述为通过基因改造菌株(例如Shigella sonnei)高效产出外膜抗原颗粒(脂多糖),再经过2 步简单的过滤纯化得到糖疫苗。虽然该策略在糖疫苗的研究中还处在最初阶段,但相较传统的纯化过程,GMMA 可以有效缩短糖抗原的纯化步骤,大幅降低糖疫苗的制造成本。糖疫苗的发展历程与趋势见图7。理活动的影响,同样是糖疫苗开发中必须解决的重大问题。
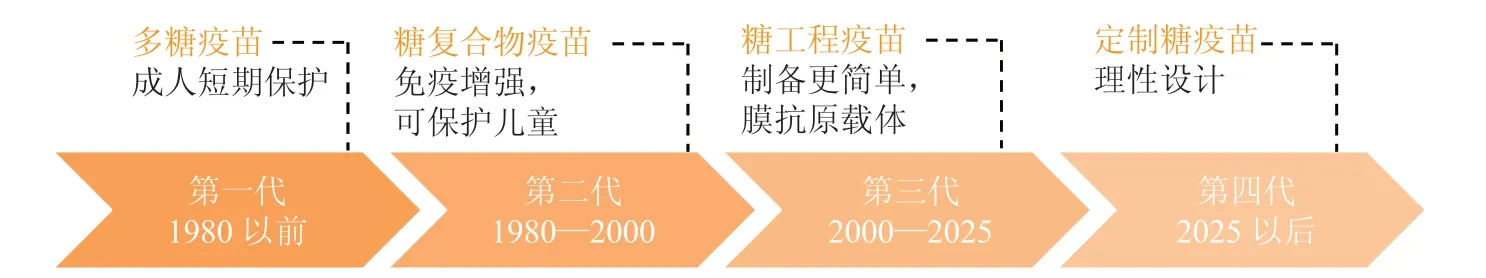
图7 糖疫苗的发展历程与趋势[50]Figure 7 Historical and future development of carbohydrate vaccines
最后,糖疫苗的最终应用还要通过严格的临床试验,推动基础研究中具有优异抗原活性的糖复合物走向临床试验,进一步探索其安全性及对正常生
