酪氨酸激酶抑制剂专利布局分析
2020-08-10张莹雪左勇刚郑晓南
张莹雪,左勇刚,郑晓南
(1.中国药科大学理学院,江苏 南京 210009;2.江苏省发明协会,江苏 南京 210019)
酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)也被称为“替尼”类药物,是一类小分子靶向药物。酪氨酸激酶抑制剂通过抑制酪氨酸激酶并阻断相关细胞信号转导通路达到抑制肿瘤细胞增殖的效果[1]。该类药物对靶点的选择性较强、毒副作用相对较小、治疗效果较好,近年来成为新药研发的热点。截至2020年6月9日,中国已有6 种替尼类药物(伊马替尼、厄洛替尼、吉非替尼、托法替尼、舒尼替尼、达沙替尼)的仿制药获批准上市(见表1)。本文对这6 种药物的专利布局进行分析,进而分析外企在中国的专利布局策略,为中国制药企业提供参考。
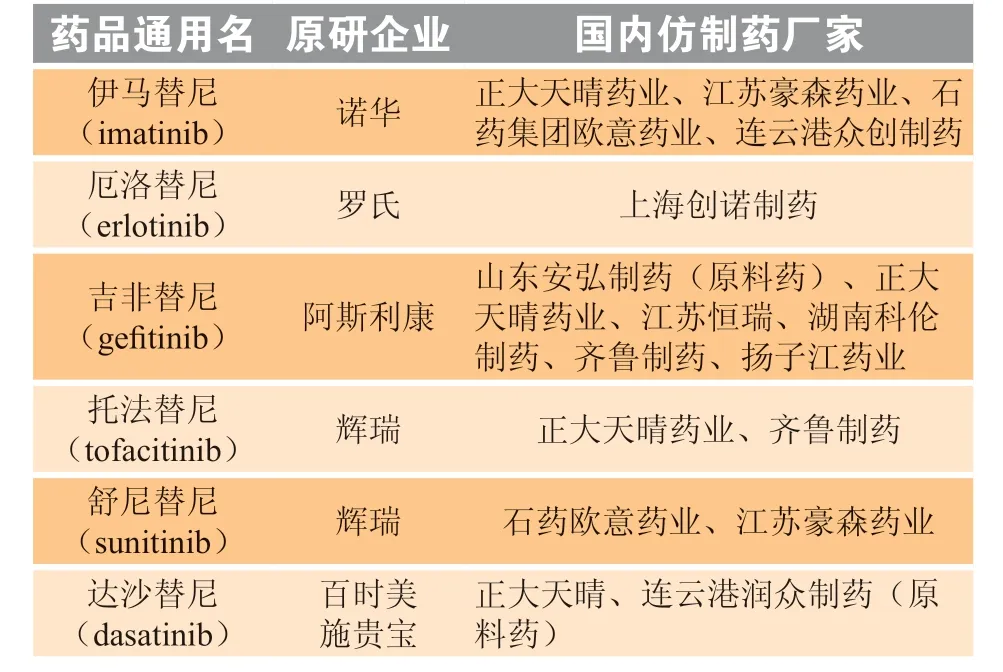
表1 6 种酪氨酸激酶抑制剂的原研及仿制企业#Table 1 The original and generic enterprises of six tyrosine kinase inhibitors
1 分析方法
1.1 数据来源
本文专利数据主要来自Clarivate Analytics Integrity 数据库,在Drug Name Search 检索入口中,分别将6 种药品的通用名作为关键词进行检索,得到各个药品的相关专利信息,再通过智慧芽全球专利数据库批量检索、下载所有检索结果,得到原始专利文献信息。检索数据截至2020年6月9日。
1.2 数据的去噪和标引
将检索结果进行进一步的加工整理,筛选出原研药企在中国的所有专利申请。将每一条专利申请赋予属性标签,标引的内容包括申请号、公开号、申请日、申请人、法律状态、药品专利保护类型、发明名称、保护主题。
2 酪氨酸激酶抑制剂原研药企在中国的专利布局策略分析
2.1 伊马替尼
伊马替尼[原研商品名为格列卫(Glivec)]由瑞士诺瓦提斯公司(即诺华)研发,于2001年被FDA 批准用于费城染色体阳性的慢性粒细胞白血病(CML)或α-干扰素治疗失败后的慢性期患者的治疗。本品于2002年在中国获批,用于治疗CML 和胃肠道间质瘤(GIST)。
截至2020年6月9日,诺华在中国布局的专利共33 件,从化合物(1 件)、晶型(5 件)、联用(14件)、用途(7 件)、组合物(2 件)、剂型(3 件)和分析方法(1 件)方面进行了保护,失效32 件,目前有效的专利包括1 件药物联用专利。
伊马替尼原研药企在中国的专利布局见图1。1993年诺华申请了伊马替尼的化合物专利CN1043531C,在此核心专利中,保护了伊马替尼的化合物通式N-苯基-2-嘧啶胺类衍生物,该专利的公开实验结果显示,此类化合物通过抑制蛋白致活酶C 发挥抗肿瘤作用。在晶型保护上,诺华于1998年申请的专利CN1134430C 保护了伊马替尼β晶型,其实验结果表明伊马替尼的β晶型在流动性和吸湿性方面都优于α晶型,在2006年诺华又相继布局了δ、ε、H、F晶型的有关专利。在药物联用上,2000—2013年,诺华相继申请了14 件伊马替尼的药物联用专利,此类型也是伊马替尼在华专利类型中占比最多的,如专利CN1304005C 保护了伊马替尼与红霉素联合用于治疗白血病,专利CN1523991A 保护了伊马替尼与c-Src 抑制剂联合用于治疗白血病等。在医药用途上,诺华一方面着重保护伊马替尼治疗白血病的用途,另一方面也比较重视伊马替尼新用途的挖掘。
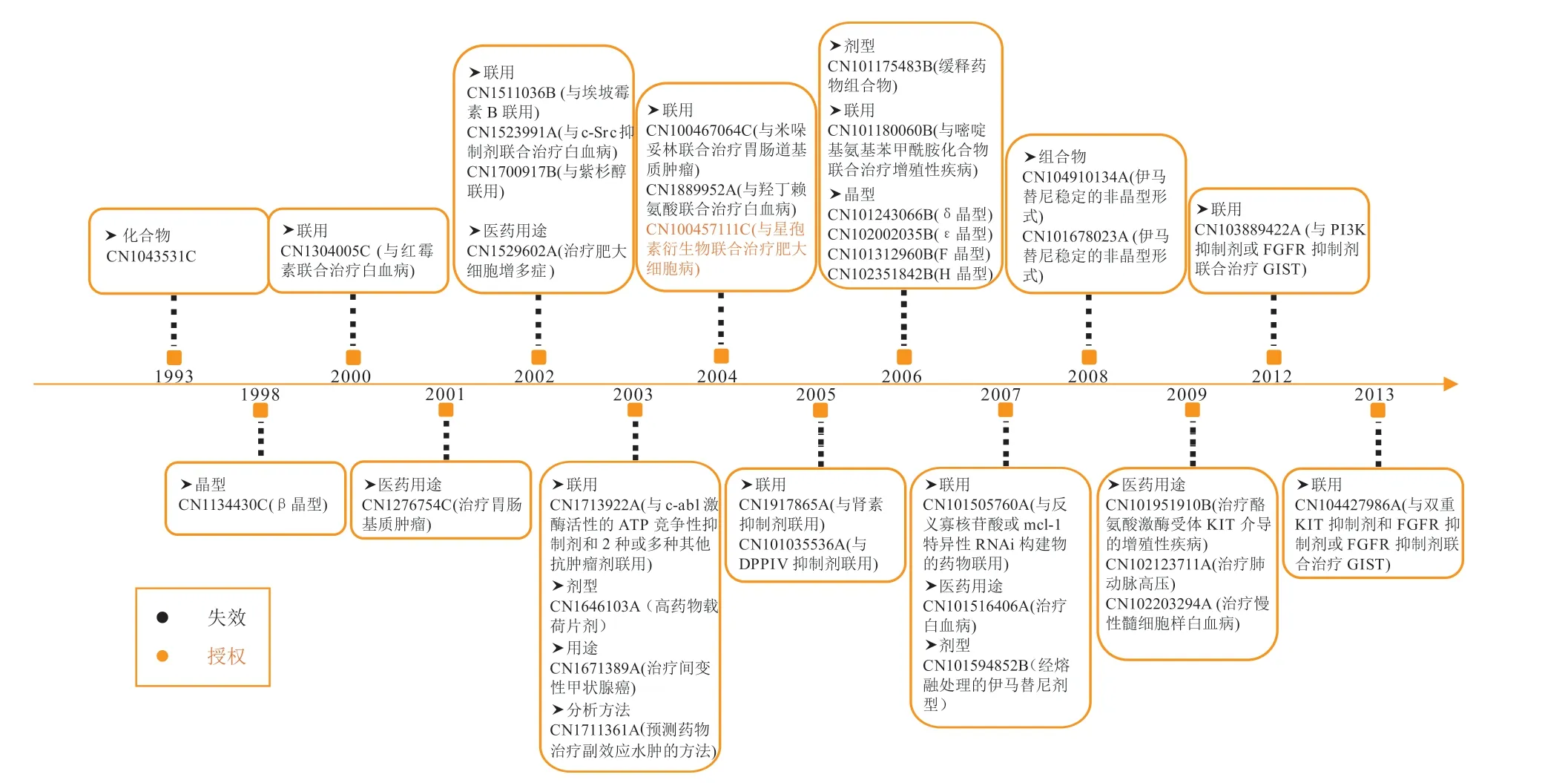
图1 伊马替尼原研药企在中国的专利布局图Figure 1 Patent layout of imatinib's original research enterprise in China
2.2 厄洛替尼
厄洛替尼[原研商品名为特罗凯(Tarceva)],由OSI 制药研发,于2004年被FDA 批准用于非小细胞肺癌(NSCLC)、与吉西他滨联用于晚期胰腺癌的治疗。2006年在中国获批,适用于表皮生长因子受体(EGFR)基因敏感突变的局部晚期或转移性NSCLC 患者的治疗,由罗氏制药在中国进口上市。
截至2020年6月9日,原研公司OSI、辉瑞、罗氏在中国布局的专利共34 件,从化合物(1 件)、晶型(1 件)、制备方法(4 件)、联用(10 件)、医药用途(3件)和分析方法(15件)方面进行了保护,失效28 件,目前有效的专利包括1 件晶型、1 件制备方法、2 件药物联用和1 件分析方法专利,并有1件分析方法专利处于在审状态。
厄洛替尼原研药企在中国的专利布局见图2。在核心专利布局方面,专利CN1066142C 保护了4-氨基喹唑啉的通式结构,并在实施例20 公开了其盐酸盐的制备方法;厄洛替尼在中国的晶型专利布局包括厄洛替尼的B 型多晶型物和多晶型E,专利CN100506803C 公开的实验数据显示多晶型E 比晶型B 有更好的溶解度和溶解速率,具有改进的药理学性质[2]。在厄洛替尼上市后,罗氏在厄洛替尼的制备方法、联用、医药用途和分析方法方面进行了着重研究,申请了一系列采用厄洛替尼的检测方法的专利,并对其可能存在的新用途进行挖掘。
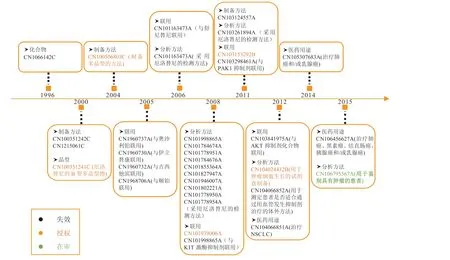
图2 厄洛替尼原研药企在中国的专利布局图Figure 2 Patent layout of erlotinib's original research enterprise in China
2.3 吉非替尼
吉非替尼[原研商品名为易瑞莎(Iressa)]由阿斯利康研发,于2003年获FDA 批准上市,2004年在中国获批,用于治疗晚期或转移性NSCLC。
截至2020年6月9日,吉非替尼原研药企阿斯利康在中国布局的专利共17 件,从化合物(4 件)、晶型(2 件)、联用(7 件)、制备方法(1 件)、组合物(1 件)和分析方法(2 件)方面进行了保护,失效10 件,目前有效的专利包括2 件晶型、1 件制备方法、1 件组合物和3 件化合物专利。
吉非替尼原研药企在中国的专利布局见图3。在核心专利布局方面,化合物专利CN1100046C的权利要求保护了数个化合物,吉非替尼出现在权利要求9 中,这对核心化合物的保护起到一定的隐蔽作用,该专利还公开了吉非替尼的制备方法,但都不适用于大量工业生产,直到2003年专利CN100429204C 进一步保护了中间体和制备方法专利,公开了用于大量工业生产的制备方法,这也是阿斯利康在专利保护和布局方面的策略[3]。在申请核心专利时,无需等到找到具体的活性化合物再申请专利,应当尽早申请,且只需公开本领域的技术人员能够实施的方法就可满足充分公开条件,在需要对制备方法进行保护时再对其进行保护。在吉非替尼上市后,阿斯利康对其外围专利又进行了重点布局,通过吉非替尼与其他化合物联用挖掘其新用途。
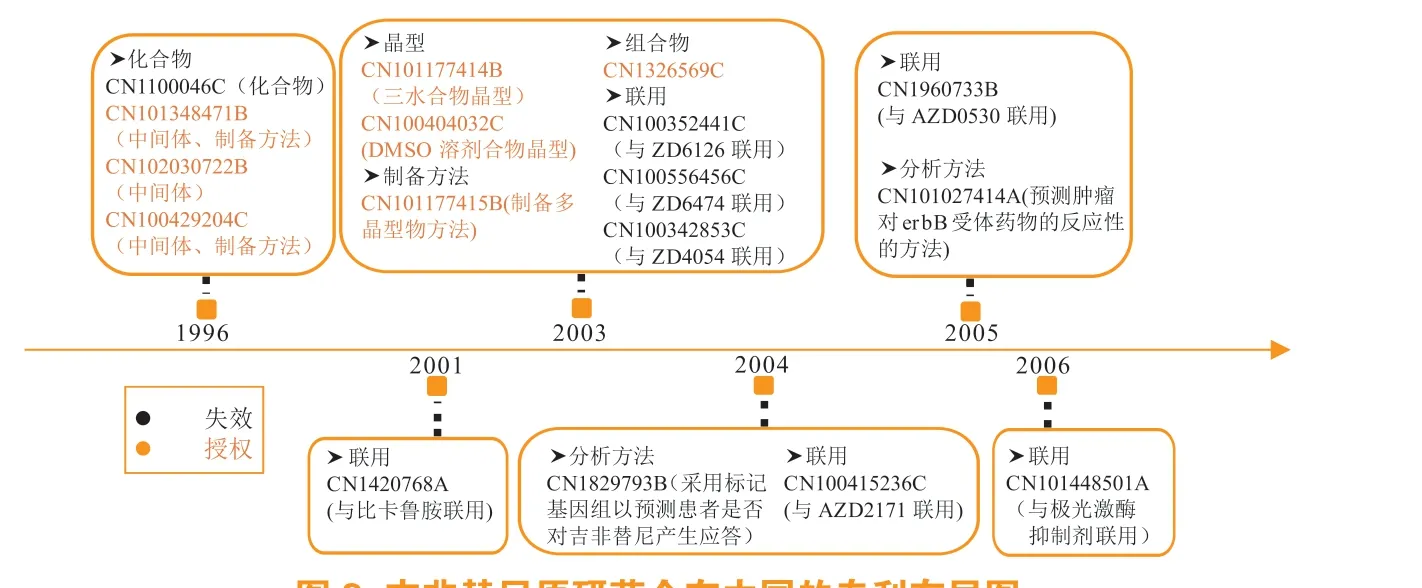
图3 吉非替尼原研药企在中国的专利布局图Figure 3 Patent layout of gefitinib's original research enterprise in China
2.4 托法替尼
托法替尼[原研商品名为尚杰(Xeljanz)]由辉瑞研发,于2012年被FDA 批准上市,2017年在中国获批,用于治疗甲氨蝶呤反应不足或不耐受的中度至重度类风湿关节炎(RA)。
截至2020年6月9日,原研药企辉瑞在中国布局的专利共9 件,从化合物(1 件)、晶型(2 件)、制备方法(1 件)、组合物(1 件)、剂型(1 件)和医药用途(3 件)方面进行了保护,失效8 件,目前有1 件剂型专利处于在审状态。
托法替尼原研药企在中国的专利布局见图4 。在核心专利布局方面,托法替尼的原研化合物专利CN1195755C 权利要求4 保护了托法替尼,专利CN1325498C 保护了托法替尼柠檬酸盐晶型,CN104610264A 要求保护结晶和非结晶形式的托法替尼,以上核心专利在中国均已失效。在医药用途方面,CN1893952A 与 CN1893952A 均是有关治疗移植排斥反应的医药用途专利,CN101743009A 要求保护托法替尼用于治疗干眼病的用途。目前辉瑞在中国布局的专利中核心化合物专利类型多样,但数量较少,且大多已经失效,有较多空间供其他申请人挖掘。
2.5 舒尼替尼
舒尼替尼[原研商品名为索坦(Sutent)]由苏根公司(后被辉瑞收购)开发,于2006年获FDA批准上市,2007年在中国获批,用于治疗肾癌和胃肠间质瘤。
截至2020年6月9日,原研药企辉瑞在中国布局的专利共15 件,从化合物(2 件)、晶型(3 件)、制备方法(1 件)、组合物(1 件)、联用(6 件)和医药用途(2 件)方面进行了保护,失效12 件,目前有1件化合物专利和2件晶型专利处于授权状态。
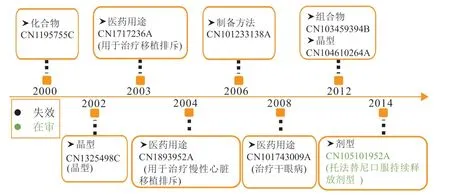
图4 托法替尼原研药企在中国的专利布局图Figure 4 Patent layout of tofacitinib's original research enterprise in China
舒尼替尼原研药企在中国的专利布局见图5。舒尼替尼的化合物专利CN1329390C 的到期日为2021年2月15日,发明名称为吡咯取代的2-二氢吲哚酮蛋白激酶抑制剂,该专利保护了通式化合物、舒尼替尼化合物以及在多种疾病中的制药用途。查询中国及多国专利审查信息数据库后得知,2019年5月石药集团提出了对化合物专利CN1329390C的无效宣告请求,但在2019年11月29日专利局复审和无效审理部作出了维持专利权有效的审查决定。舒尼替尼的晶型专利CN100364991C、CN100439360C 保护了舒尼替尼的一种苹果酸盐晶体,目前处于授权状态。原研公司在布局了核心专利后迅速对其外围专利如联用、组合物和医药用途专利进行重点布局,构建了完整的专利布局网,这是值得国内申请人学习借鉴的地方。
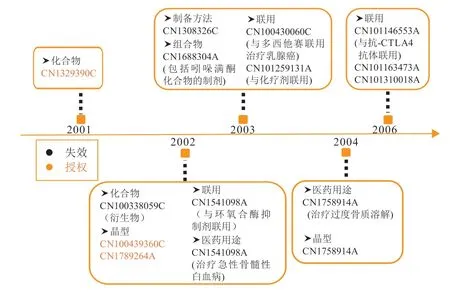
图5 舒尼替尼原研药企在中国的专利布局图Figure 5 Patent layout of sunitinib's original research enterprise in China
2.6 达沙替尼
达沙替尼[原研商品名为施达赛(Sprycel)]由百时美施贵宝公司研发,于2006年获FDA批准上市,2011年在中国获批,适用于对包括甲磺酸伊马替尼在内的治疗方案耐药或不能耐受的慢性髓细胞样白血病患者。
截至2020年6月9日,原研药企百时美施贵宝在中国布局的专利共10 件,从化合物(2 件)、晶型(1件)、联用(3 件)、医药用途(2 件)和组合物(2件)方面进行了保护,失效8 件,目前有1 件晶型专利处于授权状态,1 件联用专利处于在审状态。
达沙替尼原研药企在中国的专利布局见图6。在核心专利方面,达沙替尼的化合物专利CN1348370A 与其分案CN101481359A 在中国的申请均被驳回,其美国同族US06596746B1 在美国处于有效状态。晶型专利CN1980909B 在中国被授权,保护了达沙替尼的一水合物晶型。对于其外围专利,在达沙替尼的医药用途方面,CN1764454A 与其分案CN1989969A 要求保护达沙替尼对多种癌症治疗的医药用途,例如CML、GIST、小细胞肺癌(SCLC)、NSCLC、急性髓性白血病等多种疾病。在药物联用方面,CN1849119A 要求保护达沙替尼和抗增生细胞毒剂联合治疗增生性疾病,CN101198253A 要求保护达沙替尼与干细胞选择性细胞毒剂联合治疗癌症;CN102822200A 要求保护达沙替尼与抗细胞毒性T 淋巴细胞相关抗原(CTLA)-4 药物联合治疗增殖性病症,目前处于在审状态。百时美施贵宝在达沙替尼的医药用途和药物联用方面挖掘了较多的适应证和疗法,其在中国申请专利的授权数量不多,其他申请人仍然可以从化合物改造、晶型、新适应证或药物联用方面挖掘可能的新技术。

图6 达沙替尼原研药企在中国的专利布局图Figure 6 Patent layout of the dasatinib's original research enterprise in China
3 国外专利布局策略及其对我国企业竞争对策的启示
3.1 国外企业专利布局策略
3.1.1 知识产权保护贯穿药品研发创新的整个阶段医药产业的长周期、高投入、高风险、高回报的特性决定了其对知识产权具有较强的依赖性。在药品研发阶段的专利申请类型主要是药品的化合物、盐、晶型等保护药品活性组分的基础专利。在上市成功后,对制备方法、剂型、医药用途、组合物、联用、医疗器械等外围专利进行布局。药品的研发和上市生命周期中,在时间、地域、主题内容都有不同的专利布局网络。国际大型制药公司在研发初期就根据预期的目标市场进行了及时的布局,并在不同的阶段进行了相应的布局,这样可以有效地延长药品的专利保护期。
3.1.2 通过多角度的专利布局构建专利壁垒化合物专利是药品的首要核心专利,企业通过精心打磨核心专利,建立严密的专利壁垒。在化合物保护阶段,通常采取先保护范围较大的马库什通式再进行窄范围的具体化合物的保护策略,这样能够有较大的保护范围并且在研发初期能够避免过早地暴露目标药物。在化合物专利失效或被专利挑战成功时,外围专利便能够起到保护原研企业的市场份额的作用。专利布局的角度通常包括技术布局(保护式布局、对抗性布局、储备式布局)、时间阶段的布局、地域空间的布局(海外专利布局)和针对竞争对手的布局等。从策略上可分为防御布局、进攻布局、运营布局、整合布局和战略布局。通过专利权之间的组合和接续组成专利组合,实现专利保护的延长,使竞争对手难以分割相关市场[4]。
3.2 对我国企业专利布局与竞争对策的启示
3.2.1 挖掘原研专利信息,拓展仿制药市场空间在国外原研企业对其重点药物建立了严密的专利壁垒情况下,一方面,我国企业需要对其药品专利布局深度挖掘,发现具有开发潜力的布局空白点或专利空隙,在避免侵权的情况下进行仿制药研发,紧跟技术脚步;另一方面,国外大型药企一般从大范围药效化合物的筛选开始,而国内药企可以跟踪国外已上市或已进入临床的药物的趋势,进行结构改造和修饰,仿制和创新相结合。国内药企和国际大型药企在研发能力和经济实力上的巨大差异,必然导致研发重点有所不同。由于规避方式也具有一定的侵权风险,对原研化合物进行结构改造并研发“me too”类药物更符合我国制药企业的实际情况[5]。
3.2.2 注重专利申请和专利布局策略在中国医药的专利挑战新形势下,原研企业需要加强自主创新,将知识产权保护贯穿药品研发创新的整个阶段,通过多角度的专利布局构建专利壁垒,尽可能延长药品市场独占期。可以借鉴以下技巧:第一,在专利保护类型上全面布局;第二,在专利申请时间间隔上,不断开发药品外围专利保护;第三,在专利申请数量上可以适当增加专利数量,可以选择“小而密”的专利申请策略,形成密集专利网络布局,从而增加专利授权率;第四,在专利公开时机上,按期公开可以综合全面考察药品的市场潜力,提前公开则可以加快审查速度[6];第五,在撰写专利时学会隐藏核心技术,掌握一定的撰写技巧,在申请核心专利时,无需等到找到具体的活性化合物再申请专利,应当尽早申请,且只需公开本领域的技术人员能够实施的方法就可满足充分公开条件,在需要对制备方法进行保护时再对其进行保护。
3.2.3 关注在中国未获授权的申请主题各国对于专利的审批和授予是各自独立互不干扰的,在进行专利挖掘时,可以积极关注在他国申请而未在国内申请的主题。对于已在中国申请的主题,可以积极挖掘寻找,提高获得授权和交叉许可的可能性。
4 结语
综合上述分析,中国药企应该专注中国发病率较高的病症来寻找未满足临床需求的靶标,跟踪已知上市和进入临床试验的药物,加强自主创新能力,注重专利申请与专利布局策略,才能从容应对仿制药企业的围攻。仿制药企业需要挖掘原研专利信息,拓展仿制药市场空间,才能攻破原研药的严密专利布局,拓展仿制药市场,攻克天价药品,造福广大患者。
