2019新型冠状病毒检测方法
2020-08-10潘晓芳姚燕丽曹春玲黄宇哲吴静标
潘晓芳,姚燕丽,曹春玲,黄宇哲,吴静标
广东省医疗器械质量监督检验所,广州市,510663
0 引言
2019 新型冠状病毒(severeacute respiratory syndrome coronavirus 2,SARSCoV-2)自2019年12月在武汉出现以来,在中国各地和其他许多国家迅速蔓延,并成为全球关注的健康问题[1]。SARS-CoV-2感染导致的肺炎叫2019新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)。SARS-CoV-2由RNA核酸和蛋白等组成。病毒通过特定细胞表面的受体入侵细胞造成感染,并且利用宿主细胞进行复制增殖,因此检测特定部位细胞样本,可以确定其中是否含有SARS-CoV-2 RNA核酸[2]。SARS-CoV-2核酸检测作为“金标准”的前提是采集到的标本含有一定量的病毒细胞,被感染者的细胞中有一定量的病毒,且检测试剂可靠,核酸实验室规划合理、管理规范,检验人员能力达标,否则只要任何一个环节没有切实有效执行,检测结果就容易出现“假阴性”[2]。基于以上因素,在核酸检测的同时,补充SARS-CoV-2特异抗原或抗体检测就可以很好地减少检测结果“假阴性”的发生率。
1 SARS-CoV-2 检测试剂分类
根据《体外诊断试剂注册管理办法》,SARS-CoV-2检测试剂为第三类医疗器械[3]。截止2020年3月2日,检索中国临床试验注册中心显示,以SARS-CoV-2为主题的研究已经达到288项[4],而检索国家药品监督管理局国产医疗器械数据库发现,目前国内SARS-CoV-2检测试剂盒拥有有效注册证的公司仅有14家(其中基于核酸方法检测试剂10家,其它检测试剂4家),热门的方法学主要包括基于核酸分子诊断的荧光PCR法、用于抗原抗体检测的胶体金免疫层析法[5],此外也有厂家将荧光免疫层析、酶联免疫法和化学发光免疫分析法作为快速检测SARS-CoV-2的辅助方法。但是在已经取得注册证的SARS-CoV-2 检测试剂盒中,只能定性检测SARS-CoV-2,而不能获得定量结果。
我们从分子诊断和免疫学诊断两个方面,对荧光PCR法、免疫层析法、酶联免疫法、化学发光免疫分析法的原理进行概括,并对方法的优点和局限性进行评价。
2 SARS-CoV-2 检测方法及其原理
2.1 荧光PCR分子诊断法
SARS-CoV-2分子诊断目前主要采用荧光PCR法,利用荧光信号的变化实时检测PCR扩增反应中每一个循环扩增产物量的变化,通过Ct值可以进行定性分析,如果加上标准曲线就可以对起始模板进行定量分析,SARS-CoV-2浓度越高,Ct值越小。将SARS-CoV-2 RNA逆转录为DNA,利用反转录聚合酶链式反应检测技术,针对SARS-CoV-2 ORF1a/b基因、N基因、S基因和人源内参RNase P基因等基因序列保守区域设计特异性引物和荧光Taqman探针,实现对样本中的SARS-CoV-2 RNA的定性检测,即通过SARS-CoV-2碱基排列的特异性识别SARS-CoV-2。
国家卫生健康委员会发布的《新型冠状病毒感染的肺炎实验室检测技术指南(第五版)》(以下简称《指南》)要求荧光PCR法SARS-CoV-2核酸检测需至少选用SARS-CoV-2的ORF1ab、N基因区域的引物和探针[6]。
2.2 免疫学诊断法
免疫学检测的基础是抗原抗体,人体感染SARS-CoV-2后,就含有SARS-CoV-2抗原,抗原刺激细胞产生特异性抗体。利用抗原-抗体特异性结合原理,即可用直接抗体检测抗原或间接抗原检测抗体的方法,判断待测样本是否含有SARS-CoV-2。
SARS-CoV-2的外壳由特异性蛋白质包裹,因此可以利用抗原-抗体结合的原理对SARSCoV-2进行免疫学检测[7]。我们下面介绍免疫层析法、酶联免疫法、化学发光免疫分析法三种检测SARS-CoV-2抗原抗体的方法。
2.2.1 免疫层析法
免疫层析法采用胶体金免疫层析或荧光免疫层析技术,定性检测人样本中SARS-CoV-2抗原或抗体。胶体金免疫层析或荧光免疫层析技术的区别在于标记物的不同,前者采用胶体金作为标记物,后者利用荧光颗粒作为标记物且通过激发荧光发光。
以胶体金免疫层析法抗原检测为例,采用双抗体夹心法,胶体金标记的SARS-CoV-2抗体“Au--SARS-CoV-2--Ab”与样本中的SARSCoV-2抗原“SARS-CoV-2--Ag”结合,形成反应复合物“(Au--SARS-CoV-2--Ab)-(SARSCoV-2--Ag)”,在层析作用下反应复合物“(Au--SARS-CoV-2--Ab)-(SARS-CoV-2--Ag)”沿着硝酸纤维素膜向前移动,与检测区(T)预包被的SARS-CoV-2抗体“SARSCoV-2--Ab”结合,形成“(Au--SARS-CoV-2--Ab)-(SARS-CoV-2--Ag)-(SARS-CoV-2--Ab)”双抗体夹心物,当标本中病毒含量不小于最低检测限时,T区形成一条肉眼可见的红色反应线;相反,若待测样本中不含SARS-CoV-2抗原“SARS-CoV-2--Ag”,T区无肉眼可见的红色反应线出现。无论待测样本中是否含有SARS-CoV-2抗原“SARS-CoV-2--Ag”,质控区(C)都会形成一条红色反应线,否则认为此试剂卡无效。双抗体夹心法检测抗原的胶体金试纸原理和结果判读详见图1和图2[7]。
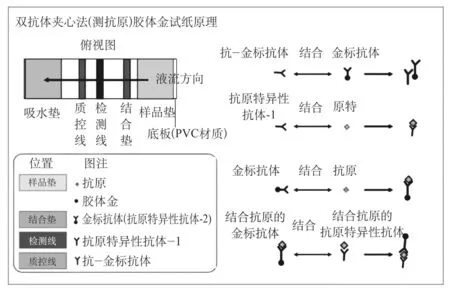
图1 双抗体夹心法检测抗原的胶体金试纸原理Fig.1 Principle of detecting antigens by double antibody sandwich colloidal gold strip
同理,可以采用“(Au--SARS-CoV-2--Ag)-(SARS-CoV-2--Ab)-(SARS-CoV-2--Ag)”双抗原夹心法测抗体。

图2 双抗体夹心法检测抗原的胶体金试纸法的结果判读Fig.2 Judgment on the results of detecting antigens by double antibody sandwich colloidal gold strip
2.2.2 酶联免疫法
酶联免疫法抗原(抗体)检测的原理是能够特异性识别SARS-CoV-2抗原的抗体(抗原)结合到固相载体表面形成“固相抗体(固相抗原)”后,加入待测样本,如果样本中存在SARS-CoV-2抗原(抗体),“固相抗体(固相抗原)”与待测样本形成“固相待测抗原-固相抗体复合物(固相待测抗体-固相抗原复合物)”。洗涤去除未结合的待测抗原(抗体),随后用酶标记的抗体即酶标二抗识别并结合“固相待测抗原-固相抗体复合物(固相待测抗体-固相抗原复合物)”,形成“酶标二抗-固相待测抗原-固相抗体复合物(酶标二抗-固相待测抗体-固相抗原复合物)”。在洗涤多余的酶标二抗后,加入底物和终止液使酶发生颜色反应,颜色的深浅与抗原(抗体)的含量一定范围内成正比,因而可以定性或定量进行SARS-CoV-2抗原(抗体)检测。
2.2.3 化学发光免疫分析法
以双抗体夹心法、酶促化学发光为例,待测样本与“磁珠--SARS-CoV-2--Ab”混合进行免疫反应后,待测样本中的抗原“SARS-CoV-2--Ag”与磁珠标记物结合形成“(磁珠--SARSCoV-2--Ab)—(SARS-CoV-2--Ag)”;经过洗涤,加入酶标记物“碱性磷酸酶--SARS-CoV-2--Ab”进一步反应,形成免疫复合物“(磁珠--SARS-CoV-2--Ab)—(SARS-CoV-2--Ag)—(碱性磷酸酶-SARS-CoV-2--Ab)”。然后充分洗涤将未参与反应的多余物质去除;最后加入发光底物,碱性磷酸酶催化底物发光,发光强度与标本中SARS-CoV-2抗原的量呈正相关。
3 SARS-CoV-2 检测方法评价
3.1 荧光PCR分子诊断法
荧光PCR法核酸检测试剂研发的关键是引物和探针的设计,因此中国疾控中心2020年1月21日公布SARS-CoV-2的全基因序列及其引物和探针后,试剂厂家迅速研发出SARS-CoV-2的核酸检测试剂[8]。荧光PCR法对实验室有严格的要求和使用规范,PCR实验室需要合理的分区以及严格执行质量管理体系,对检测人员的能力有一定要求,一般要求持证上岗,但是由于疫情的特殊性,很多检验人员临时培训即开始检测,因此导致“假阴性”出现的概率很大。另外,采样过程的不合理、样本转运、储存和处理过程任何一个环节出现偏差,都可能导致结果的不正确。因此,严格按照《指南》及《新型冠状病毒肺炎病毒核酸检测专家共识》进行SARS-CoV-2核酸检测不仅可以降低工作人员在核酸检测过程中感染的风险,而且可以提高检测结果的符合率[6,9]。《指南》指出,实验室确认阳性病例需要满足同一份样本ORF1ab、N两个基因靶标的检测结果均为阳性;平行检测的两个样本同时为单靶标阳性,或者重新采样检测均为单靶标阳性,则判定为阳性[6]。此外,单独的核酸检测阴性结果,并不能100%排除感染SARS-CoV-2的可能性,因为病毒滴度低于试剂盒的最低检测限也会导致感染者的检测结果为阴性。由于N基因的扩增灵敏度高于ORF1ab,加上SARS-CoV-2 的mRNA(带有多数N基因、少量ORF1ab基因)含量大于RNA,且SARS-CoV-2 的N基因易与其他冠状病毒的核酸序列交叉,导致N基因扩增阳性而ORF1ab阴性,因此检测出N基因单靶标阳性的概率较大[10]。
尽管如此,目前SARS-CoV-2荧光PCR法仍然比其他检测方法的灵敏度更高,然而遗憾的是目前没有厂家研发出定量检测SARS-CoV-2的核酸检测试剂。2月19日国家卫生健康委员会发布《新型冠状病毒肺炎诊疗方案(试行第六版)》,将诊断标准统一分为“疑似病例”和“确诊病例”两类,对“疑似病例”只要满足SARS-CoV-2核酸检测阳性或基因序列与已知SARS-CoV-2高度同源的病原学证据之一即为“确诊病例”,核酸检测是临床SARS-CoV-2确诊的唯一依据[10-11]。
3.2 免疫学诊断法
免疫学诊断法基于抗原抗体的检测,然而要获得特异性识别抗体是一个很大的挑战,而单克隆抗体更是需要进行很长时间的免疫反应才可以获得,因此与核算检测相比,免疫学诊断法试剂的研发难度更大、周期更长。尽管如此,为了弥补核酸检测的局限性,仍然有很多研究人员和厂家在克服重重困难研究出检测抗原抗体的免疫学诊断法[12]。
3.2.1 免疫层析法
免疫层析法可以快速判断人体是否含有SARS-CoV-2抗原或抗体,与核酸检测相比,对临床实验室的操作要求更低,在基层实验室即可完成,而且对检验人员的要求也没有核酸检测那么高,简单培训即可操作。但是此方法目前只能用于定性检测。此方法的检查结果仅供临床参考,不应作为临床诊治的唯一依据。对SARS-CoV-2可疑患者,在核酸检测阴性的情况下,可以对患者进行抗原或IgM、IgG抗体检测。通常,IgM抗体在感染早期出现,IgG抗体在感染中晚期出现,滴度有一个持续增高的过程,并在血液循环中保持较长时间存在[2]。由于抗原抗体检测容易受到类风湿因子、非特异IgM、溶血所致的高浓度血红蛋白等干扰物质的影响而出现“假阳性”结果,所以抗原抗体检测必须采用IgM和IgG同时检测且通常需多次动态检测来确认,进而判断患者是否为急性或近期感染[2]。在SARS-CoV-2感染初期,病毒特异性IgM抗体未产生或滴度很低会导致阴性结果,因此对可能感染SARS-CoV-2病毒者,应在7~14 d 内复查,抽取第二份样本,并和第一份样本在同条件下同时检测,以确定是否有初次感染的血清转化或病毒特异IgG/IgM抗体滴度明显升高。另外,高滴度病毒特异性IgG抗体会与特异性IgM抗体竞争抗原结合部位,会使检测的敏感度降低,IgM结果可能会出现假性低值或阴性结果。其次对于免疫功能受损或接受免疫抑制治疗的患者,其血清学IgM/IgG抗体检测的参考价值有限。
此方法同样易受最低检测限的限制,阴性结果并不能排除SARS-CoV-2感染的可能性。另外,采样、样本储存不当或样本反复冻融均会影响检测结果。
3.2.2 酶联免疫法
酶联免疫法只用于检测SARS-CoV-2抗原或IgG、IgM抗体,检测结果同样不能作为临床确诊的唯一依据,结果阴性的样本也不能排除SARS-CoV-2感染的可能性。
3.2.3 化学发光免疫分析法
化学发光免疫分析法易受人抗鼠抗体(HAMA)、溶血、黄疸及脂血的干扰,使结果产生假阴阳性,因此同样只能作为可疑患者SARS-CoV-2 检测的辅助手段。此外,如果样本中的血红蛋白、总胆红素、类风湿因子及甘油三酯分别超过500 mg/dL、5 mg/dL、500 IU/mL、450 mg/dL,则此方法不适用。
4 结论
综上,SARS-CoV-2的精准检测对早期筛查以及前期和愈后的诊断意义重大。在规范操作的前提下,荧光PCR法可以精确对不低于试剂盒最低检测限的SARS-CoV-2进行确诊,辅助抗原抗体检测,根据IgG、IgM抗体滴度和多次动态检测的变化趋势,可以判断患者是否为急性或近期感染。
