家用、医用血糖监测系统准确度评价标准的差异性分析
2020-08-10宋伟王军续勇
宋伟,王军,续勇
北京市医疗器械检验所,北京市,101111
0 引言
血糖监测系统(blood glucose monitoring systems,BGMSs)是糖尿病管理的一个重要组成部分,广泛用于糖尿病患者中以监测其血糖变化,尤其是对于胰岛素治疗的患者意义重大。根据使用人群及使用地点的不同,血糖监测系统可分为家用和医用两种。家用血糖监测系统主要目标人群为糖尿病患者和正常人群,多在家中测量血糖,即我们通常认为的自测用血糖监测系统(self-monitoring blood glucose test system,SMBGs),主要用于使用者的健康管理;而医用血糖监测系统主要目标人群为疾病患者,使用人群为医护人员,在医疗机构中测试患者血糖,以辅助糖尿病患者诊断及治疗。
不管家用还是医用,人们对血糖监测系统的准确度要求越来越高,然而血糖测量干扰因素众多,血细胞比容、氧分压、内源性干扰物及操作者水平等因素都会直接影响到测试结果,进而影响到糖尿病的诊断、治疗及并发症的管理。因此血糖监测系统标准化问题尤为重要。但目前国际上对血糖监测系统标准化问题聚焦在自测用血糖监测系统,例如国际标准化组织(International Organization for Standardization,ISO)发布的ISO 15197《体外诊断检测系统 糖尿病管理中自测用血糖监测系统的要求》标准[1],成为欧盟及许多国家评价血糖监测系统的重要标准,部分医用血糖监测系统也在采用ISO标准作为其评价依据。然而美国食品药品监督管理局(Food and Drug Administration,FDA)从生物安全因素、使用有效性因素及管理有效性因素考量,认为家用和医用评价标准应不尽相同,2014年FDA起草了两份关于血糖监测系统评价的指南,即FDA指南Self-Monitoring Blood Glucose Test Systems for Overthe-Counter Use[2](以下简称FDA指南-OTC)和FDA指南Blood Glucose Monitoring Test Systems for Prescription Point-of-Care Use[3](以下简称FDA指南-POC),前者适用于非专业人士操作的家用血糖监测系统,即SMBGs,而后者适用于专业人士操作的医用血糖监测系统。美国临床和实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)亦发布POCT12-A3指南Pointof-Care Blood Glucose Testing in Acute and Chronic Care Facilities; Approved Guideline[4],对上市后医用血糖监测系统性能指标进行评价。本研究关注于评价血糖监测系统的上述四个标准文件,即ISO 15197标准,FDA指南-OTC,FDA指南-POC及CLSI指南POCT12-A3,着重分析四个标准文件对血糖监测系统准确度评价上的不同,旨在找出家用和医用血糖监测系统分开评价管理的必要性。
1 标准概述
ISO 15197是国际标准化组织(ISO)于2003年发布的针对SMBGs进行评价的标准,标准中明确指出其适用于非专业人士使用的血糖监测系统。2009年,因血糖技术的发展及临床专家的要求,ISO对2003版标准进行修订,至2012年修订完成,2013年5月发布,形成目前现行有效的版本ISO 15197:2013。2013版标准更加明确不适用范围,其中一条指出该标准不适用于糖尿病管理中自测血糖以外用于临床目的的血糖计量器,也就是不适用于医用血糖监测系统[5]。ISO 15197:2013标准对SMBGs性能评价产生巨大影响。目前欧盟执行标准统一为EN ISO 15197:2015[6],并已在2016年全面实施,其他各国也转换ISO 15197:2013标准,针对SMBGs上市前进行评价和监督。
FDA指南-OTC[2]和FDA指南-POC[3]是美国FDA于2014年发布的关于血糖监测系统性能评价的指导草案,旨在指导制造商开展适合的性能评价研究和510(k)申请文件的撰写,对上市前血糖监测系统相关产品质量进行监督。FDA认为[3],针对不同预期用户,血糖仪有其不同的自身特点,而制造商在设计血糖仪时应考虑到这一点,因此,FDA发布了适用于家用和医用血糖监测系统的两份指导文件。FDA相信,这种区分可以使制造商更好地设计血糖仪以满足其各自不同的预期用户群的需求,以提高产品的安全性及有效性。尤其对于医用血糖监测系统,FDA认为ISO 15197标准中的要求不足以保护患者,因此不推荐使用ISO 15197进行评价。FDA两份指南在准确度评价方面主要差异在于医用血糖监测系统中准确度的评价标准和增加额外评价试验,例如不同预期患者群体和不同样本类型的性能评估[7]。
CLSI指南POCT12-A3[4]是CLSI组织于2013年发布的关于医用血糖监测系统指南,目前为第3版。该指南介绍了在急慢性疾病护理中心血糖监测系统相关政策、操作者要求、医用血糖监测系统性能评估方案、结果报告和质量控制等内容,旨在指导急慢性疾病护理中心快速血糖检测的使用,系统建立血糖快速检测服务,以保证测试结果准确性,提高护理质量。CLSI指南评价上市后医用血糖监测系统,对上市后相关产品进行质量监督。
2 准确度评价
四个标准中ISO 15197:2013和FDA指南-OTC是针对SMBGs的评价,而FDA指南-POC和POCT12-A3是针对医用血糖监测系统的评价,在准确度评价上有相同点,亦有其各自特点,具体阐述如下(见表1)[7]。
2.1 评价方法
实验操作者不同:四个标准中都尽量体现预期用户使用情况。医用血糖监测系统评价标准FDA指南-POC和POCT12-A3中规定操作者需为专业人士,操作前需经过培训,具有一定背景知识,并严格按照产品说明书进行操作。而针对SMBGs评价标准FDA指南-OTC中规定操作者为非专业人士,而且至少10%的操作人员无血糖测量经验,其中包括非糖尿病人员。ISO15197:2013中准确度评价试验为正规培训的操作人员进行,但在用户评价试验中,操作者为非专业人士,而FDA指南-OTC将用户评价和准确度相结合,更能体现实际血糖仪准确度情况。
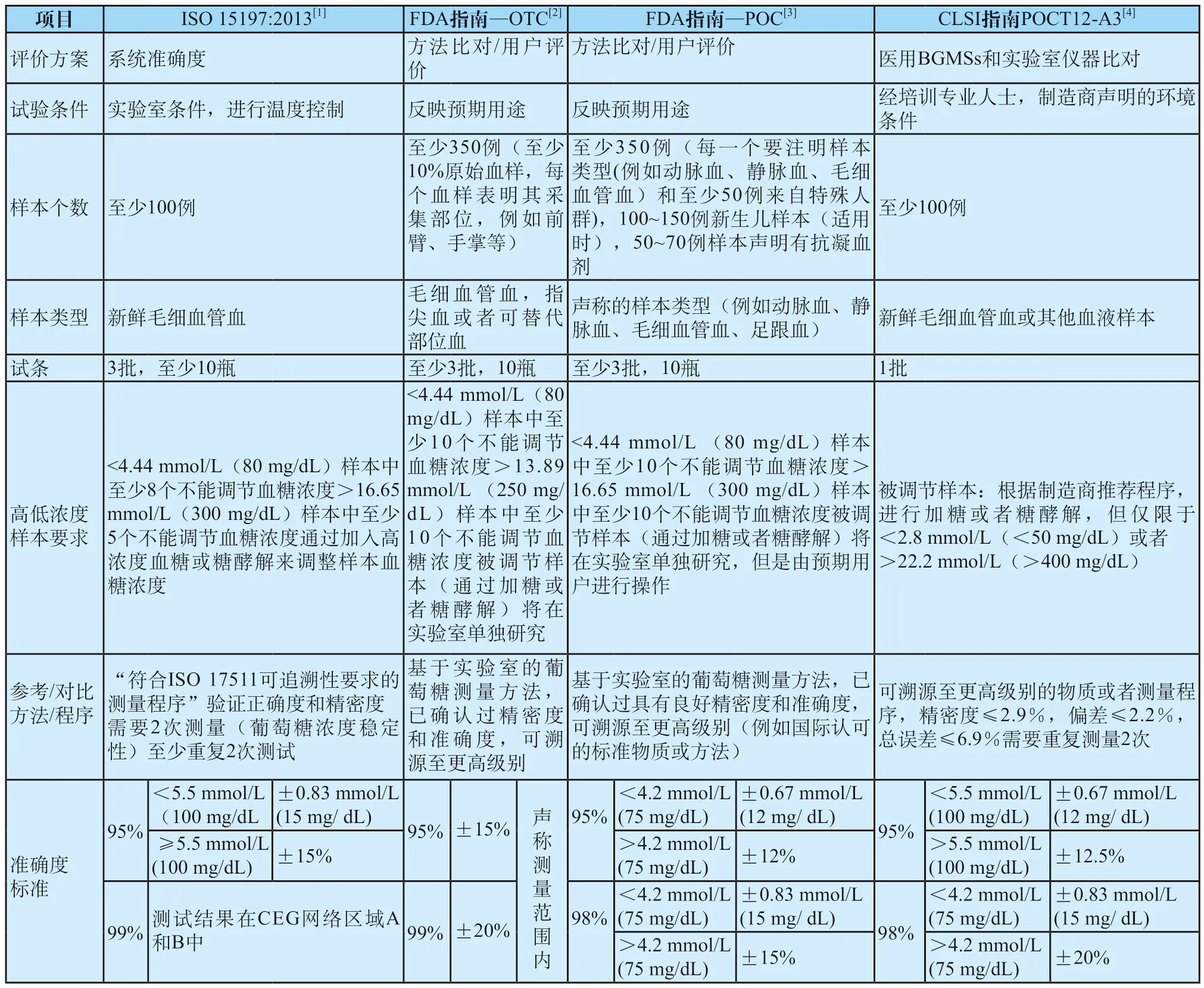
表1 四个标准对血糖监测系统准确度评价要求Tab.1 System accuracy requirements of four standards for BGMSs
样本来源不同:SMBGs 评价标准ISO 15197:2013和FDA指南-OTC均规定只能用新鲜毛细血管血进行试验,所不同的是,FDA指南-OTC中规定可以是多个采血部位,例如指尖、前臂和手心,但需评价制造商声称每一个采血部位。而医用血糖监测系统评价标准FDA指南-POC和POCT12-A3中样本类型未做限制,可以是动脉血、静脉血、毛细血管血及足跟血等制造商说明书声称的可用样本,FDA指南-POC中要求评价制造商声称的每一个样本类型。由此可见,医用血糖监测系统由于用于医疗机构中,样本来源比较广,需针对不同样本进行研究评价。
受试人群规定及数量不同:评价SMBGs系统的两个标准ISO 15197:2013和FDA指南-OTC无特殊规定,只要采集到满足对应血糖浓度的样本即可。而医用血糖监测系统评价标准POCT12-A3和FDA指南-POC中要求有代表性的患者样本。其中FDA指南-POC标准中规定最为严格,如果制造商声称血糖监测系统可用于特殊人群检测,则规定在至少350例样本中,至少50例样本来自特殊人群,这些特殊人群来自ICU病房、新生儿病房、儿科病房和手术室等,包括心脏病患者、肺病患者、手术患者和肿瘤患者,如果制造商声称测试结果对某抗凝剂无影响,试验设计至少包含含有此抗凝剂的50~70例样本。另外,FDA指南-POC中规定需设计额外试验针对新生儿样本的准确度评价。针对受试者数量,FDA要求数量更多,更严格,虽然ISO 15197:2013和CLSI指南POCT12-A3要求至少100名受试者进行双重测量,但两份FDA指南都要求至少350名受试者,并且不允许去除任何数据。
对于样本血糖浓度的要求,四个标准均规定覆盖制造商声称的测量范围。其中ISO 15197:2013给出了具体分段区间及每个区间样本数量。对于接近线性两端的极限样本获得,四个标准均同意可采取加入高浓度糖及糖酵解的方法以调节样本血糖浓度,所不同的是四个标准对于调节样本数量和浓度选择要求不同。FDA要求更严格一些,而且被调节样本需单独试验设计进行评价。
2.2 参考方法/比对方法
随着准确度要求越来越严格,参考方法/比对方法的选择亦越来越重要。医用血糖监测系统和SMBGs评价标准中对此规定没有明显差别。四个标准均要求所选参考方法/比对方法有良好的溯源性,而且溯源级别不能太低,ISO 15197:2013[4]中规定选择符合ISO 17511可追溯性要求的测量程序;ISO 15197:2013[4]和POCT12-A3[6]标准中还描述了验证参考方法的正确度和精密度的程序,例如使用有证参考物质进行验证。POCT12-A3[6]标准文件中对这些指标做了具体的规定,即要求参与比对的实验室仪器的精密度≤2.9%,偏差≤2.2%,总误差≤6.9%。相比之下,FDA要求为参考测量程序的质量提供了更多的余地,表明它必须“经过良好的精密度和准确度验证”即可。ISO 15197:2013和POCT12-A3指南提到参考方法/比对方法需要测试两次,而FDA未做要求。
2.3 判定标准
理论上,SMBGs属于自测用、家用仪器,非专业人士操作,而医用血糖监测系统属于医院用仪器,专业人士经培训后操作,因此,医用血糖监测系统的准确度评价标准应严于SMBGs。纵观这四个标准对于准确度的要求,严格顺序大致为:高浓度血糖区间(>4.2 mmol/L(75 mg/dL)),FDA指南-POC严于POCT12-A3严于FDA指南-OTC严于ISO 15197:2013,而在低浓度血糖区间(≤4.2 mmol/L(75 mg/ dL)),则是FDA指南-OTC严于FDA指南-POC严于POCT12-A3严于ISO 15197:2013。举例说明,对于3.0 mmol/L的血糖样本,按照FDA指南-OTC的要求(95%的结果在±15%内,99%的结果在±20%内),95%的结果偏差应在±0.45 mmol/L,99%的结果偏差应在±0.60 mmol/L以内,而按照FDA指南-POC的要求,95%的结果偏差是在±0.67 mmol/L以内,98%的结果偏差在±0.83 mmol/L以内,很明显,FDA指南-OTC的要求严格很多,而且血糖浓度越低,其要求越严格。那为什么在低葡萄糖浓度区间,FDA指南-OTC对SMBGs的性能要求如此严格?其实,FDA清楚不是所有SMBGs准确度要求都能达到FDA指南-OTC要求的标准,尤其低血糖浓度区间,因此FDA希望制造商可以提高测量下限来达到标准要求,以减少低浓度血糖测试不准确的风险,FDA指南-OTC标准中对于SMBGs测量范围下限为不高于2.78 mmol/L(50 mg/dL),而FDA指南-POC中规定测量范围下限不高于0.56 mmol/L(10 mg/dL)。另一方面,SMBGs用于非专业人士家庭用,而低血糖的危害远高于高血糖,因此,对于低血糖浓度区间的准确度要求,FDA更偏向SMBGs的指标更严格,以提高该类产品的安全性。在四个标准中,ISO 15197:2013准确度的要求最低,所以FDA不推荐医用血糖监测系统按照ISO的标准评价。
3 结语
随着血糖技术的发展和临床需求的提高,人们对血糖仪准确度要求越来越高,我们从四个标准的制修订过程中可以看出,血糖监测系统准确度评价标准也越来越严格。家用血糖监测系统主要用于健康管理,操作过程中干扰因素较少,错误结果导致后果较轻微,而医用血糖监测系统测量过程中用药与疾病导致的干扰因素较多,错误结果导致后果较严重。通过分析四个标准中准确度的评价过程,我们可以看出,SMBGs和医用血糖监测系统在准确度评价方法和判定标准上是有差异的,医用血糖监测系统标准在操作者要求、样本来源、受试人群及判定标准等方面,均严于SMBGs标准,医用血糖监测系统需要更多的试验来证明不同样本的适用性。总体来说,医用血糖监测系统更严格一些,而SMBGs应该更安全一些。美国FDA对于家用和医用血糖监测系统分别制定标准进行管理的做法,能够促使制造商设计出不同性能特点的血糖仪以满足预期用户的需求,在一定程度上促进了血糖监测系统的发展和应用。而目前我国未把家用和医用血糖监测系统分开监管,市场上大部分产品均为SMBGs,这些产品按照自测用血糖监测系统的标准进行性能评价,通过审批进入市场后一小部分却进入医院,作为医用血糖监测系统在使用,对患者而言存在一定风险性。因此将医用和家用血糖监测系统分开评价并管理,对于规范血糖监测系统应用市场、保障其安全性及有效性是十分必要的。
