苄星青霉素不同孕期用药对妊娠合并梅毒感染者母婴结局影响
2020-08-08李彩霞
陈 春 李彩霞
西安交通大学医学院附属汉中3201医院(723000)
梅毒传染性极强,95%以上经性传播,危害性仅次于艾滋病[1]。妊娠合并梅毒(PS)早期缺乏典型症状且病程较长,可侵袭全身个脏器系统,严重影响孕妇健康,如未及时规范化治疗可经胎盘传播给胎儿,诱发稽留流产、早产、死产或新生儿先天性梅毒(NCS)等严重后果[2]。治疗PS的原则是明确诊断后规范应用足量药物治疗,目前首选青霉素,以苄星青霉素应用较多,虽然已有研究显示越早用药对改善妊娠结局及新生儿状况具有积极意义[3],但多缺乏对产后新生儿血清学改善的随访观察。本研究回顾性分析了使用苄星青霉素治疗的PS患者临床资料,分析不同用药时机对母婴结局的影响及其婴儿6月龄时血清学情况,为临床诊疗及NCS的预防提供参考。
1 资料与方法
1.1 一般资料
回顾性收集2015年1月-2018年1月本院接受驱梅母婴阻断治疗的PS孕妇151例。纳入标准:①符合《妊娠合并梅毒的诊断和处理专家共识》[4]PS诊断标准;②入组时尚未接受规范驱梅治疗;③单胎妊娠;④自愿接受抗梅毒治疗,有条件在我院接受后期孕检、分娩及随访;⑤认知功能及精神状态正常,能够配合临床试验。排除标准:①习惯性流产者;②合并其他妊娠期合并症或并发症者,如妊娠期糖尿病、妊娠期高血压等;③合并心、脑、肝、肾等重要脏器系统功能障碍或严重原发病者;④合并精神障碍者;⑤对本研究用药过敏或过敏性体质者。根据治疗时机分为孕早期(<13+6周)用药组(51例),孕中期(14~27+6周)用药组(63例),孕晚期(≥28周)用药组(37例)。患者及家属均充分了解并签署知情同意书。研究获得医院伦理委员会审核批准。
1.2 治疗方法
经确诊后均予以苄星青霉素肌内注射,240万U/次,1次/周,连续用药3周为1个疗程。孕早期和孕中期组在确诊后及妊娠晚期各治疗1个疗程,如TRUST滴度下降2倍比稀释度以上或转阴则停止治疗;孕晚期组在确诊后治疗1疗程,并在胎儿分娩后即刻予以苄星青霉素15万U肌注。治疗期间严禁性生活,其配偶接受相关检查与治疗。3组均在新生儿娩出后采集母血及新生儿血(包括死胎、死产、流产儿)检查不加热血清试验(TRUST),活产新生儿按照NCS标准予以预防性隔离治疗。
1.3 观察指标
统计妊娠结局,包括分娩孕周、剖宫产、死胎(孕20周后胎儿宫内死亡)或死产(生产过程中胎儿死亡)、流产(妊娠不足28周且胎儿体重<1kg而终止妊娠)、早产(孕28~37周内分娩)发生率;观察新生儿出生体质量、出生1min和5min Apgar评分,统计低体重儿(出生体重<2500g)、新生儿窒息(Apgar评分≤7分)和NCS发生率。NCS诊断标准[5]:①产妇及新生儿血清学TRUST+螺旋体明胶颗粒凝集试验(TPPA)呈阳性,且新生儿TRUST滴度是其母亲分娩前4倍;②新生儿具有≥2项NCS临床症状及体征,包括新生儿窒息或呼吸困难、低出生体重、病理性黄疸、梅毒假性麻痹、贫血、血小板减少、腹胀、水肿、黏膜损害、皮肤损害(肢端掌趾脱皮、皮肤斑疹或斑丘疹)、肝脾肿大等。
1.4 统计学分析
2 结果
2.1 各组一般资料比较
3组151例中梅毒潜伏共129例(85.4%),年龄分别为孕早期组28.1±4.7岁、孕中期组28.1±4.1岁、孕晚期组27.7±4.4岁,各组一般资料比较未见差异(P>0.05)。见表1。
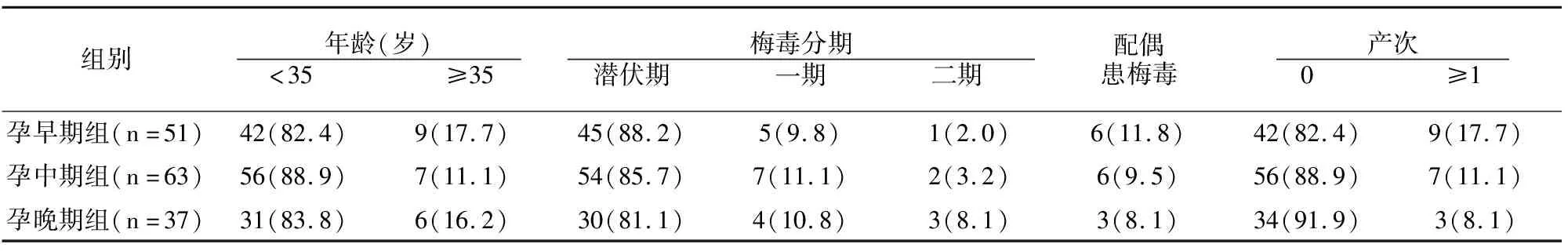
表1 各组一般资料比较[例(%)]
2.2 各组妊娠结局比较
分娩孕周、足月分娩率、早产率及不良结局总发生率各组比较有差异(P<0.05),剖宫产率、死胎/死产及流产发生率各组未见差异(P>0.05)。孕早期组的分娩孕周及足月分娩率高于另外两组,早产率及不良妊娠结局总发生率低于另外两组(P<0.05),而另外两组组间比较未见差异(P>0.05)。见表2。
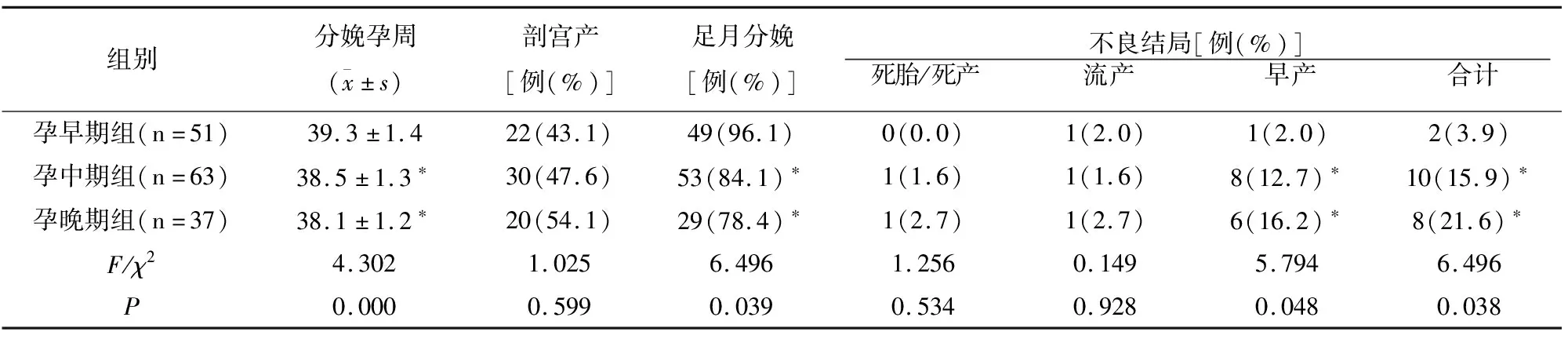
表2 各组妊娠结局比较
2.3 各组新生儿预后情况比较
各组活产新生儿均无产后死亡,无重度窒息新生儿,均为轻中度窒息(Apgar评分4~7分)。孕早期组新生儿出生1min、5min Apgar评分高于另外两组,新生儿窒息和NCS发生率低于另外两组(P<0.05);低体重儿比较各组无差异(P>0.05)。见表3。

表3 各组新生儿情况比较
2.4 各组产妇及新生儿TRUST滴度比较
新生儿娩出后(包括死胎/死产/流产),孕早期组产妇和新生儿TRUST阴性率均高于另外两组(P<0.05),而另外两组无差异(P>0.05)。见表4。
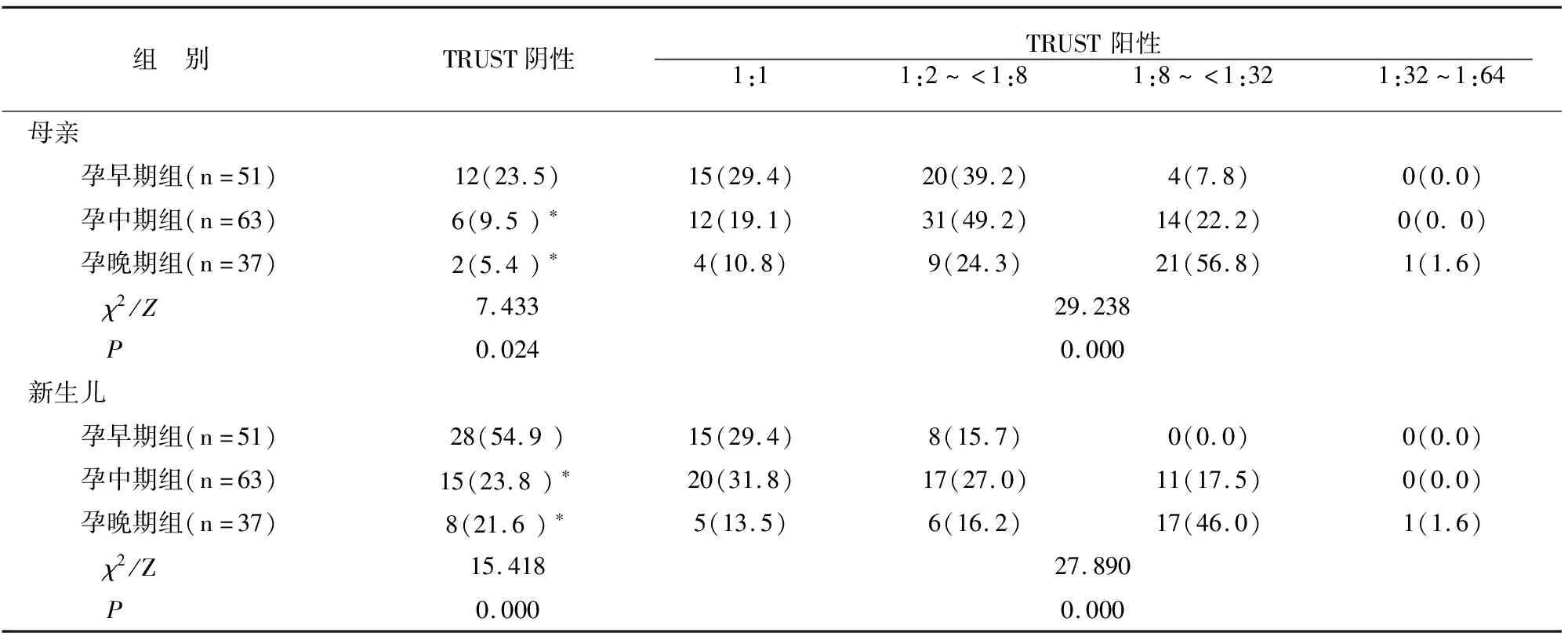
表4 各组产妇及新生儿TRUST及滴度情况比较[例(%)]
2.5 各组婴儿6月龄时TRUST滴度比较
活产新生儿均征求家长同意及青霉素皮试后,我国按照NCS标准进行正规抗梅毒治疗,其中孕中期组1例在出生后3个月时失访,其余孕早期组、孕中期组及孕晚期组(50例、60例、35例)新生儿均最终完成随访。孕早期组新生儿TRUST转阴率100%(50/50),孕中期组1例新生儿TRUST 1:1阳性,其母亲TRUST滴度为1:32,其余新生儿均获得转阴,转阴率98.3%(59/60);孕晚期组1例新生儿TRUST滴度为1:4,其母亲TRUST滴度为1:64,其余新生儿均获得转阴,转阴率为97.1%(34/35)。各组新生儿6月龄转阴率比较未见差异(χ2=1.298,P=0.523>0.05)。
3 讨论
流行病学研究显示,梅毒感染发病率呈现逐年上升趋势[6]。大部分孕妇感染梅毒后处于潜伏期状态,多在产检时被发现,部分孕妇甚至因先兆流产被发现,导致防治难度极大,增加母婴不良结局发生风险[7]。PS孕妇在孕6周内即可能发生流产,孕16~20周后梅毒苍白螺旋体能够经胎盘播散至胎儿,且妊娠时间越长胎儿感染风险越高,孕8个月时胎儿感染率最高[8]。窦丽霞等[9]研究表明,发病年龄、梅毒分期、TRUST滴度及治疗时机是影响PS不良妊娠结局的独立危险因素,年龄越大、分期越高、高RPR滴度(≥1:8尤其是≥1:64)、晚期开始治疗将增加母婴不良妊娠结局发生风险。文献报道显示,妊娠期潜伏期梅毒在不治疗情况下胎儿梅毒感染率达80%以上,而Ⅰ、Ⅱ期梅毒如不及时治疗,其胎儿的梅毒感染率将达到100%[10]。因此,是否接受治疗及治疗及时与否与PS患者的妊娠结局具有密切关系。
目前,临床对PS的处理尚存一定争议。既往观点认为,对PS应尽早终止妊娠,以降低NCS新生儿的出生,但近年来大部分学者认为除非患者本人强烈要求终止妊娠,否则所有PS患者均应积极采取规范化治疗,以阻断母婴传播,降低NCS的发生风险。青霉素类药物是临床治疗PS质优价廉的药物,对Ⅰ~Ⅲ期梅毒及隐性梅毒均具有良好疗效,其中苄星青霉素已被美国和英国推荐为一线药物[11]。用药0.5h即可达到血药峰浓度30U/L以上,血药有效浓度维持时间较长,对非妊娠梅毒感染及PS均具有较好的治疗效果[12]。陈春燕等[13]研究显示,苄星青霉素对PS的治疗效果优于普鲁卡因青霉素,能够更好地改善妊娠结局并降低NCS发生率。
本研究观察分析了苄星青霉素不同孕期用药对PS患者妊娠结局及胎儿预后的影响。结果显示,孕早期PS治疗效果明显优于孕中、晚期开始治疗者,提高了足月分娩率,降低了不良分娩结局。新生儿结局显示,孕早期组的Apgar评分更高,新生儿窒息率及NCS发生率更低。进一步表明PS治疗时机越早,新生儿预后越好,NCS发生率越低,孕早期诊断和治疗更有利于改善PS患者的妊娠结局及胎儿结局,有效控制梅毒感染并降低NCS的发生。由于PS抗梅毒治疗后血清TRUST转阴或滴度降低有一定过程,开始治疗时机较晚时往往TRUST尚未转阴或滴度降低不明显,新生儿已经遭受梅毒螺旋体侵害。
血清TRUST滴度检测是筛查梅毒感染并评价感染强度的重要指标之一。徐美凤等[14]研究显示,孕妇TRUST 滴度<1:8时经积极抗梅毒治疗后,早期与晚期治疗组的NCS发生率并无明显差异;滴度≥1:8时,早期治疗组的NCS发生率明显低于晚期组,认为孕妇TRUST滴度较高时,尽早开展抗梅毒治疗有利于降低NCS发生风险。本研究中孕早期组产妇及其新生儿的TRUST滴度阴性率低于另外两组,且TRUST阳性滴度多为<1:8,与既往报道[15-16]基本一致。提示孕早期开始治疗更有利于孕产妇TRUST转阴。随访至婴儿6月龄时,孕早期组存活新生儿的TRUST滴度均转阴,而另外两组均分别有1例婴儿TRUST未转阴,TRUST滴度分别为1:32阳性、1:64阳性,考虑为PS发现时间相对较晚,且孕妇TRUST滴度较高所致。本资料中隐性梅毒率达85.4%。梅毒在人体内的潜伏时间较长,血清学窗口期为感染后2~3周内,该阶段筛查梅毒可能呈阴性,故孕早期血清检查可能有较高的误诊或漏诊率,延误最佳治疗时机而影响妊娠结局及胎儿预后[17]。
综上所述,苄星青霉素仍应作为治疗PS的首选药物,且早期积极筛查及时诊断并规范抗梅毒治疗能够有效改善PS患者的妊娠结局及新生儿结局,降低流产、早产及NCS发生风险。与此同时,对PS的筛查应贯穿整个孕期,在孕早、中、晚期均应行梅毒筛查,以便及早发现和治疗,最大限度降低NCS发生风险。本研究样本有限,对婴儿出生后随访时间尚短,远期影响还有待进一步观察。
