来氟米特通过调节miR-449a 在肺纤维化中的机制研究
2020-08-07赖伟男陆军军医大学新桥医院药剂科重庆400037南方医科大学南方医院风湿免疫科广东广州
刘 冬,赖伟男 (. 陆军军医大学新桥医院药剂科,重庆 400037;. 南方医科大学南方医院风湿免疫科,广东 广州
510515)
成纤维细胞的增殖和活化引起的细胞外基质(extracellular matrix,ECM)的累积是肺纤维化的主要病理基础[1]。肺纤维化治疗难度大,且发展到晚期纤维化过程不可逆转,而一些药物的长期使用会提高肺纤维化的发生风险,对于这临床的一类并发症应格外重视。来氟米特(leflunomide,LEF)是治疗类风湿性关节炎的常用药物,但是有临床报道称,长期服用LEF 可能提高肺纤维化的发生风险,但是也有研究认为LEF 对肺纤维化影响不大[2]。微小RNA(microRNA,miRNA)长度约为18~22 个核苷酸,虽然不具备编码功能,但是可通过识别和碱基配对的方式与靶基因信使RNA(message RNA,mRNA)的3'非翻译区(3'UTR)结合,从而参与基因表达的调控[3]。miR-449a 具有抑制肿瘤细胞的增殖并诱导凋亡的作用[4],并且最新研究发现miR-449a 可能与肺纤维化有关,在二氧化硅诱导的肺纤维化模型中,miR-449a 可通过调节自噬缓解纤维化[5]。c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是调节细胞增殖、凋亡和分化的重要蛋白,其磷酸化后可通过信号转导调控细胞生物学行为[6]。本文发现了miR-449a 的过表达会显著缓解由LEF 引起的肺成纤维细胞的增殖,而沉默miR-449a 对细胞的影响相反,这可能是LEF 引起肺纤维化的机制之一,报道如下。
1 材料与方法
1.1 试剂与仪器
人肺成纤维细胞MRC-5 购自美国ATCC;LEF(苏州长征-欣凯制药有限公司,国药准字H20000550);RPMI-1640 培养基以及血清购自美国Gibco 公司;miR-449a mimic 和inhibitor 质粒由Genepharma 公司构建;
LipofectamineTM2000(美国Invitrogen 公司);荧光显微镜(Olympus BX51);Model 680 酶标仪(Bio-Rad,美国);流式细胞仪(BD FACScanto II,Becton Dickinson,美国)。CCK-8 试剂盒(武汉华美公司);凋亡试剂盒(美国Thermo Fisher);PVDF 膜(美国Bio-Rad 公司);抗体购自美国Abcam 公司,逆转录试剂盒TaKaRa 和SYBR Prellix Ex TaqTM 实时PCR 试剂盒购自TaKaRa(日本)。
1.2 细胞分组和转染
MRC-5 细胞在RPMI-1640 培养基中培养,温度为37 ℃,CO2浓度为5%。细胞被分为6 组,即对照组、LEF 组、LEF+mimic 组、mimic 组、LEF+inhibitor 组和inhibitor 组。其中LEF+mimic 组和mimic 组 通 过 转 染miR-449a mimic 质 粒 过 表 达miR-449a 的水平,LEF+inhibitor 组和inhibitor 组通过转染miR-449a inhibitor 质粒使miR-449a 的水平降低。对照组转染空载质粒。LEF 组、LEF+mimic组和LEF+inhibitor 组分别在5 mg/L LEF 的条件下培养48 h。
1.3 检测指标和方法
1.3.1 qPCR 检测miR-449a
将细胞裂解后收集总RNA 并检测纯度,通过逆转录试剂盒合成cDNA,然后进行PCR 反应,步骤如下:95 ℃下2 min,95 ℃下15 s,60 ℃下25 s和72 ℃下60 s,共进行40 个循环。以U6 作为内参,使用2-ΔΔCT法分析miR-449a 水平。引物序列如下(5′-3′),miR-449a 上游引物:TGCGGTGGCAGTGTATTGTTAGC,下游引物:CCAGTGCAGGGTCCGAGGT;U6 上游引物:GGGCAGGAAGAGGGCCTAT,下游引物:TATGGCTAGCATGACTGGT。
1.3.2 CCK-8 法检测细胞活力
将细胞调节至2×104个细胞/ml 的密度,接种于96 孔板中,100 μl/孔。再培养24、48 和72 h 后将10 μl 的CCK-8 试剂加入至每孔中,37 ℃下培养2 h。在酶标仪上测量450 nm 处的吸光度(A),计算相对细胞活力。
1.3.3 克隆形成检测细胞增殖能力
分别将各组细胞200 个细胞在6 孔板中培养,每3 天补充一次培养基,培养2 周。用PBS 洗涤细胞并加入甲醇固定15 min,加入使用结晶紫染色30 min,在显微镜下观察克隆形成的数目,≥50 个细胞的集落为一个克隆形成。
1.3.4 流式细胞术检测细胞凋亡
将细胞洗涤后重悬于结合缓冲液中,使细胞浓度为2.5×105个/ml。根据试剂盒说明书将试剂加入细胞中,并通过流式细胞术分析细胞凋亡情况。
1.3.5 免疫荧光染色
通过免疫荧光染色检测α 平滑肌肌动蛋白(α smooth muscle actin,α-SMA)和胶质蛋白I(collagen I,Col I)的表达情况分析细胞的表型和细胞外基质。然后将细胞在4 ℃下使用α-SMA 的抗体染色过夜,用异硫氰酸四甲基罗丹明的山羊抗兔抗体染色30 min。然后再于避光条件下利用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)对细胞核染色10 min,通过荧光显微镜观察。
1.3.6 Western blot 检测蛋白表达
通过Western blot 检测JNK 和磷酸化JNK(p-JNK)蛋白的水平。将细胞裂解、离心收集总蛋白并检测蛋白浓度。使用10%的SDS-PAGE 凝胶用于电泳分离蛋白,电泳后使用PVDF 膜转膜并在室温下用5%无脂牛奶封闭2 h。分别加入一抗(稀释1:1 000)室温震荡2 h,后在4 ℃孵育过夜,加入二抗(稀释1:5 000),孵育3 h。通过Quantity One软件分析条带的灰度值并以GAPDH 为参照计算目标蛋白质的表达量。
1.4 统计学处理
实验数据采用SPSS 19 软件进行处理,实验结果以平均值±标准偏差(SD)表示,组间比较采用单因素方差分析和t检验,统计学显著性表示为P<0.05。
2 结果
2.1 各组细胞miR-449a 表达水平
使用qPCR 检测各组细胞中miR-449a 表达水平。结果显示mimic 组miR-449a 水平显著高于对照组,inhibitor 组的miR-449a 表达水平显著低于对照组(P<0.05),说明转染实验成功。LEF 组的miR-449a 水平显著低于对照组(P<0.05),并且LEF+mimic组的miR-449a 的表达水平显著高于LEF 组,LEF+inhibitor 组的miR-449a 显著低于LEF 组(P<0.05)。表明LEF 可抑制人成纤维细胞中miR-449a 的表达,见表1。

表1 各组miR-449a 表达水平比较
2.2 各组细胞的细胞活力比较
使用CCK-8 法检测各组细胞的相对细胞活力。结果显示在第48 小时和第72 小时,LEF 组和inhibitor 组的细胞活力显著高于对照组(P<0.05),而mimic 组的细胞活力显著低于对照组(P<0.05)。此外,LEF+mimic 组的细胞活力显著低于LEF 组,LEF+inhibitor 组的细胞活力显著高于LEF 组(P<0.05),过表达miR-449a 可部分逆转LEF 对促进人成纤维细胞的细胞活力的作用,而降低miR-449a 的水平会进一步促进细胞活力,见表2。
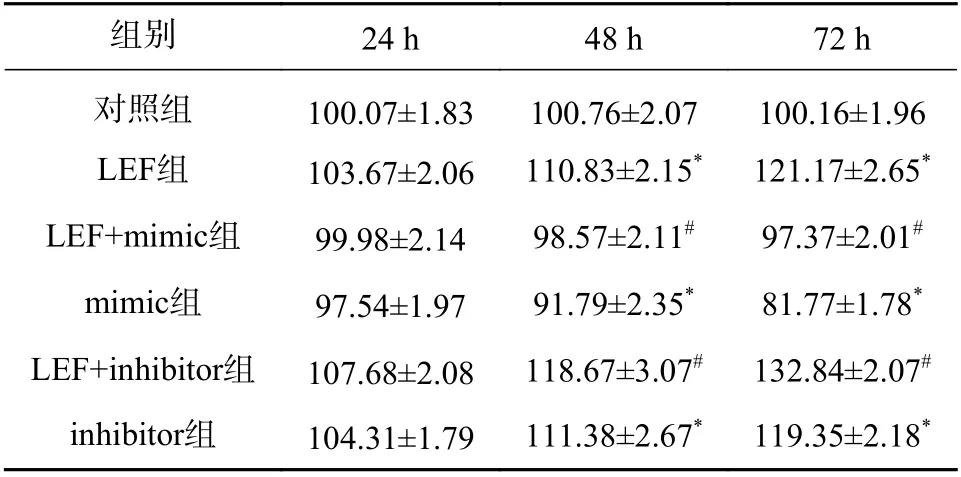
表2 各组细胞的相对细胞活力比较(%)
2.3 各组细胞增殖和凋亡情况比较
LEF 组和inhibitor 组的克隆形成数目显著高于对照组而细胞凋亡率低于对照组(P<0.05),mimic 组的克隆形成数目显著低于对照组而细胞凋亡率显著高于对照组(P<0.05)。此外,LEF+mimic组的克隆形成数目显著低于LEF 组而细胞凋亡率显著高于LEF 组(P<0.05),LEF+inhibitor 组的克隆形成数目在LEF 的基础上进一步升高而细胞凋亡率进一步降低(P<0.05)。过表达miR-449a 可逆转LEF 促进肺成纤维细胞增殖和抑制凋亡的作用,而低表达miR-449a 会加剧LEF 的作用,见表3。

表3 各组细胞增殖和凋亡情况比较
2.4 各组细胞中α-SMA 和Col I 水平比较
本次研究通过免疫荧光技术检测了各组α-SMA 的水平来分析细胞向肌细胞转化情况,检测Col I 的水平来分析ECM 水平。其中蓝色荧光为细胞核,红色荧光为α-SMA 或Col I 蛋白。LEF 组和inhibitor 组的荧光强度显著高于对照组(P<0.05),而mimic 组的相对荧光强度低于对照组(P<0.05)。此外,LEF+mimic 组的相对荧光强度显著低于LEF 组(P<0.05),LEF+inhibitor 组的相对荧光强度显著高于LEF 组(P<0.05)。过表达miR-449a 可部分逆转LEF 对促进人成纤维细胞α-SMA 和Col I 表达的促进作用,见图1、图2 和表4。
2.5 各组p-JNK/JNK 水平比较
LEF 组和inhibitor 组的p-JNK/JNK 水平高于对照组,mimic 组的p-JNK/JNK 水平显著低于对照组(P<0.05),并且LEF+mimic 组中p-JNK/JNK 水平显著低于LEF 组(P<0.05),LEF+inhibitor 组中p-JNK/JNK 水平显著高于LEF 组(P<0.05)。过表达miR-449a 可逆转LEF 促进JNK 蛋白磷酸化的作用,见表5。
3 讨论
肺纤维化是一种慢性进行性肺部疾病,但是临床上尚无治疗肺纤维化的特效方法和药物,目前用于进行性肺纤维化的唯一有效治疗方法是肺移植[7],若患者未接受肺移植,通常在诊断后的3 至5 年内出现肺功能丧失导致呼吸衰竭和死亡。肺纤维化的病理特征包括纤维增生和ECM 沉积过多,但是这个过程较为漫长,并且在早期症状不明显,也缺乏相应的诊断手段,在患者确诊为肺纤维化时再采取治疗效果有限。因此虽然LEF 是否会引起肺纤维化尚无定论,但是由于肺纤维化的恶性预后和致死率,LEF 治疗过程中的肺纤维化风险仍是临床重点关注的问题。研究LEF 促进肺纤维化的机制是寻找诊断和治疗肺纤维化新方法的重要途径。

表4 各组细胞α-SMA 相对荧光强度比较

表5 各组p-JNK/JNK 相对水平比较
LEF 是一种调节免疫的药物,其作用机制通过抑制二氢乳清酸脱氢酶来抑制T 淋巴细胞和其他类型细胞的细胞周期进程[8]。LEF 引起的肺纤维化并导致患者死亡的病例随着LEF 使用时间的增加而升高[9]。一项长期的调查随访报告指出,在5911 例使用LEF 治疗的患者中,共出现了80 例间质性肺病,其中有27 例患者死亡,并且结果判定其中有18 例患者的死亡是由于LEF 直接导致[10-11]。在肺纤维化的过程中,成纤维细胞向成肌纤维细胞转化和ECM 的累积是两大特点[12]。因此本文主要分析了LEF 对人肺成纤维细胞的影响,结果显示LEF 可显著促进成纤维细胞的细胞活力和增殖,抑制其凋亡,并诱导细胞表达大量的α-SMA 蛋白和ECM 累积。α-SMA 是上皮细胞向间质细胞转化的检测指标之一,也是体外研究肺纤维化的最常用指标,而Col I 是ECM 的主要成分[13]。作者提示了LEF 可通过活化成纤维细胞和促进其增殖参与肺纤维化。
为进一步分析LEF 调节肺成纤维细胞增殖和表达α-SMA 的机制,我们检测了miR-449a 在其中的作用。miR-449a 是近年来新发现的一种miRNA,研究已经证实了其可通过靶向并诱导靶基因mRNA 降解,抑制肺癌细胞的增殖、上皮间充质转化[14-15]。本次研究结果显示LEF 可抑制miR-449a 的表达水平,并且过表达miR-449a 可抑制成纤维细胞的细胞活力、细胞增殖能力,抑制α-SMA 和Col I 蛋白的表达,并促进其凋亡。过表达miR-449a 会逆转由LEF 引起的细胞活化、增殖以及α-SMA 和Col I 蛋白的表达,而抑制miR-449a的水平会进一步加剧LEF 的促纤维化作用。Zhang等[16]的研究结果也显示miR-449a 具有调节α-SMA 蛋白表达的作用。通过进一步的研究我们还发现LEF 可促进JNK 的磷酸化,过表达miR-449a 会抑制JNK 磷酸化水平并显著逆转LEF 促进JNK 磷酸化的作用。JNK 的活化在促进肺癌发生和发展中的作用已经被广泛证实,此外,JNK 可活化可能通过活化肝星状细胞引起肝纤维化[17]。Yang 等[18]的研究结果显示阻断JNK 途径可抑制成纤维细胞样滑膜细胞的活性,并抑制迁移和侵袭。Shingyochi 等[19]的研究结果也显示了激活JNK 通路会促进成纤维细胞的增殖和迁移。这提示LEF 可能通过miR-499a 促进JNK 蛋白的磷酸化,从而促进肺成纤维细胞的活化和增殖,并促进细胞向肌纤维细胞转化和ECM 的累积,进而引起肺纤维化。
综上所述,LEF 可能通过抑制肺成纤维细胞中miR-449a 的表达激活JNK 途径,促进α-SMA的表达和ECM 的累积,从而诱导成纤维细胞的活化和增殖,抑制其凋亡,从而引起肺纤维化。但是,关于LEF 调节miR-449a 的机制和miR-449a 在JNK 途径中的作用仍需要进一步的研究。
