基于网络药理学研究柴胡达胸合剂治疗新型冠状病毒肺炎的作用机制
2020-08-07肖志军刘萃萃陆赛花上海交通大学附属第六人民医院南院药剂科检验科上海201499
肖志军,刘萃萃,陆赛花,蔡 建,徐 峰 (上海交通大学附属第六人民医院南院:. 药剂科, . 检验科,上海201499)
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19),是指2019 年始发、由严重急性呼吸道综合征冠状病毒2 型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起的肺炎。截至2020 年4 月5 日,全球共确诊COVID-19 患者1 093 349 例,死亡58 620 例[1]。目前尚无针对COVID-19 的特异性治疗药物,一些化学药物包括氯喹/羟氯喹、洛匹那韦/利托那韦、瑞德西韦等正在临床开展随机对照研究。临床实践表明,清肺排毒汤和连花清瘟胶囊等多种中药方剂和制剂对COVID-19 有良好的治疗效果。据国家卫生健康委员会报道,在我国确诊的COVID-19 病例中,有74 187 人使用了中医药,占91.5%;中医药能够缓解症状,减少轻型、普通型疾病向重型发展,提高治愈率、降低病死率,总有效率达90%以上[2]。
柴胡达胸合剂,曾用名为“强力肺炎1 号”,是国医大师梅国强教授为痰热壅肺证COVID-19 患者制定的中药处方[3]。柴胡达胸合剂由小柴胡汤、小陷胸汤、达原饮、止嗽散共同组方,包含柴胡、黄芩、法半夏、全瓜蒌、黄连、枳实、甘草、浙贝母、桔梗、百部、前胡、紫苑、款冬花、槟榔、草果、藿香、佩兰、虎杖共十八味中药。由于临床使用疗效显著,2020 年2 月23 日,湖北省药品监督管理局下发制剂备案批件,包括柴胡达胸合剂在内的2 个由湖北省中医院研制的医院制剂获批用于防治COVID-19[4]。
网络药理学是基于系统生物学和多向药理学技术和方法,通过构建“药物-基因-疾病”网络,分析药物在网络中与特定节点相互作用的关系,从整体角度探索药物与机体相互作用的一门学科[5]。2007 年,Hopkins 首次在Nature Biotechnology杂志上发表述评,提出网络药理学这一概念,并认为其为发现新药的新范式[6]。中药通过多成分、多靶点、多通路对疾病产生治疗作用,利用网络药理学方法,可系统阐明中药治疗疾病的药理作用机制[7]。
因此,本研究运用网络药理学方法,筛选柴胡达胸合剂治疗COVID-19 的活性成分和作用靶点,构建“药材-活性成分-靶点”网络图,然后对靶点进行蛋白质-蛋白质相互作用(protein-protein interaction, PPI)、GO 基因注释和KEGG 信号通路分析,为进一步阐明柴胡达胸合剂治疗COVID-19 的药理作用机制提供理论依据。
1 材料与方法
1.1 柴胡达胸合剂药材的性味归经、活性成分和靶点的筛选
通过《中华人民共和国药典》(2015 年版)手工检索柴胡达胸合剂的十八味中药材的性味归经,利用Cytoscape 3.7.2 软件制作“药材-性味归经”网络图。在中药系统药理学数据库和分析平台(TCMSP)以柴胡达胸合剂中的十八味中药材名为关键词检索得到所有中药的化学成分。生物利用度(oral bioavailability,OB)和半衰期(half life,HL)是影响药动学的重要参数,而类药性(druglikeness,DL)可以反映化合物的理化性质与已上市的药物是否类似。根据TCMSP 数据库推荐的筛选标准,本研究以OB≥30%,DL≥0.18 及HL≥4 h为条件,筛选得到每味中药材的活性成分。同时,通过 TCMSP 数据库查找各活性成分的作用靶点,归纳整理后利用Uniprot 数据库(https://www.uniprot.org/)标准化靶点名称。
1.2 “药材-活性成分-靶点”网络图的构建
以coronavirus 为关键词,检索GeneCards(https://www.genecards.org/)和OMIM(https://omim.org/)数据库获得COVID-19 潜在相关基因;利用Venn 图在线绘制工具(http://bioinformatics.psb.ugent.be/webtools/Venn/),将柴胡达胸合剂活性成分的作用靶点和COVID-19 相关基因取交集,得到柴胡达胸合剂治疗 COVID-19 作用靶点;最后,将得到的药材-活性成分-靶点关联性文本导入Cytoscape 3.7.2 软件,构建并分析“药材-活性成分-靶点”网络。
1.3 PPI 网络构建
将柴胡达胸合剂治疗 COVID-19 作用靶点导入STRING 蛋白相互作用数据库(https://stringdb.org/),物种选定为Homo sapiens,获得PPI 信息并导入Cytoscape 3.7.2 软件,利用NetworkAnalyzer功能,分析网络中每个靶点的度值(dgree value),使用R 软件Graphics 包,绘制条形图展示度值排名前20 位的靶点。
1.4 GO 基因注释和KEGG 通路分析
利用R 软件的org.Hs.eg.db 和clusterProfiler包,对柴胡达胸合剂治疗COVID-19 的作用靶点进行GO 基因注释和KEGG 通路分析,以P<0.05 进行筛选,得到柴胡达胸合剂对COVID-19 发挥治疗作用参与的生物学过程和信号通路,并绘制气泡图展示结果。
2 结果
2.1 柴胡达胸合剂的药材性味归经
柴胡达胸合剂“药材-性味归经”网络如图1 所示,图中节点的大小代表该节点在网络中的度值。由图可知,度值最大的性味归经分别为寒(度值=8)、苦(度值=13)和肺经(度值=14)。
2.2 柴胡达胸合剂的活性成分及其作用靶点
通过TCMSP 平台检索到柴胡达胸合剂中的十八味药材共包含1 977 个化合物。以OB≥30%,DL≥0.18 及HL≥4 h 为条件筛选并去重后,共得到221 个活性成分。在TCMSP 检索活性成分的作用靶点,并到Uniprot 数据库中查找其标准名称,最后共得到259 个作用靶点。柴胡达胸合剂的“中药-化合物-活性成分-靶点”信息,结果见表1。
2.3 柴胡达胸合剂治疗 COVID-19 的作用靶点
通过检索GeneCards 和OMIM 数据库,共收集得到COVID-19 相关基因352 个。将柴胡达胸合剂的作用靶点和COVID-19 相关基因取交集制作Venn 图,共得到51 个交集基因,即柴胡达胸合剂治疗COVID-19 的作用靶点(图2)。
2.4 “药材-活性成分-靶点”网络
柴胡达胸合剂治疗COVID-19“药材-活性成分-靶点”网络共包含234 个节点(药材节点18 个,有效成分节点165 个,靶点节点51 个)。网络中棱形代表药材节点,倒三角代表有效成分节点,圆形代表靶点节点(图3)。节点的颜色越深或节点图形越大,表明该节点在网络中的度值越高。每一圈的最低点为该圈度值最大的节点,度值沿逆时针方向逐渐减小,且3 个有效成分节点圈由外往里节点度值依次减小。网络中化合物节点中位数为4,高于2 倍中位数的化合物节点共有12 个(表2),这些化合物可能是柴胡达胸合剂治疗COVID-19 的主要活性成分。
2.5 PPI 网络
在“药材-活性成分-靶点”网络中的靶点节点不包含PPI 信息,因此,对柴胡达胸合剂治疗COVID-19 靶点进行PPI 分析,结果如图4A 所示。图中节点形状越大,表明其度值越高,越可能为柴胡达胸合剂治疗COVID-19 的核心作用靶点。对网络中度值前30 的节点作条形图,节点度值排名前10 的蛋白为CASP3、MAPK3、IL-6、MAPK8、IL-10、CXCL8、MAPK1、IL-1B、PTGS2和CCL2(图4B)。
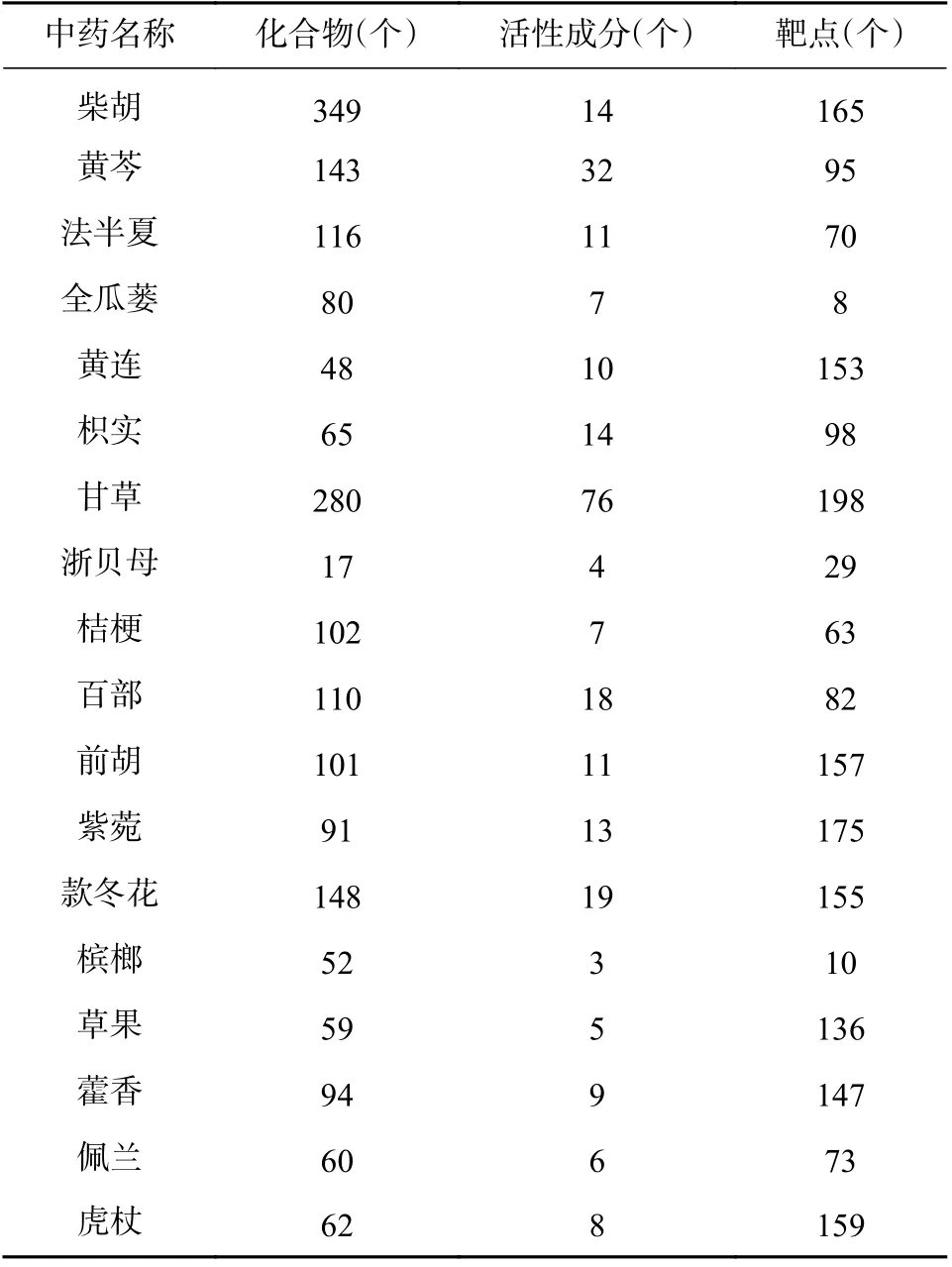
表1 柴胡达胸合剂的“中药-化合物-活性成分-靶点”信息表
2.6 GO 基因注释
GO 基因注释将基因的功能分为3 个部分:参与的生物学过程(biological process,BP),所处的细胞组分(cellular component,CC),执行的分子功能(molecular function,MF)。对柴胡达胸合剂治疗COVID-19 的51 个作用靶点进行GO 基因注释,以P<0.05 为条件进行筛选,结果得到GO 条目共1 722 个,其中BP 条目1 612 个,CC 条目30 个,MF 条目80 个。选取每个部分的前5 个条目作气泡图,富集最多基因且P值最小的BP、CC 和MF 条目分别为脂多糖反应、膜筏和细胞因子受体结合(图5)。
2.7 KEGG 信号通路分析
对柴胡达胸合剂治疗COVID-19 的51 个作用靶点进行 KEGG 信号通路富集分析,筛选出P<0.05 的信号通路156 条,选取富集基因最多的10 条通路作气泡图。排名前5 的信号通路为糖尿病并发症中的AGE-RAGE 信号通路、甲型流感、IL-17 信号通路、TNF 信号通路和乙型肝炎(图6)。
3 讨论
COVID-19 隶属于中医的“温疫”、“疫病”范畴,病因为感受“异气”、“疠气”,疠气夹湿,病位在肺、脾[3]。柴胡达胸合剂用于痰热壅肺证患者,其病因为痰热互结,壅闭于肺,致使肺失宣降而表现的肺经实热证候。本研究首先对柴胡达胸合剂的十八味中药材进行性味归经的网络分析,结果发现柴胡达胸合剂组方的性味以“苦寒”最多且主归肺经。“苦寒”药能清热泻火,消除热症,多用于具有实热特征病证[8]。因此,柴胡达胸合剂与COVID-19 的病机、病位相符。
利用中药、疾病相关数据库,本研究筛选出柴胡达胸合剂治疗COVID-19 的165 个活性成分和51 个作用靶点,表明柴胡达胸合剂治疗COVID-19 具有多成分、多靶点的特点。通过构建和分析“药材-活性成分-靶点”网络图,发现网络中度值较高的12 个活性成分:槲皮素、木犀草素、山奈酚、β-谷甾醇、汉黄芩素、柚皮素、黄芩素、甘草查尔酮A、刺槐素、川陈皮素、异鼠李素和葛花苷元。除β-谷甾醇外,其余11 个成分均属于黄酮类化合物。
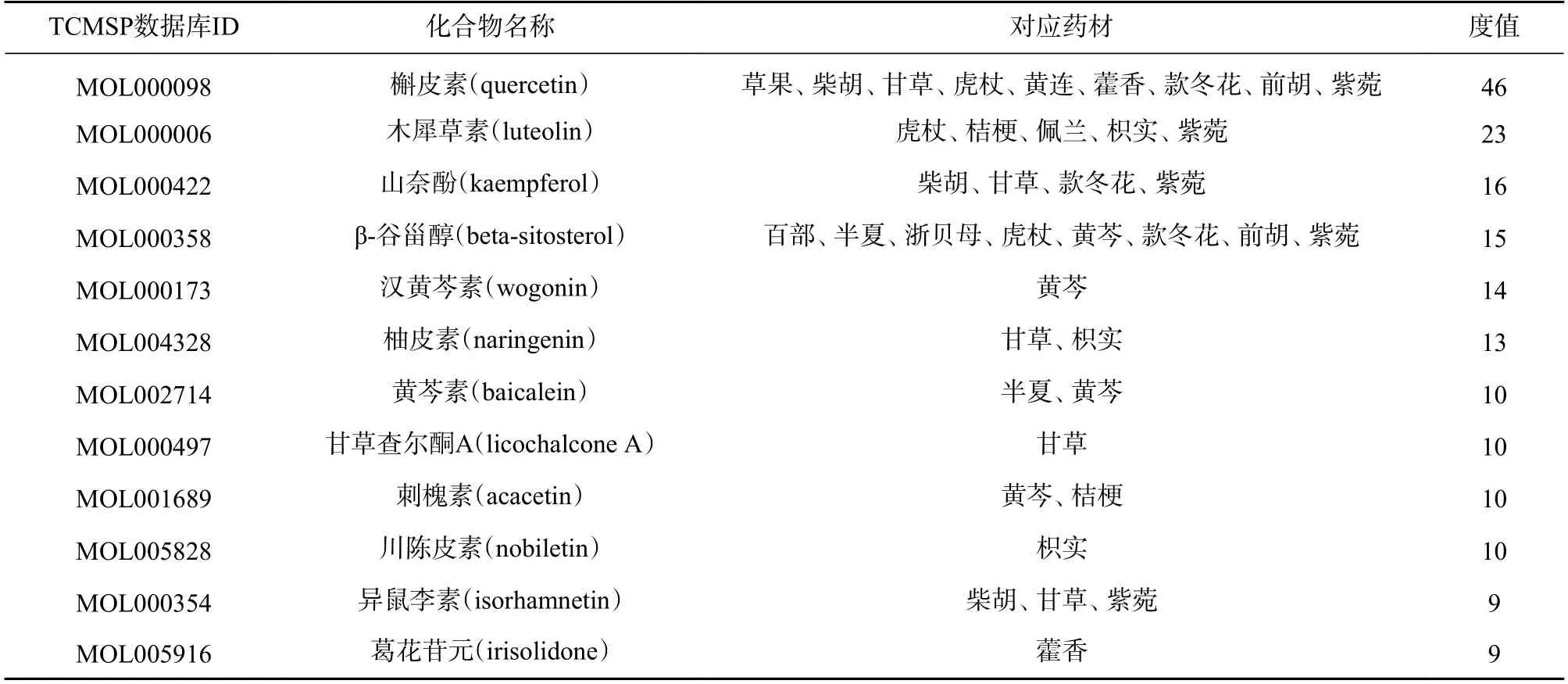
表2 高于2 倍度值中位数的化合物信息表
黄酮类化合物广泛存在于自然界的多种植物中,具有包括抗炎、抗动脉粥样硬化和抗肿瘤等多种药理作用[9]。黄酮类化合物还有良好的抗病毒作用,对流感病毒、呼吸道合胞病毒、单纯疱疹病毒和柯萨奇病毒等都有抑制作用[10]。体外实验研究表明,槲皮素和木犀草素均能够抑制SARS-CoV 3CL 蛋白酶活性,对SARS-CoV 产生抑制作用[11-12]。β-谷甾醇也能抑制SARS-CoV 3CL 蛋白酶活性[13]。SARS-CoV-2 与SARS-CoV 基因序列有约80%同源性,两者3CL 蛋白酶结构有相似性[14]。此外,分子对接结果发现山柰酚、槲皮素、 黄芩素、 木犀草素、 汉黄芩素、β-谷甾醇与SARS-CoV-2 3CL 蛋白酶均有较高的结合活性[15]。因此,通过直接抑制SARS-CoV-2 3CL 蛋白酶活性,可能是柴胡达胸合剂治疗COVID-19 的药理作用机制之一。
通过分析PPI 网络发现,CASP3、MAPK3、IL-6、 MAPK8、 IL-10、 CXCL8、 MAPK1、 IL-1B、PTGS2、CCL2 等在网络中有较高的度值。CASP3 基因编码的caspase-3 蛋白是细胞凋亡过程中重要的终末剪切酶,研究发现caspase-3 蛋白在SARS-CoV 病毒引起的组织细胞凋亡过程中发挥了重要作用[16]。MAPK 基因编码的丝裂原活化蛋白激酶参与细胞的增殖、分化、迁移及凋亡等多个生物学过程。此外,炎症因子风暴被认为是重症COVID-19 患者组织损伤的病理机制之一。SARSCoV-2 病毒在体内激活T 细胞,产生粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL-6 等细胞因子,随后GM-CSF 会进一步激活CD14+CD16+炎性单核细胞,进一步升高IL-6 等炎性因子,形成炎症因子风暴,导致严重的肺部和其他器官免疫损伤[17]。细胞因子根据其在炎性反应中的作用不同可分为促炎性细胞因子(如 IL-1、IL-6、IFN-α、IFN-γ、TNF-α 等)和抑炎性细胞因子(如 IL-4、IL-10 等)两类。SARS 患者的肺部炎症和肺损伤与患者血浆中的IL-1B、IL-6、IL-12 等促炎性细胞因子水平升高引起炎症因子风暴有关[18]。同样地,COVID-19 患 者 血 浆IL-1B、IFN-γ、CXC 趋 化 因 子-10(CXCL-10)等促炎性细胞因子水平也升高[19]。本研究中,IL-6、IL-10 和IL-1B 均为核心作用靶点。因此,减少组织细胞凋亡、降低促炎性细胞因子和升高抑炎性细胞因子水平可能也是柴胡达胸合剂治疗COVID-19 的药理作用机制。
对靶点进行GO 基因注释的结果表明,柴胡达胸合剂治疗COVID-19 的主要生物学过程为脂多糖反应、对源于细菌的分子的反应和氧化应激反应等。脂多糖是G-菌细胞壁的组成成分,可诱导细胞产生炎性反应,其中促炎性细胞因子发挥了重要介导作用。IL-6 可促进B 细胞分化,并活化MAPK,激活STAT 转录因子,从而加重炎性反应[20]。KEGG 分析富集到156 条信号通路,主要涉及糖尿病并发症中的AGE-RAGE 信号通路、甲型流感、IL-17 信号通路、TNF 信号通路和乙型肝炎,表明柴胡达胸合剂治疗COVID-19 多通路的特点。
综上所述,本研究采用网络药理学方法,初步揭示了柴胡达胸合剂可能一方面通过多种黄酮类化合物和β-谷甾醇直接抑制SARS-CoV-2 3CL 蛋白酶活性,另一方面通过多成分、多靶点、多通路减少组织细胞凋亡、降低促炎性细胞因子和升高抑炎性细胞因子水平,从而对COVID-19 产生治疗作用。
