金线莲多糖的提取优化与纯化
2020-08-07张松柏黄泽豪陈抒云福建中医药大学药学院福建福州350122
张松柏,张 勋,许 文,徐 伟,黄泽豪,林 羽,陈抒云 (福建中医药大学药学院,福建 福州 350122)
金 线 莲Anoectochilus roburghii(Wall.) Lindl,又名金线兰、金蚕、乌人参、金线入骨消等,是一种多年生兰科草本植物[1],主产地为福建。文献报道多糖类、黄酮类、生物碱类、氨基酸类等是金线莲主要化学成分[2]。其中金线莲多糖是其主要药理活性物质,具有降血糖、抗氧化、抗肝损伤、增强免疫功能、抗肿瘤等药用功效[3]。本研究为提高金线莲多糖提取率,采用超声提取的方法,在单因素实验的基础上以响应面法优化其提取工艺。蛋白质的存在往往影响到多糖的活性,蛋白的脱除是多糖提取纯化的一个关键步骤[4],且天然植物中多糖与蛋白质两种高分子成分分子量相近,严重制约了进一步的分析[5],而Sevage 试剂法、三氯乙酸(TCA)法、盐法(氯化钙和氯化钠法)、盐酸法等是多糖脱蛋白的常用方法[4-6],为此,笔者对以上方法在金线莲多糖提取中的影响进行了考察,为进一步深入研究金线莲多糖奠定一定的基础。
1 材料
1.1 仪器
UV-3 200 紫外分光光度计(上海美谱达仪器有限公司);AR224CN 电子天平(美国奥豪斯仪器常州有限公司);HWS-12 型电热恒温水浴锅、电热鼓风干燥箱(上海一恒科学仪器有限公司);SC-04 低速离心机(安徽中科中佳科学仪器有限公司);KQ-500DE 型超声波清洗器(昆山市超声仪器有限公司)。
1.2 材料
福建永泰产金线莲样品经福建中医药大学药学院黄泽豪副教授鉴定为兰科开唇兰属的金线莲Anoectochilus roburghii(Wall.) Lindl。D-水葡萄糖(中国食品药品检定研究院,批号:110833-201506);乙醇(批号:20181208)、苯酚(批号:P815401)、氢氧化钠(批号:20160509)购自上海国药集团化学试剂有限公司;硫酸(批号:1706191)、盐酸(批号:1903301,)、氯化钠(批号:1610141)、氯仿(批号:1803121)购自广东西陇科学股份有限公司;氯化钙(广东光华化学有限公司,批号:20091031);正丁醇(江苏强盛功能化学股份有限公司,批号:20130418);超纯水(实验室制备)。
2 实验方法
2.1 对照品溶液的制备
取D-葡萄糖50 mg 溶于1 000 ml 的量瓶中,加水定容,得对照品溶液。
2.2 供试品溶液的制备
取金线莲鲜品清洗干净,于60 ℃恒温干燥箱中烘干,打粉,过60 目筛,得金线莲干品。取金线莲粉末5 g,以料液比为1:10 加水,48 ℃超声提取30 min,超声功率为300 W,超声提取2 次;对上述提取液3 600 r /min 离心15 min,弃去沉淀,即得金线莲原始液。取上述原始液5 ml 加4 倍体积无水乙醇放置过夜,4 000 r/min 下离心10 min,沉淀加水溶解,于1 000 ml 的量瓶中定容,得供试品溶液。
2.3 金线莲多糖含量
按本课题先前研究的“优化的苯酚硫酸法”[7],计算金线莲多糖提取得率。
2.4 单因素实验
按“2.2”项下的方法,对超声提取工艺中各单因素进行考察:①以超声温度30、40、50、60、70、80 ℃分别进行提取;②以超声功率200、250、300、350、400 W 分别进行提取;③用超声分别提取10、20、30、40、50 min;④以1∶5、1∶10、1∶15、1∶20、1∶30 的料液比加水;⑤用超声分别提取1、2、3 次。
2.5 响应面法优化超声提取工艺
在单因素考察的基础上,利用软件Design-Expert.V8.0.6.1 中Box-Behnken 试验原理,选择对多糖提取率影响较大3 个因素料液比(A)、超声提取时间(B)、超声温度(C)为自变量,以多糖提取率(R)为响应值,设计3 因素3 水平实验。因素与水平设计如表1。
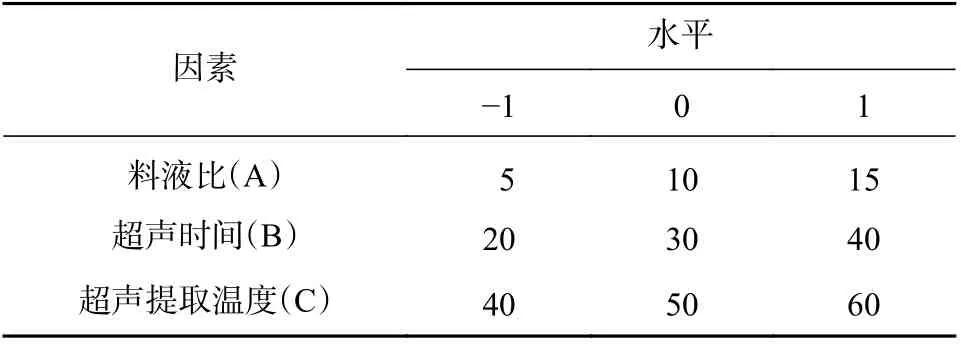
表1 Box-Behnken试验设计因素与水平
2.6 脱蛋白方法的考察
2.6.1 盐酸法脱蛋白[4,6]
取5 ml 金线莲原始液,用2 mol/L 盐酸调节至pH 3,并保持过夜。将该混合物在4 000 r/min下离心10 min,弃去沉淀,上清液加入4 倍体积无水乙醇放置过夜,4 000 r/min 下离心10 min,所得沉淀物加水溶解,于1 000 ml 的量瓶中定容,得脱蛋白供试品溶液。
2.6.2 NaOH-CaCl2法脱蛋白[5]
取5 ml 金线莲原始液,以2% NaOH 溶液将其调至pH 8~9,加热至85 ℃。将CaCl2固体调至5%(50 g/L)的浓度,煮沸30 min,冷却至室温并过滤,用稀盐酸将滤液调至pH 7,加入4 倍体积无水乙醇放置过夜,4 000 r/min 下离心10 min,得多糖沉淀。加水溶解重复上述操作3 次,所得沉淀物加水溶解,于1 000 ml 的量瓶中定容,得脱蛋白供试品溶液。
2.6.3 NaOH-NaCl 法脱蛋白[5]
取5 ml 金线莲原始液,在沸腾(90 ℃)条件下,用2%NaOH 溶液将多糖溶液调节到pH 9~10。加入NaCl 固体,浓度调至5%(50 g/L),然后混合煮沸30 min。冷却至室温并过滤,上清液用稀盐酸调至pH 7。添加4 倍体积无水乙醇放置过夜沉淀多糖,在4 000 r/min 下离心10 min,弃上清液得多糖沉淀。加水溶解重复上述操作3 次,所得沉淀物加水溶解,于1 000 ml 的量瓶中定容,得脱蛋白供试品溶液。
2.6.4 三氯乙酸(TCA)法脱蛋白[5]
取5 ml 金线莲原始液,加入10% TCA 溶液将其调节到pH 3,静置过夜。样品4 000 r/min 离心10 min,沉淀物丢弃,上清液加4 倍体积无水乙醇放置过夜,在4 000 r/min 下离心10 min,弃去上清液得多糖沉淀。加水溶解重复上述操作3 次,所得沉淀物加水溶解,于1 000 ml 的量瓶中定容,得脱蛋白供试品溶液。
2.6.5 Sevage 法脱蛋白[6]
取5 ml 金线莲原始液,以金线莲水提溶液:正丁醇:氯仿按1:1:4 的比例进行除蛋白,振荡器振荡20 min 后,4 000 r/min 转速离心 5 min,弃去下层有机相。该过程重复3 次,上层水相添加4 倍体积无水乙醇放置过夜,在4 000 r/min 下离心10 min,弃去上清液得多糖沉淀物,所得沉淀物加水溶解,于1 000 ml 的量瓶中定容,得脱蛋白供试品溶液。
2.7 多糖损失率与蛋白脱除率
以“紫外分光光度法”对蛋白含量进行测定[5],
蛋白质浓度C(mg/ml) = 1.45A280-0.74A260
多糖损失率=[(供试品多糖含量-脱蛋白供试品多糖含量)/供试品多糖含量]×100%
蛋白脱除率=[(供试品蛋白含量-脱蛋白供试品蛋白含量)/供试品蛋白含量]×100%
3 实验结果
3.1 不同方法提取金线莲多糖
参考相关文献,按“2.2” 项下使用不同提取方法制得对应的供试品,比较多糖得率,结果如表2。
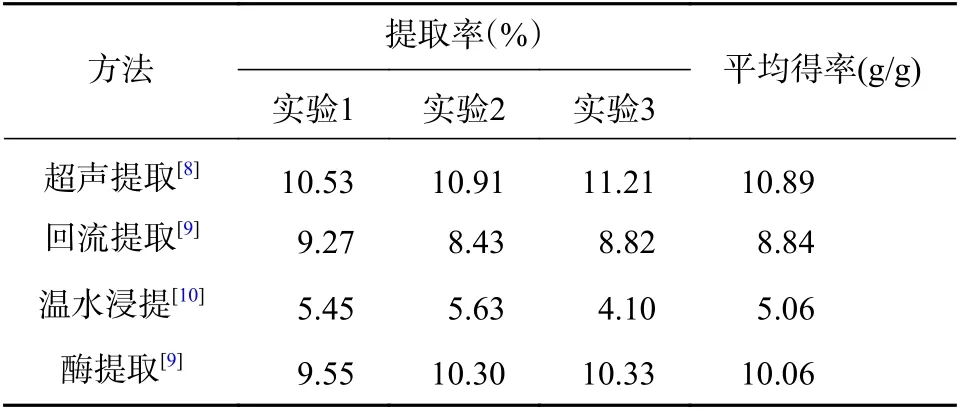
表2 提取金线莲多糖方法比较
实验结果表明,超声提取和酶提取均能获得较高的多糖提取率,由于酶价格昂贵,超声提取操作简便,且能获得高提取率,故选择超声提取进行下一步研究。
3.2 单因素实验结果
如图1 所示:①随着提取温度的增加,提取得率逐渐增加,在50 ℃提取得率达到最大值,后随着温度的增加提取率逐渐下降并趋于稳定,故初步确定提取温度40~60℃作为进一步响应面考察设计的水平;②在超声功率为300 W 时多糖提取率最高,实验结果显示,随着超声功率的增加,多糖提取率先上升后下降,但影响相对较小,故选定功率为300 W 进行下一步分析;③以超声提取30 min,提取率最高,故初步确定超声时间20~40 min 作为进一步响应面考察设计的水平;④料液比为1∶10 时,多糖提取率最高,随着料液比的增加,提取率稍有下降且趋于平稳,故初步确定料液比1∶5~1∶15 作为进一步响应面考察设计的水平;⑤随着提取次数的增加,提取率逐渐降低,提取3 次后,多糖已基本提取完全,考虑实际操作及原料等,选定提取2 次进行下一步分析。
3.3 响应面法优化超声提取工艺
在单因素考察的基础上,利用软件Design-Expert. V 8.0.6.1 中Box-Behnken 试验原理,设计3 因素3 水平实验。响应值设计方案及结果见表3,方差分析见表4。对数据分析后得到回归方程为:
多糖提取率(R)=13.08+0.026A+0.50B+0.25C+0.085AB+1.05AC-0.56BC-1.05A2-0.47B2-0.49C2。
由表3 知,回归模型有很好的显著性(P< 0.000 1),说明二项式方程拟合良好,模型二项式方程失拟项不显著(P=0.246 3),说明未知因素对实验干扰较小,拟合的相关系数r=0.992 6,模型可信度良好,故可运用此模型实现超声提取金线莲多糖最佳工艺的分析探究。
根据拟合方程绘制响应面图谱,响应面分析的等高线图和响应面图(图2、图3),AC、BC 具有相互影响,各图为料液比(A)、超声时间(B)、超声提取温度(C)中任意一个变量取零水平,其余变量对金线莲多糖提取率的交互作用影响。由图2、图3可以看出,提取时间对提取率影响最为显著,三者的主效应关系为:提取时间(B)>提取温度(A)>料液比(C),其中料液比与提取温度的响应曲面最为陡峭,证明料液比与提取温度的交互作用最为强。
通过Design-Expert. V 8.0.6.1 软件对二项式回归方程进行最优值的计算,确定理论上的多糖提取最佳工艺:料液比为1∶9.88,超声提取温度为48.76 ℃,超声提取时间为36.08 min,超声提取次数为2 次,超声功率为300 W,其多糖提取的理论得率为13.22%,考虑到实际操作的可行性,最佳工艺定为料液比1∶10,超声提取温度48 ℃,超声提取时间36 min,超声提取次数为2 次,超声功率为300 W。为验证实验结果,进行3 组平行实验,多糖提取得率分别为13.14%、13.05%、13.20%,其RSD为0.57%,提取得率的均值13.13%与理论值13.22%偏差0.09%,表明优化后的提取工艺可行,适用于金线莲中多糖的提取。
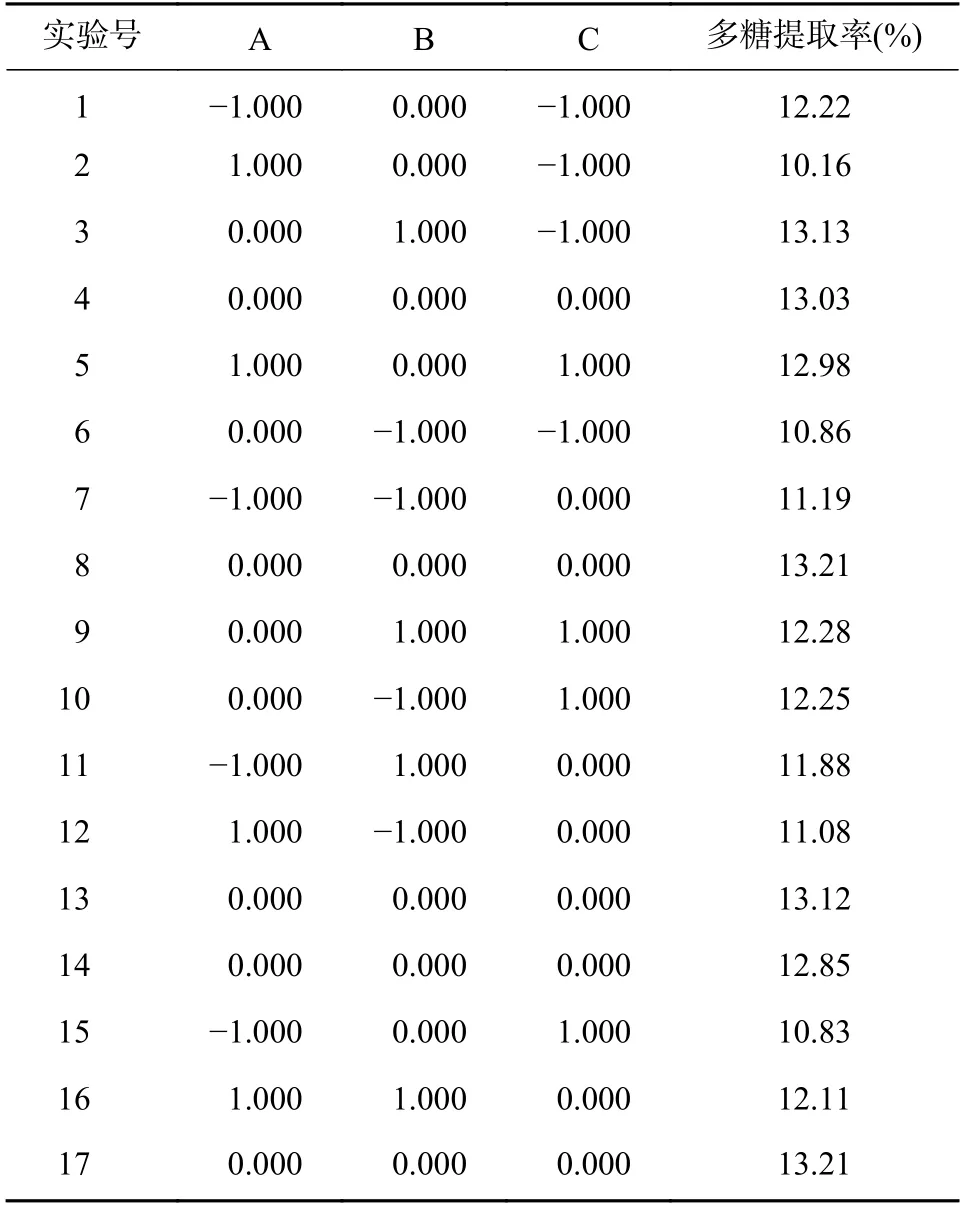
表3 Box-Behnken 试验设计方案及结果
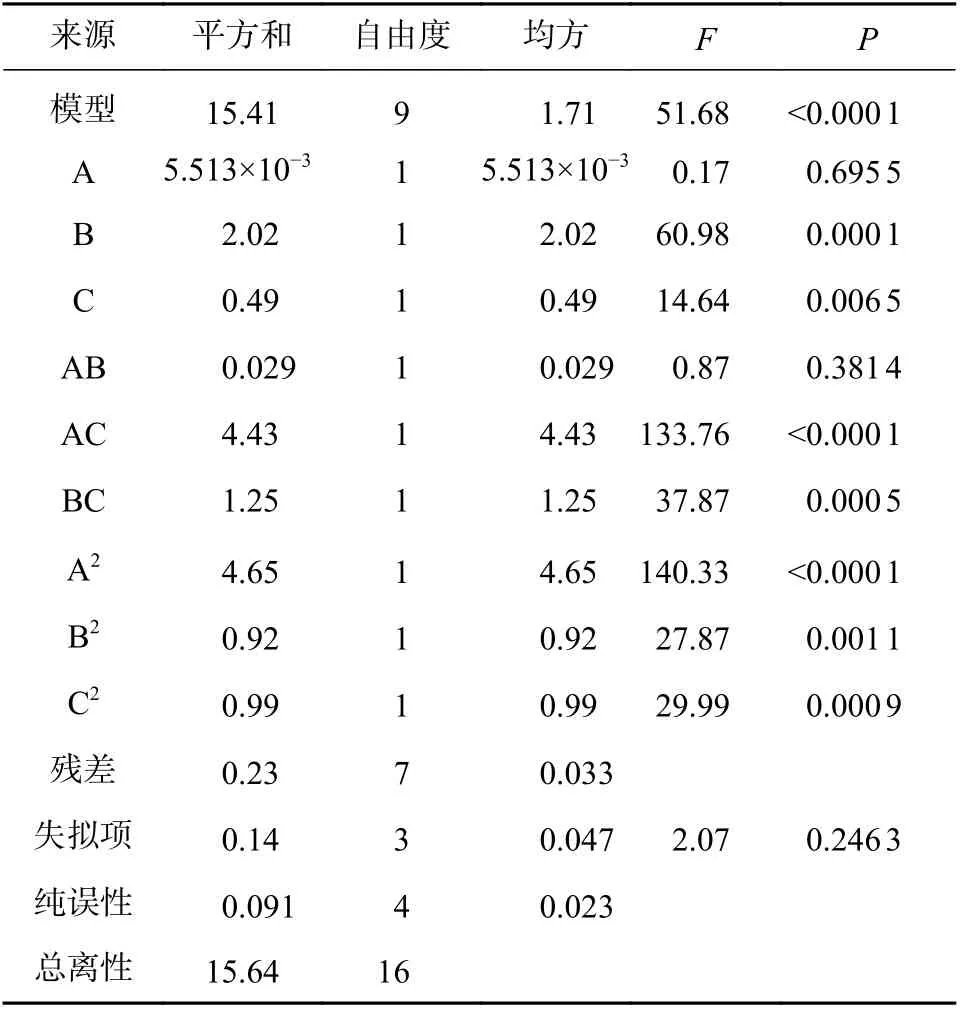
表4 模型回归系数显著性检验结果
3.4 脱蛋白方法的比较
按“2.6”项下的方法进行脱蛋白操作,得出多糖损失率及蛋白脱除率结果如表5。实验结果表明,NaOH-CaCl2法脱蛋白可以获得较高蛋白脱除率,同时也能获得最低的多糖损失率。
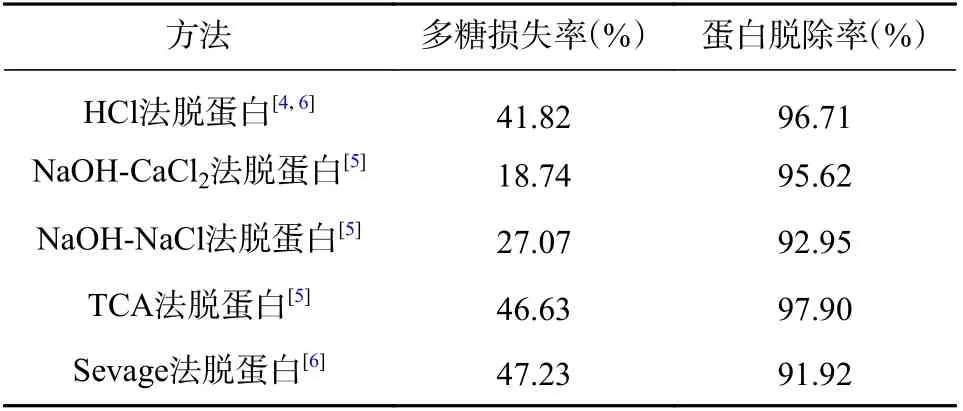
表5 不同脱蛋白方法对金线莲多糖损失及蛋白脱除的考察结果(n=3)
4 结论与讨论
植物多糖的提取方法包括了超声提取法[8]、酶法[9]、回流提取[9]、传统温水浸提[10]等,传统热水浸提与回流提取的提取效率低,且操作烦琐,考虑到酶法中由于酶价格昂贵,不适用于批量金线莲多糖的提取,本文采用超声提取的方法,操作简单,且以响应面优化后的提取工艺能够取得较高得率。因金线莲多糖中所含蛋白对进一步分析产生影响[6],所以,本研究考察了5 种除蛋白的方法,结果表明NaOH-CaCl2法最佳,既能获得较高蛋白脱除率,同时多糖损失最少;本研究将两者结合,实现了对金线莲多糖成分的最大化提取与保留,为金线莲多糖的深度开发提供了参考。
