肾脏疾病代谢组学研究的进展
2020-08-06邱丹丹综述审校
邱丹丹 综述 蒋 松 审校
随着系统生物学的突飞猛进,以及核磁共振(NMR)和质谱分析(MS)技术的不断普及,作为基因组学、转录组学和蛋白质组学下游的代谢组学应运而生。代谢组学能够反映体内实时的生化反应过程,还可整合内生性和外源性代谢产物水平的变化,反映饮食、环境及肠道微生物等因素对疾病的影响。此外,代谢与肾脏之间也存在密切的联系,多种代谢产物由肾脏代谢或排泄,肾功能的下降广泛影响代谢产物的水平。代谢组学研究显示,随着慢性肾脏病(CKD)的进展,可出现精氨酸代谢改变、凝血/炎症途径代谢增加、羧酸阴离子转运障碍、肾上腺激素产生减少以及犬尿素途径色氨酸代谢产物增加等改变[1]。而某些代谢产物本身也可促进肾脏疾病的进展及其并发症的发生。因此,代谢组学技术在肾脏领域的分子标志物和分子机制的研究中具有十分广阔的前景。本文拟简介代谢组学技术及肾脏疾病相关代谢组学研究进展。
代谢组学
代谢组学是指利用高通量检测技术识别和定量生物样本中全部或特定类别代谢产物的方法,可以检测分子量<1 500 D的代谢产物,主要包括糖类、氨基酸、核苷酸、酰基肉碱、脂类等物质。根据样本类型不同,目前可被识别的代谢产物数量可从数千至数万不等,收录于《Human Metabolome Database》、《METLIN》、《LipidMaps》等多个数据库中。无法被识别的代谢产物,只能以色谱分析停留时间、质量以及离子特征裂解方式等信息标注,称为未知代谢产物。识别未知代谢产物仍是一项艰巨任务。目前代谢组学主要采用NMR和MS两种方法。
NMR技术利用1H、13C、31P等原子核的磁性自旋特性确定代谢产物的结构和丰度。NMR技术无需预先色谱分析,样本处理步骤相对较少,可对代谢产物进行绝对定量,且无需标准品即可识别产物结构。但该方法灵敏度较差,仅能检测出丰度较高的物质,在体液标本中可检测出的代谢产物一般小于100个。
MS技术灵敏度较高,结构识别性也较好。但在分析之前需要液相色谱(LC)或气相色谱(GC)分离技术以降低样本的复杂性,而化学衍生和淬火等过程有可能改变代谢产物的结构,导致错误结果。MS技术有靶向和非靶向两种模式。靶向模式的通量较高,质谱分析仪只检测预先设定的代谢产物。例如液相色谱-质谱联用(LC-MS)技术每周大概可检测800个样本。靶向分析通常采用三重串联四级杆质谱分析方法,将先驱离子裂解为产物离子,通过先驱离子/产物离子对代谢产物进行识别,可一次性检测几十至一百多对先驱离子/产物离子组合,在代谢产物识别方面具有较高的灵敏度和准确性,但质量准确度相对较差。非靶向模式的通量相对较低,例如LC-MS技术每周只可检测约150个样本。非靶向分析方法常采用飞行时间质谱和离子阱质谱,这两种方法无需离子裂解,在保证质量准确度的前提下,每次检测可产生成百上千个分析物峰。由于代谢产物在分子量、极性和浓度等方面存在很大的不同,目前尚无一种方法能够精确检测全部的代谢产物。每种检测方法均有各自的优缺点,可根据研究目的、样本类型以及实验室条件等多种因素进行选择[2](图1)。

图1 不同代谢组学检测方法的优缺点比较[3]
代谢组学技术在肾脏疾病的应用
肾脏疾病代谢组学研究具有独特的优势。肾脏是调节机体物质代谢的重要器官,代谢组学常用的尿液标本是肾脏多组分协同合作的结果,而尿液样本获取简单且无创伤性,是寻找肾脏疾病分子标志物理想的样本类型。血液和肾组织也是常用的研究样本。下文将着重概述近年来肾脏疾病代谢组学研究成果。
色氨酸代谢产物多项研究表明CKD患者体内色氨酸代谢产物水平升高,其中硫酸吲哚酚是一种潜在的尿毒症毒素。2009年,Kikuchi等[3]利用LC-MS方法检测5/6肾切除大鼠的血清,证实硫酸吲哚酚是主要的尿毒症毒素之一。硫酸吲哚酚与血清白蛋白结合率高,难以通过血液透析技术清除。体外实验证实硫酸吲哚酚具有诱导内皮细胞功能紊乱、白细胞粘附、氧化应激及肾近端小管细胞老化等多种功能[4]。
犬尿素通路是色氨酸重要的代谢途径[2](图2),该通路代谢产物水平升高是发生CKD的风险因子。在奥格斯堡S4/F4合作医疗研究中,研究者运用LC-MS方法检测了1 104例患者血清的代谢产物,发现在校正估算的肾小球滤过率(eGFR)和其他风险因素后,血清中犬尿素/色氨酸比值升高组发生CKD的风险是比值未升高组的1.36倍(OR=1.36,P=0.003)[5]。弗雷明汉心脏研究队列1 434例患者血浆的LC-MS检测结果显示,犬尿素(OR=1.49,P<0.001)及其下游代谢产物犬尿酸(OR=1.53,P<0.001)均是发生CKD的风险因子[6]。此外,慢性肾功能不全研究队列的代谢组学研究结果也表明,色氨酸水平与eGFR成正相关,犬尿素以及犬尿酸水平与eGFR成负相关[7]。有研究证实犬尿酸可作为白细胞中G蛋白偶联受体35的配体促进炎症反应,而犬尿素则可促进血管内皮松弛[8-9],这些作用均有可能引起肾脏疾病的恶化。
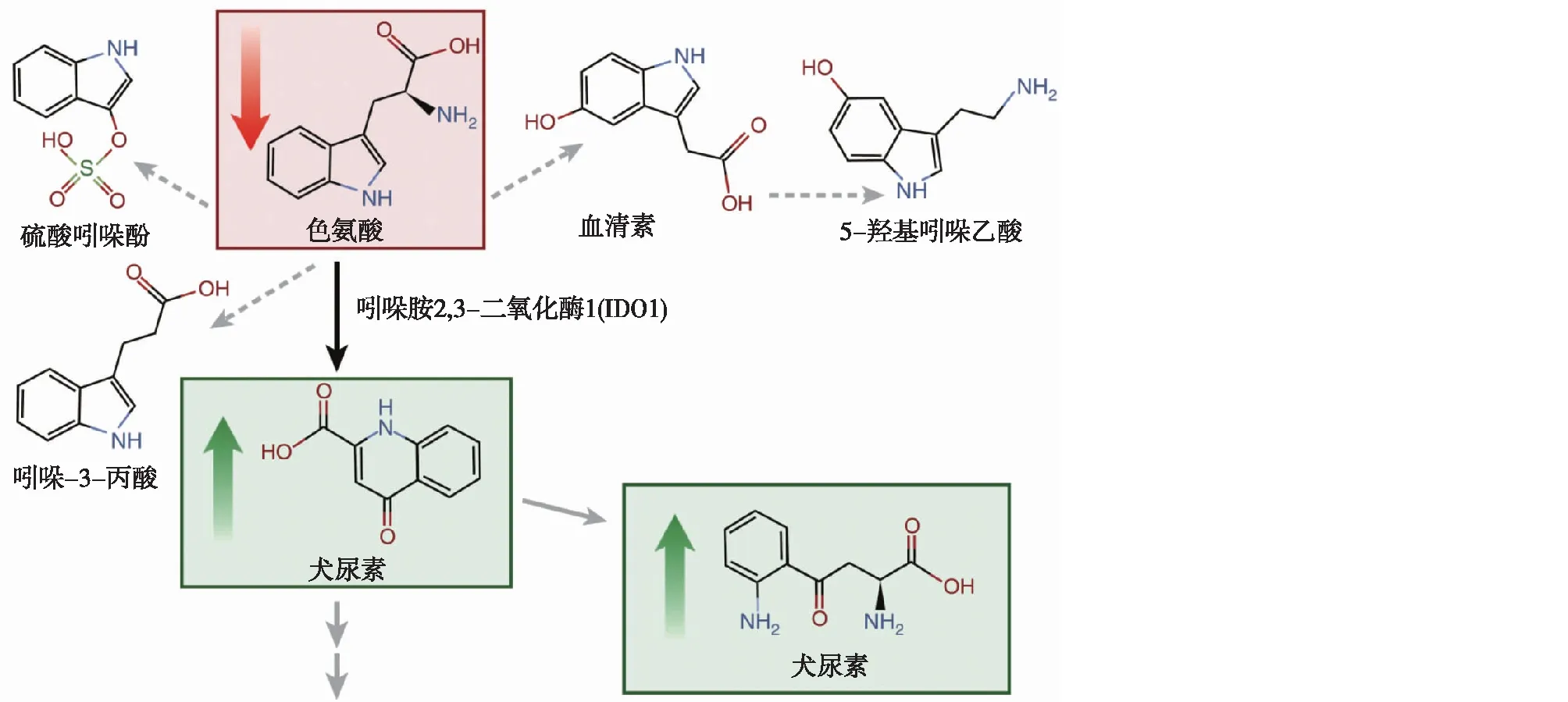
图2 色氨酸代谢途径示意图[3]色氨酸可通过肠道微生物代谢产生硫酸吲哚酚、吲哚-3-丙酸、血清素和5-羟基吲哚乙酸(灰色虚线箭头)。色氨酸还可通过犬尿素通路代谢(灰色实线箭头),其中吲哚胺2,3二氧化酶1(IDO1)是该通路的第一限速酶(黑色实线箭头)
氧化三甲胺(TMAO)TMAO主要由肾脏排泄,GFR下降可引起血清TMAO水平升高。多项研究表明血清TMAO水平升高可增加CKD患者心血管事件和死亡的发生风险。一项横断面研究发现,在220例接受过冠状动脉造影术的CKD患者中,血清TMAO浓度与患者动脉粥样硬化负荷以及长期死亡率有关[10]。一项针对179例CKD患者的研究同样证实了血TMAO水平与全因死亡率密切相关[11]。Kim等[12]在随访3年的2 529例CKD3b期和4期患者中,利用LC-MS检测方法发现,血TMAO水平是CKD患者心血管事件的独立风险因子(HR=1.23,P<0.006)。
然而TMAO与终末期肾病(ESRD)患者心血管结局的关系并未得到一致结论。Kaysen等[13]和Kalim等[14]分别在235例和500例透析患者中发现,TMAO水平与心血管事件和全因死亡之间没有相关性。Shafi等[15]利用LC-MS方法对1 232例长期透析患者的血浆进行检测,结果则显示TMAO水平与心血管事件相关。以上结果的不一致可能与研究的样本量大小、种族构成以及受试者残余肾功能有关。TMAO水平与ESRD患者心血管事件之间的关系还有待进一步证实。
目前认为TMAO可成为CKD患者心血管事件发生的风险因素,主要与TMAO可以抑制胆固醇逆转运,增加血小板高反应性,以及促进巨噬泡沫细胞形成等作用有关[16]。
线粒体损伤和氧化代谢异常Sharma等[17]利用气相色谱-质谱联用(GC-MS)技术对受试者尿液中94种代谢产物进行了靶向检测,与健康对照组以及糖尿病无CKD组(DM-CKD)相比,糖尿病合并CKD组(DM+CKD)尿液中分别有13种和12种代谢产物出现下降,而这些代谢产物均与线粒体代谢有关。而对糖尿病肾病(DN)患者肾组织和尿液的相关检测也再次证实DN患者肾脏中线粒体活性下降。急性肾损伤(AKI)也可出现肾小管线粒体破坏和氧化代谢异常。PGC1α是线粒体生物合成的重要调节分子,全身敲除PGC1α的小鼠更容易出现AKI。Tran等[18]利用LC-MS技术,检测PGC1α敲除小鼠以及在此基础上通过缺血再灌注诱导的AKI小鼠的肾组织匀浆,结果发现PGC1α下游产物烟酰胺水平均出现显著下降。而对PGC1α敲除小鼠静脉灌注烟酰胺后,可减轻肾脏损伤程度,并可阻止缺血再灌注诱导的AKI的发生。
延胡索酸是三羧酸循环重要的中间产物。代谢组学研究发现CKD患者血清的延胡索酸水平与长期死亡率密切相关[19]。与db/m小鼠相比,6~8周龄db/db小鼠的血清中延胡索酸水平显著升高[20]。此外,在足细胞特异性过表达NADPH氧化酶4(NOX4)的DN小鼠模型尿液中,也可检测到包括延胡索酸在内的多种三羧酸循环中间产物的上升。在DN状态下,延胡索酸可刺激内质网应激,引起细胞外基质产生增多,并诱导低氧诱导因子1α(HIF-1α)和转化生长因子β(TGF-β)的表达增加[21]。此外,延胡索酸还可共价修饰半胱氨酸残基,介导琥珀酸酯化,影响细胞的抗氧化反应[22]。
尿素循环代谢产物尿素循环可将体内的氨转化为尿素,其中鸟氨酸、瓜氨酸和精氨酸是其重要的中间产物[23](图3)。Shah等[24]利用GC-MS以及LC-MS方法,检测了30例不同分期的CKD患者的血浆结果显示,与CKD 2期相比,CKD 3期和4期患者的鸟氨酸水平下降,而瓜氨酸、精氨酸以及二甲基精氨酸水平均出现升高。Duranton等[25]利用LC-MS方法证实,随着CKD的进展,血浆中瓜氨酸/鸟氨酸、瓜氨酸/精氨酸以及非对称性/对称性二甲基精氨酸(ADMA/SDMA)比值增加。此外,Benito等[26]利用LC-MS技术对精氨酸-肌酸代谢通路进行的靶向性研究也表明,在儿童CKD患者血清中瓜氨酸和ADMA水平上升。有研究认为血浆中瓜氨酸以及瓜氨酸/精氨酸比值升高与CKD患者血压异常密切相关,有潜力成为CKD患者心血管事件的预测标志物[23]。而ADMA可由肾脏中高表达的二甲基精氨酸二甲基氨基水解酶1(DDAH1)催化水解成二甲胺和瓜氨酸,也可经肾脏直接排泄到尿中。肾功能受损可直接引起血浆中ADMA水平升高。ADMA可抑制一氧化氮合成酶(NOS)的活性,导致一氧化氮(NO)合成减少,与肾脏疾病伴发的高血压、心血管事件和免疫功能紊乱密切相关[27]。

图3 尿素循环示意图[29] ADMA:非对称性二甲基精氨酸;SDMA:对称性二甲基精氨酸;PRMT:蛋白精氨酸甲基转移酶;DDAH:二甲基精氨酸-二甲基赖氨酸水解酶;NOS:一氧化氮合成酶;NO:一氧化氮;ASL:精氨琥珀酸裂解酶;ASS:精氨琥珀酸合成酶;OCT:鸟氨酸氨甲酰基转移酶
肠源性代谢产物与肾脏疾病
肠道和肾脏之间存在密切的联系,称为肾-肠轴。在CKD患者中胃肠道失调引起的菌群紊乱以及内毒素的产生,可增加肠道的通透性,诱导体内慢性炎症,增加心血管风险并加重尿毒症症状。代谢组学可反映肠道来源的代谢产物与肾脏疾病之间的关系。
代谢组学研究揭示多种肠道微生物产生的代谢产物具有毒性。例如近期一项代谢组学研究,利用LC-MS技术,通过检测对健康对照、结肠切除术患者以及维持性血液透析患者的血尿标本,识别了60种具有毒性的结肠微生物来源的代谢产物,其中有33种物质具有已知的化学结构,包括硫酸吲哚酚、对甲酚硫酸盐和TMAO[28]。此外,一项利用LC-MS技术的非靶向代谢组学研究证实肠道微生物来源的苯硫酸盐与糖尿病肾病患者的基线白蛋白尿水平密切相关,并可预测患者2年后白蛋白尿的进展,在糖尿病肾病小鼠模型中抑制苯硫酸盐可减轻白蛋白尿水平,可成为糖尿病肾病治疗的潜在靶点[29]。与此同时,具有肾脏保护作用的短链脂肪酸(SCFAs)在ESRD患者中则产生减少[30]。SCFAs由饮食中的纤维(复合碳水化合物)经肠道细菌发酵产生,主要包括醋酸盐、丙酸盐和丁酸盐,具有抗炎、抑制组蛋白去乙酰化酶的作用,并可保护缺血再灌注引起的急性肾损伤。动物研究表明,与无特定病原体级的肾衰小鼠相比,无菌级肾衰小鼠的肠道微生物来源的尿毒症毒素虽产生较少,却因缺乏具有肾脏保护作用的SCFAs等物质而表现出更严重的肾脏损伤[31]。随着代谢组学研究的不断深入,肠道微生物与肾脏疾病之间的关系将会得到更为全面的剖析。
与其他组学联合的多组学研究
基因组学、转录组学和蛋白组学均可与代谢组学联合分析。例如,Suhre等[32]利用全基因组关联研究和非靶向质谱为基础的代谢组学研究,证实单羧基转运蛋白9可作为肉碱外流性转运蛋白在游离肉碱的肠道吸收和肾脏重吸收中起到重要作用。Sas等[33]结合转录组学、代谢组学以及代谢流分析等方法证实在糖尿病肾脏中糖酵解、脂肪酸β氧化、三羧酸循环等途径代谢流增加,尿液中三羧酸循环代谢产物的浓度增加可预测糖尿病肾病的疾病进展。Simic等[34]则是联合蛋白组学和代谢组学识别并证实急性肾损伤时肾脏来源的3-磷酸甘油可促进成纤维细胞因子23的合成。多组学联合分析可从分子多层面进行结果验证,使得到的结果更为可靠。由于代谢组学反映体内实时的生化反应过程,将代谢组学与其他组学联合分析是目前组学研究的趋势。
前景与展望
由于肾脏和代谢之间存在密切关联,代谢组学技术在肾脏疾病的研究方面具有极大的潜能。但由于检测方法本身的局限性,以及未知代谢产物识别的艰巨性,代谢组学研究仍面临着巨大挑战。加快对未知代谢产物的识别,以及与基因组学、转录组学和蛋白质组学等多组学的结合,有助于增加结果的可靠性,促进研究结果向临床的转化。
