干扰AKAP12调控G1/S期促进乳腺癌MCF-7细胞增殖
2020-08-06梁瑞鹏陆春花于恒恒袁顺杰刘维薇
梁瑞鹏,程 倩,陆春花,李 可,于恒恒,徐 彬,袁顺杰,刘维薇,林 清
乳腺癌是女性最常诊断的恶性肿瘤之一,近年来无论是发病率还是致死率均高居首位[1]。众所周知,乳腺癌是一组高度异质性疾病,雌激素受体(estrogen receptor;ER)阳性乳腺癌约占所有乳腺癌70%,在乳腺癌患者占有较大比例。A型激酶锚定蛋白12(A kinase-anchored protein 12;AKAP12)是胞内大分子支架蛋白与维持正常组织结构功能完整[2]及肿瘤细胞增殖、侵袭转移[3]等过程密切相关。AKAP12最早被用来评价重症肌无力预后的抗原,随后研究[4]发现在src基因、ras基因等原癌基因转化的成纤维细胞中AKAP12表达明显下调,文献[5]报道,与正常组织相比,AKAP12在多种肿瘤中表达下调,如实体肿瘤肺癌、结直肠癌[3]、肝癌[6],血液肿瘤如幼年髓单核细胞白血病[7],在肿瘤细胞重新表达AKAP12抑制肿瘤细胞增殖、迁移侵袭,而干扰AKAP12则增加肿瘤细胞增殖、迁移侵袭能力,因此AKAP12被认为是潜在的抑癌基因。但AKAP12与乳腺癌生物学功能是否有关尚未阐明,AKAP12是否参与乳腺癌的发生发展有待于研究。该研究通过干扰ER阳性乳腺癌MCF-7细胞中AKAP12表达来观察其对ER阳性MCF-7细胞增殖、周期机制的影响,初步探讨AKAP12在ER阳性乳腺癌发生发展中的作用。
1 材料与方法
1.1 主要材料人乳腺癌细胞系MCF-7、MDA-MB-231、MDA-MB-468和SK-BR-3以及乳腺正常上皮细胞MCF-10A均购自中国科学院上海细胞库;特异性干扰AKAP12基因的慢病毒和阴性对照慢病毒购自吉凯公司;DMEM培养基购自Gibco公司;胎牛血清购自hyclone公司;CCK-8试剂购自上海诺维赞生物科技公司;RIPA裂解液(强)、蛋白酶抑制剂PMSF购自江苏碧云天生物技术研究所;鼠抗人AKAP12单克隆抗体购自abcam公司;β-actin鼠抗人单克隆抗体购自proteintech公司;兔抗人P21抗体、兔抗人P27抗体以及鼠抗人CyclinD1抗体均购自proteintech公司。
1.2 细胞培养及转染所有细胞用含10%胎牛血清、100 U/ml青霉素-链霉素的DMEM培养基培养,培养于37 ℃、5% CO2的饱和湿度细胞培养箱;接种细胞于六孔板待贴壁稳定,更换1 ml不含双抗的DMEM完全培养基和40 μl病毒感染增强液(购自上海吉凯基因化学技术有限公司),按照1 ∶10的MOI值加入病毒液,24 h后更换正常培养基继续培养,48 h后荧光显微镜下看细胞转染效率(成功转染细胞标记绿色荧光),更换含有5 μg/ml嘌呤霉素的完全培养基进行药物筛选。
1.3 Western blot检测蛋白量收集细胞添加适量细胞裂解液(按照1 ∶100加入蛋白酶抑制剂),冰上裂解10 min,4 ℃ 12 000 r/min离心10 min,收集上清液使用BCA法测定总蛋白浓度,按照20 μg上样检测,80 V恒压电泳,电泳结束后采用 200 mA 恒流低温转膜至NC膜(AKAP12转膜时间为2 h),室温5%脱脂奶粉封闭1.5 h,一抗4 ℃孵育12 h,PBST溶液清洗3次,每次5 min,二抗室温孵育1 h,PBST溶液清洗3次,每次5 min。扫膜读取条带并测量条带灰度值。
1.4 CCK-8细胞增殖实验取各组处于对数生长期细胞消化计数,按照4 000个细胞/孔的密度铺设于96孔板中,分别在24、48、72 h检测结果。添加CCK8试剂后2 h后于酶标仪450 nm波长处读值。
1.5 细胞平板克隆形成实验取各组处于对数生长期细胞消化计数,按照2 000个每孔铺设于6孔板中,继续培养两周后,70%酒精固定,0.1%结晶紫染色晾干镜下计数,大于50个细胞计数一个克隆。
1.6 生信网站分析乳腺癌中AKAP12表达与生存曲线使用乳腺癌数据网站Miner v4.1(bcGenExMiner v4.1)评估不同分子亚型乳腺癌中AKAP12表达情况和生存曲线分析。
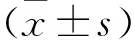
2 结果
2.1 不同分子亚型乳腺癌AKAP12表达情况及乳腺癌Luminal A型高表达AKAP12生存愈后较好使用乳腺癌信息网站(http://bcgenex.centregauducheau.fr/BC-GEM/GEM-Accueil.php?js=1)分析AKAP12表达量与乳腺癌分子分型、预后相关信息[8],结果显示如图1,各分子亚型乳腺癌AKAP12 mRNA水平明显均低于正常组织(P<0.000 1),且AKAP12在各个乳腺癌亚型的相对表达情况在不同分子分型存在差异;生存曲线显示,Luminal A型乳腺癌患者较高的AKAP12代表较好的生存愈后(P<0.05)。

图1 不同分子分型乳腺癌AKAP12表达情况及乳腺癌 Luminal A型高表达AKAP12生存愈后较好
2.2 AKAP12蛋白在各个分子分型乳腺癌细胞以及正常乳腺上皮细胞MCF-10A的表达水平选取实验室常用各个分子分型乳腺癌细胞株以及人正常乳腺上皮细胞MCF-10A,检测其AKAP12表达情况,结果显示(图2),与正常乳腺上皮细胞株MCF-10A比较,各分子亚型乳腺癌细胞株明显低表达AKAP12,差异均具有统计学意义(P<0.001,F值分别是19.00、16.01、13.61和21.89),提示AKAP12的丢失或与乳腺癌发生相关。

图2 AKAP12在各个分子亚型乳腺癌细胞以及正常乳腺上皮细胞MCF-10A的表达水平
2.3 慢病毒转染MCF-7细胞及Western blot检测AKAP12蛋白表达细胞经慢病毒转染后,Western blot检测AKAP12蛋白水平的变化,检测结果显示(图3),与空载体对照组比较,shRNA-AKAP12细胞AKAP12蛋白表达下调,两组细胞AKAP12蛋白表达差异具有统计学意义(P<0.000 1,F=1.857),表明细胞转染成功,可进行后续实验研究。
2.4 AKAP12对MCF-7细胞增殖能力的影响采用CCK-8增殖检测和细胞克隆形成实验评价AKAP12对MCF-7增殖能力的影响,72 h内CCK-8检测实验结果显示(图4A),与对照组相比,shRNA-AKAP12细胞表现出增殖速率加快,差异具有统计学意义(P<0.000 1,F=1.778);细胞克隆形成是检验单个细胞长成一个独立集落的能力,反映细胞增殖活力和持续增殖的能力,克隆形成结果显示(图4B、4C),MCF-7细胞干扰AKAP12表达后表现为细胞克隆形成多于相应空载体组,且克隆形成体积明显大于空载体组,差异具有统计学意义(P<0.001,F=2.011)。综上,干扰AKAP12表达促进MCF-7细胞的增殖能力,AKAP12或是其潜在的抑癌基因。
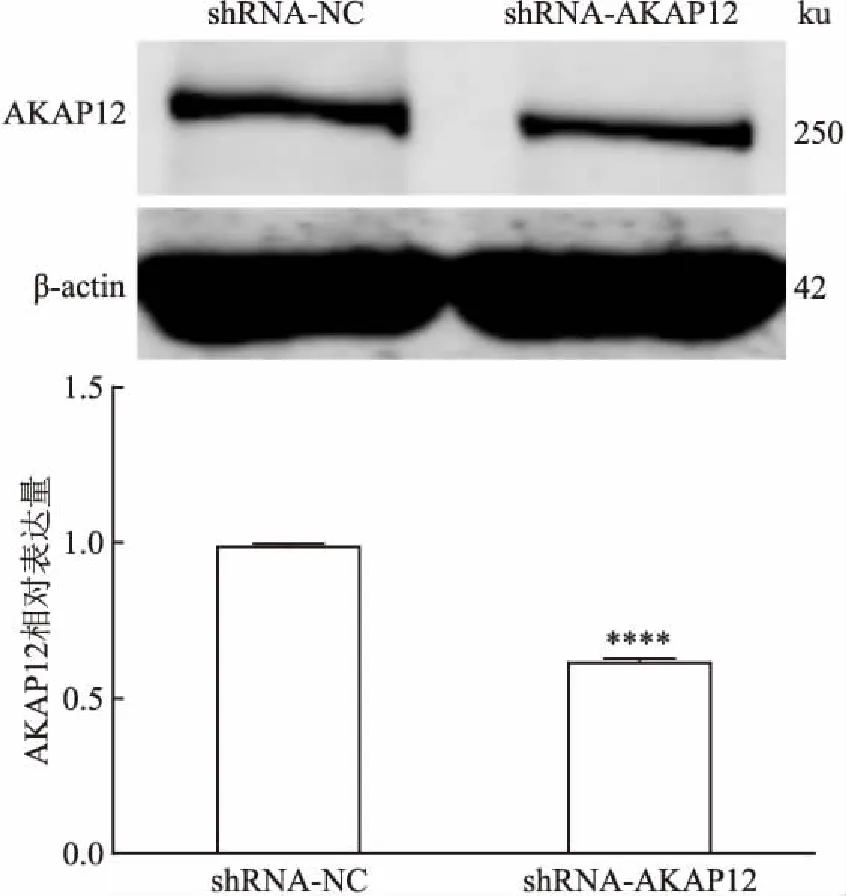
图3 干扰AKAP12基因后MCF-7细胞AKAP12蛋白的表达水平

图4 干扰AKAP12增强MCF-7细胞增殖能力
2.5 干扰AKAP12表达促进MCF-7细胞G1/S期进展干扰MCF-7细胞AKAP12表达后,Western blot检测调控G1/S期转换相关蛋白表达变化,检测结果显示抑制G1/S期转换的P27、P21蛋白表达下调,尤其是P21蛋白,然而促进G1/S期进展的CyclinD1蛋白则表达上调。干扰AKAP12表达后增加MCF-7细胞的增殖能力,加快肿瘤细胞周期(G1/S期)进展是其机制之一。见图5。
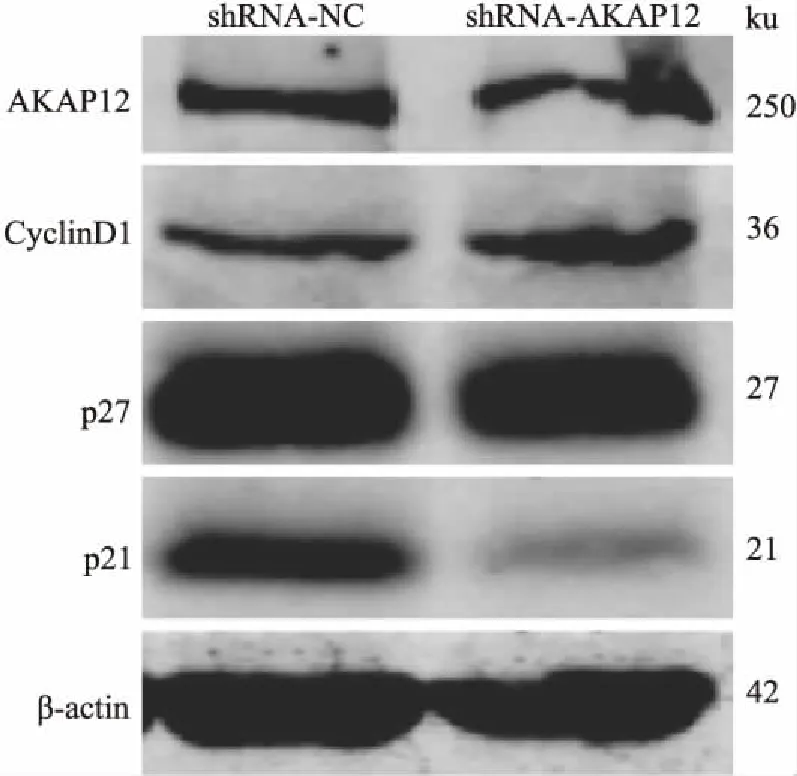
图5 干扰AKAP12表达促进MCF-7细胞G1/S期进展
3 讨论
肿瘤细胞持续增殖和凋亡受阻是其恶性行为及难于治疗的原因之一。AKAP12与肿瘤细胞增殖关系密切:过表达miR-103通过抑制AKAP12表达增加PKC活性进而增加端粒酶活性促进肝癌细胞增殖[6],抑制miR-103通过增加AKAP12表达进而可阻止端粒酶逆转录酶的核转位和磷酸化,降低肝细胞肝癌HCC细胞中的端粒酶活性从而抑制增殖并促进HCC细胞的凋亡,非小细胞肺癌中TFAP2C通过诱导致癌miR-103的过表达阻断AKAP12介导的细胞周期蛋白D1抑制进而促进肺癌细胞增殖[5],纤维肉瘤HT1080细胞[9]研究中AKAP12诱导细胞凋亡与Bcl-2的表达降低和Bax的表达增加有关,并且降低Cyclin D1表达水平且阻滞其核定位,引起细胞周期阻滞。Liu et al[10]在结直肠癌Lovo细胞重表达AKAP12发现明显抑制细胞生长并显著增加cleaved-capase3水平诱导细胞凋亡。
综上所述,AKAP12抑制肿瘤细胞增殖或通过控制细胞周期进展和促进凋亡相关蛋白表达。但也有研究通过临床结直肠癌病例样本免疫组化染色并没有发现AKAP12与Bcl-2及P53存在统计学差异[11],以及三阴性乳腺癌细胞Hs578T细胞中敲除AKAP12诱导细胞迁移能力增加[12],但不影响细胞增殖凋亡。最初在大鼠MAT-LyLu(MLL)前列腺癌细胞中证实了AKAP12具有转移抑制潜能, AKAP12重表达对原发部位肿瘤的生长影响甚微,但是明显减少了肉眼可见肺部转移,提示AKAP12发挥抑癌基因作用抑制肿瘤细胞增殖和迁移侵袭。但在黑色素瘤的研究中[13],相较于正常皮肤,原发灶及转移样本均具有较高水平AKAP12 变体2表达,降低AKAP12 v2通过减少蛋白激酶A(PKA)调节的磷酸化减少黑色素瘤的迁移和侵袭,研究结果支持AKAP12 v2及其支架功能的存在对于体外转移性黑色素瘤细胞迁移和侵袭是必要的,且较高表达AKAP12与不良生存相关,在对胃癌研究中[14],基于GEO数据库分析AKAP12在胃癌组织中的表达及临床意义,研究认为高表达AKAP12预示着不良的愈后,这也提示AKAP12作为胞内大分子支架蛋白通过锚定不同信号分子在肿瘤中存在复杂机制有待研究。
AKAP12在乳腺癌的研究鲜有报道。本研究显示AKAP12在肿瘤细胞中表达下调,提示正常乳腺组织中丢失AKAP12或与乳腺癌发生有关;ER阳性MCF-7细胞相对于其他分子分型细胞株高表达AKAP12,这与Soh et al[12]研究存在差异,Soh et al[12]认为三阴性乳腺癌细胞AKAP12表达高于其他分子亚型。研究通过在MCF-7细胞干扰AKAP12基因后观察细胞增殖、迁移侵袭等表型变化,实验结果显示AKAP12与MCF-7细胞增殖关系密切,干扰AKAP12则增强MCF-7细胞增殖能力,同时,研究也进行了Transwell实验检验MCF-7亲本株细胞及干扰AKAP12后细胞侵袭能力的变化,但未见到细胞穿过基底膜(数据未列出)。综上,本研究表明干扰AKAP12增强乳腺癌MCF-7细胞的增殖能力,与AKAP12调控细胞周期G1-S期转换相关。
