绵羊副流感病毒3 型PE2019 株的分离与鉴定
2020-08-04朱远茂陈瑞红杨木娇
朱远茂,陈瑞红,林 俊,杨木娇,薛 飞
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
副流感病毒3 型(Parainfluenza virus3,PIV3)属于副黏病毒科呼吸道病毒属成员,为有囊膜的单股负链RNA 病毒。目前已报道的呼吸道病毒属的成员主要包括人副流感病毒1 型(Human parainfluenza vi⁃rus type 1,HPIV1)、人副流感病毒3 型(Human para⁃influenza virus type 3,HPIV3)、牛副流感病毒3 型(Bovine parainfluenza virus type 3,BPIV3)和仙台病毒(Sendai virus,SV)等[1-2]。PIV3 感染主要引起宿主呼吸道系统疾病,症状主要表现为流涕、流泪、咳嗽或呼吸困难,部分宿主表现体温升高,如继发细菌或支原体感染可引起病情加重,导致呼吸道疾病综合症,造成宿主的死亡。
Hore 于1966 年最早报道了从绵羊体内分离到PIV3[3],随后在欧美陆续有该病毒的分离报道,并开展了致病性及疫苗研究,但从二十世纪九十年代以后对该病研究甚少。2014 年我国报道了从表现患呼吸道疾病山羊的鼻拭子和血清样品中检测到PIV3,并分离到一株病毒,命名为山羊副流感病毒3型(Caprine parainfluenza virus 3,CPIV 3)JS2013 株[4]。2019 年国内学者毛立等采用qRT-PCR 对1863 份绵羊血清样品进行PIV3 的检测,结果阳性率达21.5%,序列分析均为CPIV3[5]。
到目前为止,我国未有绵羊副流感病毒3 型(Ovine parainfluenza virus type 3,OPIV3)的报道。本研究对一患急性呼吸道疾病死亡绵羊的鼻拭子、气管灌洗液、胸腔积液和肺脏进行了病毒分离,结果从其胸腔积液中分离到一株病毒,经特征性的CPE、电镜观察和序列分析鉴定为OPIV3,命名为PE2019 株,系国内首次分离报道,为了解国内OPIV3 的流行情况及疫苗的研制奠定了基础。
1 材料与方法
1.1 病料样品来源2019 年哈尔滨兽医研究所动物疫病诊断中心接诊一患呼吸道疾病死亡的绵羊,采集其鼻拭子、气管灌洗液、胸腔积液和肺脏,于含3%小牛血清的α-MEM 中,于-20℃以下保存。
1.2 主要试剂MDBK 由本实验室保存;RNA 提取试剂盒、质粒提取试剂盒、胶回收试剂盒均购自AXYGEN 公 司;M-MuLV 反 转 录 酶(200 U/μL)、HPRI RNA 酶抑制剂(40 U/μL)、DL 2000 DNA Marker、ExTaq 酶、IPTG 购自宝生物工程(大连)有限公司;T4 DNA 连接酶、pGEM-T 购自Promega 公司。
1.3 病毒分离鼻拭子、气管灌洗液和胸腔积液均充分震荡后挤压吸取浸出液,3 000 r/min 4 ℃离心10 min,取上清液经0.22 μm 的滤器过滤除菌后备用。取肺部病料样品约1 cm3,剪碎,加入2 mL含3%小牛血清的MEM 培养液,置小量组织匀浆器中充分研磨,3 000 r/min 4 ℃离心10 min,取上清液经0.22 μm的滤器过滤除菌后备用。上述处理的样品接种于MDBK细胞,37 ℃5% CO2培养观察是否出现细胞病变(CPE),出现CPE 者继续培养至CPE 达到80%时收毒,继续传代至F3;培养96 h 之后无CPE 的培养物盲传3 代,如仍未出现CPE 者废弃。
1.4 病毒含量(TCID50)的测定将分离株F3 代病毒液用维持培养液10 倍倍比稀释至10-8,每个稀释度做8 孔重复,接种长成单层的96 孔细胞培养板中的MDBK 细胞,并设正常细胞对照,100 μL/孔,37 ℃、5% CO2培养,每天观察细胞病变,共培养7 d,记录CPE 孔数,根据Reed-Muench 法计算病毒的TCID50。
1.5 电镜观察将分离病毒株接种MDBK 细胞,待80%出现CPE 后进行反复冻融3 次收毒,5 000 r/min离心15 min,取上清12 000 r/min 4 ℃离心30 min,取沉淀,2%磷钨酸负染,电镜观察。
1.6 红细胞凝聚试验(HA)将分离株PE2019 的F3 代病毒液于96 孔微量血凝板中2 倍倍比稀释至211倍,50 L/孔,分别加入等量0.5%小鼠、豚鼠、鸡、兔、绵羊和牛红细胞悬液,室温静置1 h,检测分离株PE2019 效价,以红细胞100%凝集的病毒最大稀释度为该病毒HA 效价,即为1 个凝集单位。
1.7 RT-PCR 检测和分析参考GenBank 中登录的CPIV3 GS2017-2 株(MK091103)全基因组序列,分别设计并合成扩增其N 和M 基因引物,其中扩增N 基因的引物序列为NF:5'-CTATACTTAACAGCAAATGGC-3'/NR:5'-GCTCCATAATGCAGGATAATT-3',产物长度为747 bp;扩增M 基因的引物序列为MF:5'-AAAGACTTGATCCACAACTCC-3'/MR:5'-GTGTTTGATCCTCTGGTGTTG-3',产物长度为1 203 bp。利用病毒RNA 小量提取试剂盒提取病毒基因组RNA,利用NF 引物进行反转录获得cDNA 进行PCR。PCR 反应体系为1.0 μL ExTaq(5 U/μL)、5 μL 10×ExTaq Buffer、5 μL dNTP(2.5 mmoL/L)、上下游引物(20 μmoL/μL)各1μL,加水至50 μL。PCR 反应条件93 ℃3 min;94 ℃45 s、52 ℃45 s、72 ℃2 min,30 个 循 环;72 ℃10 min。将PCR 产物采用1%琼脂糖凝胶电泳分析。
将PCR 阳性扩增产物胶回收纯化后由博仕生物公司进行序列测定,测序结果与GenBank 中登录的CPIV3、BPIV3 和HPIV3 参考株进行序列比较,利用DNAStar 和MEGA X 软件进行序列同源性分析,并绘制遗传进化树。
2 结 果
2.1 病毒分离结果从患呼吸道疾病死亡绵羊采集的鼻拭子、气管灌洗液和肺脏样品接种MDBK 细胞并盲传3 代均无CPE;胸腔积液接种MDBK 第1 代即出现CPE,特征为在一层良好的单层细胞表面形成一层细胞圆缩、集聚成簇、随着时间的推移集聚的细胞破裂(图1),与副黏病毒特征性CPE 相符,初步判断该病毒为副黏病毒,将其命名为PE2019。

图1 病毒分离株PE2019 在MDBK 上的CPEFig.1 The strain PE2019 induced CPE in MDBK cells
2.2 TCID50 测定结果分离病毒株PE2019 在10-5、10-6、10-7和10-8稀释时分别出现CPE 的孔数为8孔、8 孔、3 孔和0 孔,按Reed-Muench 方法计算,病毒滴度为107.8TCID50/mL。
2.3 电镜观察结果病毒分离株PE2019 接种MDBK细胞上清,经电镜负染观察可见带有囊膜、圆形、直径约300 nm 的病毒粒子(图2);此外,可观察到病毒基因组释放出核衣壳呈长丝带状,与副黏病毒病毒粒子形态特征相符,进一步证明分离株为副黏病毒。
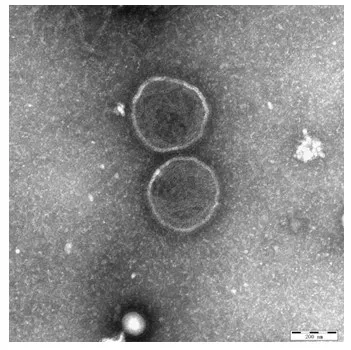
图2 分离株PE2019 病毒粒子电镜图Fig.2 Electron microscope image of the strain PE2019
2.4 血凝试验结果病毒分离株PE2019 F3代病毒均不凝集鸡、兔、绵羊和牛的0.5%红细胞,但对小鼠和豚鼠的0.5%红细胞凝集效价均为26,凝集价较高。
2.5 RT-PCR 鉴定及序列分析结果提取分离株PE2019 基因组RNA,用NF 引物进行反转录,再用N 和M 基因特异性引物进行PCR 扩增,结果获得分别约750 bp 和1 200 bp 的目的片段(图3)。

图3 分离株PE2019 的N 和M 基因RT-PCR 扩增结果Fig.3 Amplification of the N and M genefragments of the strain PE2019 by RT-PCR
对分离株PE2019的N和M基因进行序列测定,截取N 基因的680 bp 的部分基因和M 基因全长1 059 bp,与GenBank 中登录的CPIV3、BPIV3 和HPIV3 的不同参考株序列进行核苷酸序列同源性分析。结果显示,N 基因序列同源性与3 类病毒中参考株最高分别为84.0%、82.1%和78.8%,M 基因序列同源性与3类病毒中参考株最高分别为81.5%、78.4%和77.6%,且N 和M 基因均为独立一个分支(图4)。表明分离株为PIV3,但与CPIV3、BPIV3 和HPIV3 均亲缘关系较远,为一新的病毒株,由于分离株是从绵羊体内分离获得,故将分离株确定为OPIV3。

图4 基于Neighbor-Joining 法构建分离株PE2019 的N 基因(A)和M 基因(B)核苷酸序列的遗传进化树Fig.4 Neighbor joining phylogenetic tree about the N(A)and M(B)gene sequences of the OPIV3 strain PE2019
3 讨 论
随着养羊业的迅速发展,养殖密度不断扩大,规模化程度不断加深,交易也更加频繁。在转群、调运和天气变化等应激条件刺激下,羊抵抗力下降,极易造成呼吸道疾病流行。PIV3 是重要的呼吸道病原之一,2013 年江苏等多地山羊陆续暴发呼吸道疾病,造成较大经济损失,经病原学诊断CPIV3为主要病原[6]。血清流行病学调查证实许多地区(江苏、安徽、吉林、山东和广西等省或自治区)羊群中均存在CPIV3 的抗体[7-8]。以上病原学和血清学调查结果均显示我国山羊存在较为严重的CPIV3 的感染。我国绵羊养殖数量庞大,2018 年国内学者首次对绵羊是否存在CPIV3 的感染开展了调查研究,对采集的绵羊鼻拭子和血清进行抗原抗体检测,结果显示CPIV3 抗体阳性率为59.3%(1793/3026),抗原阳性率为21.5%(401/1863),并分离到11 株病毒,序列分析表明均为CPIV3[5]。至此,我国从山羊和绵羊体内均检测和分离到CPIV3,但未开展OPIV3 的检测和分离研究,因此我国山羊和绵羊群中是否存在OPIV3 的感染尚不清楚。
OPIV3 最早于1966 年在美国报道,随后在欧美等国陆续报道。致病性研究表明OPIV3 经气管注射接种1 周龄不吃初乳羔羊,可引起肺部多病灶的实变,表现为毛细支气管炎和间质性肺炎[9]。本研究接诊的患呼吸道疾病死亡绵羊的生前临床症状为精神沉郁、厌食、咳嗽和流涕,剖检后可见气管内充有黏液、肺实变和胸腔积液,符合OPIV3 感染的特征。采集鼻拭子、气管灌洗液、肺脏和胸腔积液进行病原学检测和病毒分离,结果口蹄疫、小反刍兽疫和支原体检测均为阴性,从胸腔积液中分离获得一株病毒PE2019 株,证实本次疾病流行的主要病原为OPIV3。
令人遗憾的是到目前为止GenBank 中尚未登录OPIV3 毒株的全基因组序列和M 基因的序列,这给OPIV3 的序列鉴定带来了一定的困难。2008 年,澳大利亚学者Horwood 等对7 株BPIV3 分离株进行序列分析并绘制系统发育进化树,结果显示为两个明显的分支,其中的4 株与BPIV3 经典株(SF 株)的核苷酸序列同源性为83.1%,与氨基酸序列同源性为89.9%,均显示很大的差异,认为这4 株BPIV3 为一新的基因型,定为BPIV3 基因B 型(BPIV3b)[10],随后南美的阿根廷和北美的美国亦报道了BPIV3b 的存在,支持这一基因分型。2011 年本研究团队首次分离报道了BPIV3 新的基因型,定为BPIV3c[11],随后,阿根廷、韩国、日本和美国均报道了BPIV3c 的存在。至此,BPIV3 不同毒株间核苷酸序列同源性为95%以上,一般认为是同一基因亚型;核苷酸序列同源性为80%~90%,一般认为是不同基因亚型。不同宿主的PIV3 一般根据宿主进行命名,进一步分析表明不同宿主的PIV3 毒株之间的核苷酸序列同源性一般为70%~80%,研究资料显示HPIV3、BPIV3 和CPIV3 之间全基因组序列同源性均为70%~80%[10-11]。借鉴上述BPIV3 基因亚型分类标准和不同宿主之间的PIV3 分类标准,本研究对分离株PE2019 的M 基因进行了序列测定并与HPIV3、BPIV3 和CPIV3 的M基因核苷酸序列同源性进行比对,结果表明其序列同源性 分别 为77.3%~77.6%、77.9%~78.4%和80.8%~81.5%,亲缘关系均较远,且在系统进化树上处于独立的分支。鉴于分离株宿主为绵羊,故将其确定为OPIV3。
综上所述,本研究结合患呼吸道疾病死亡绵羊生前临床症状、疾病流行特点、分离病毒引起的CPE 特征、病毒形态特征和核苷酸序列分析,证明分离株PE2019 为OPIV3,系国内首次分离报道,提示我国绵羊存在OPIV3 的感染,本研究为今后该病的流行病学、免疫学、致病机理和免疫预防等方面的进一步研究奠定了良好基础。
