猪肺炎支原体套式PCR 检测方法的建立及应用
2020-08-04刁小龙刘云迎张家铭何海蓉
栾 璐,刁小龙,刘云迎,张家铭,王 飞,何海蓉
(中崇信诺生物科技泰州有限公司 农业农村部农产品畜禽投入品安全评价重点实验室,江苏 泰州 225300)
猪支原体肺炎(Mycoplasmal pneumonia of swine,MPS)又名猪地方性流行性肺炎(Enzootic pneumoniae of swine,EPS)或者猪喘气病,是由猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)引发的一种接触性和慢性呼吸道传染病[1],该病的最主要传染源是带菌猪和患病猪,其传播途径为直接接触和空气传播[2],当患病猪和健康猪混合饲养时,常会引发大规模传播,Mhp 也可以和其它病原体一起混合感染,导致各个年龄段、种类的猪均能感染发病,其临床症状表现为咳嗽、气喘、发育迟缓、料肉比低。该病发病率高,死亡率低,世界各地均有流行[3],是造成养猪行业严重经济损失的疾病之一。
Mhp 无细胞壁,经电镜观察可见球状、环状、丝状及点状等菌体形态[4]。固体培养基培养10 d~14 d,形成半透明、圆形,边缘不整齐,且少数有中间顶端突起,大小100 μm~300 μm 的菌落。当前检测Mhp 方法主要有分离培养法、免疫荧光法、核酸探针法、PCR 等等[5],这些方法虽然可检测出病原,但存在费时费力、特异性和敏感性不高、错配率较高等缺点[6]。而套式PCR 的优点是增加扩增倍数,提高了敏感性;由于第二轮PCR 模板和引物的改变,降低了非特异性反应连续放大进行PCR 扩增的可能性,从而保证了扩增的特异性[7]。
对Mhp 的检测靶基因有P36、P46、P97、P110等,其中P36 基因编码乳酸脱氢酶蛋白(LDH),LDH是Mhp 的特异性免疫优势蛋白,极具保守和特异性,其在各个血清型Mhp 之间的同源性很高,能够诱导早期免疫反应[8-10]。本实验根据GenBank 中Mhp P36基因序列,利用Clustal 多重序列比对软件(Clust⁃al Multiple Alignment Algorithm)比对Mhp P36 基因序列,选择其保守区域,设计内外套引物,建立Mhp套式PCR 检测方法,为Mhp 的流行病学调查提供检测手段。
1 材料与方法
1.1 病毒株、菌株和临床样品Mhp 168 株菌种由江苏省农业科学院兽医研究所提供。鸡毒支原体(MG)、猪伪狂犬病毒(PRV)、猪圆环病毒2 型(PCV2)、猪鼻支原体(BRP)、猪链球菌(SS)、胸膜肺炎放线杆菌(APP)、副猪嗜血杆菌(HPS)的全基因组DNA 均由扬州大学农业部畜禽传染病学重点开放实验室提供。50 份含Mhp 的待测液体培养基来自江苏省动物重要疫病与人兽共患病防控协同创新中心。
1.2 主要试剂DNA 提取试剂盒、Taq DNA 聚合酶、dNTP Mixture、DL2000 DNA Marker 均购自宝生物工程(大连)有限公司;电泳缓冲液(50×TAE Buf⁃fer)购自生工生物工程(上海)股份有限公司;Mhp核酸检测试剂盒(PCR 法)购自广州维伯鑫生物科技股份有限公司。
1.3 引物设计与合成根据GenBank中Mhp P36基因序列(X67286.1、AY312243.1、MG813457.1、MG813451.1、MG813441.1、GU644440.1),利用Clustal 多重序列比对软件(Clustal Multiple Alignment Algorithm)选择其保守区域设计引物,引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。同时,利用Clustal多重序列比对软件Alignment 对Mhp 168 株P36 基因序列与GenBank 登录的8 个Mhp 标准株P36 基因序列(AY312243.1、 GU644440.1、 X67286.1、 AE017332.1、NC_007332.1、AE017243.1、CP003131.1、NC_021831.1)进行同源性及系统发育进化树分析。

表1 引物序列及产物长度Table 1 Primers for the nested PCR
1.4 套式PCR 反应体系的优化提取Mhp 168 株的基因组DNA,以此为模板,利用表1 的引物进行套式PCR 扩增。外套PCR 扩增反应体系为25 μL:DNA 模板2 μL、上下游引物各1 μL(浓度在5 pmol/μL~20 pmol/μL 优化)、TaqDNA 聚合酶(5 U/μL)5 μL、dNTP Mixture(2.5 mmol/L)2.0 μL、MgCl2(25 mmol/L)3 μL、10 × PCR Buffer 2.5 μL、无核酸酶水8.5 μL。PCR 反应程序为:95 ℃5 min,95 ℃30 s,退火温度以1 ℃递增共设置8 个温度(59.0 ℃~66.0 ℃)30 s,72 ℃1 min,共34 个循环,72 ℃5 min。将外套扩增的PCR 产物10 倍稀释后,作为内套PCR 扩增的模板,利用内套引物P3/P4 在相同反应体系与条件下进行第二轮PCR 扩增,退火温度设置8 个温度(47.0 ℃~54.0 ℃),引物浓度(5 pmol/μL~20 pmol/μL)进行优化。扩增产物经1.2%琼脂糖凝胶电泳检测。以Mhp 168 株的基因组为模板,采用最佳的退火温度和引物浓度进行该套式PCR 扩增,并将得到的内套PCR产物由上海华大基因科技有限公司测序,采用BLAST 对其进行序列比对分析。
1.5 特异性试验利用本实验建立的套式PCR 方法对MG、BRP、SS、APP、HPS、PCV2、PRV 的基因组DNA 进行扩增,同时以Mhp 168 株基因组DNA为阳性对照,无酶水为阴性对照,评估该套式PCR方法的特异性。
1.6 敏感性试验利用核酸蛋白分析仪对Mhp 168株基因组DNA 样本的原始核酸浓度进行测定,按照公式:拷贝数=质粒浓度×阿伏伽德罗常数/(1 个碱基对的平均分子质量×质粒总长度),计算其拷贝数后,10 倍倍比稀释(1~106),采用本研究建立的套式PCR 方法和常规PCR 方法(Mhp 核酸检测试剂盒)分别进行PCR 扩增,评估该套式PCR 方法的敏感性。
1.7 临床样品的检测50 份含Mhp 的液体培养基分别取2 mL,12 000 r/min 离心20 min,弃去上清,采用DNA 提取试剂盒提取其全基因组DNA,利用本研究建立的套式PCR、常规PCR、Mhp 分离培养方法[11]同时进行检测,以Mhp 168 株基因组DNA 作为阳性对照,水作为阴性对照,比较3 种方法的检测结果,计算相应的符合率,评价该套式PCR 方法的临床应用性。
2 结 果
2.1 Mhp 的P36 基因序列同源性及系统发育进化分析将Mhp 168 株P36 基因序列与GenBank 登录的8 个不同血清型的Mhp 标准株P36 基因序列进行同源性及系统发育进化树分析。结果显示,Mhp 168株 与8 个Mhp 株P36 基 因 序 列 同 源 性 高 达99.09%~100%,P36 基因编码的氨基酸序列同源性为99.14%~100%。上述结果表明,不同血清型Mhp 的P36 基因序列同源性极高,因此,本研究利用Mhp168 株P36基因保守区域,设计内外套引物,作为检测不同血清型Mhp的通用引物,建立套式PCR 方法。
2.2 套式PCR 反应体系优化结果以Mhp 168 株DNA 为模板,分别对外套PCR 扩增的退火温度和上下游引物浓度进行优化。结果显示,上下游引物浓度均为10 pmol/μL 时扩增效果最佳(图略);各个退火温度均能扩增出目的条带,且在63 ℃时目的条带最为清晰明亮,且无非特异性扩增(图1A),再将退火温度63 ℃的外套PCR 产物10 倍稀释,作为内套PCR 扩增的模板,进行内套PCR 退火温度和引物浓度的优化。结果显示,上下游引物浓度为10 pmol/μL时扩增效果最佳(图略);各个退火温度均能扩增出目的条带,且在50 ℃时目的条带最为清晰明亮,且无非特异性扩增(图1B),所以确定63 ℃和50 ℃分别为该Mhp 套式PCR 方法的外套和内套PCR 扩增的最佳退火温度,10 μmol/L 为该Mhp 套式PCR 方法的最佳引物浓度。
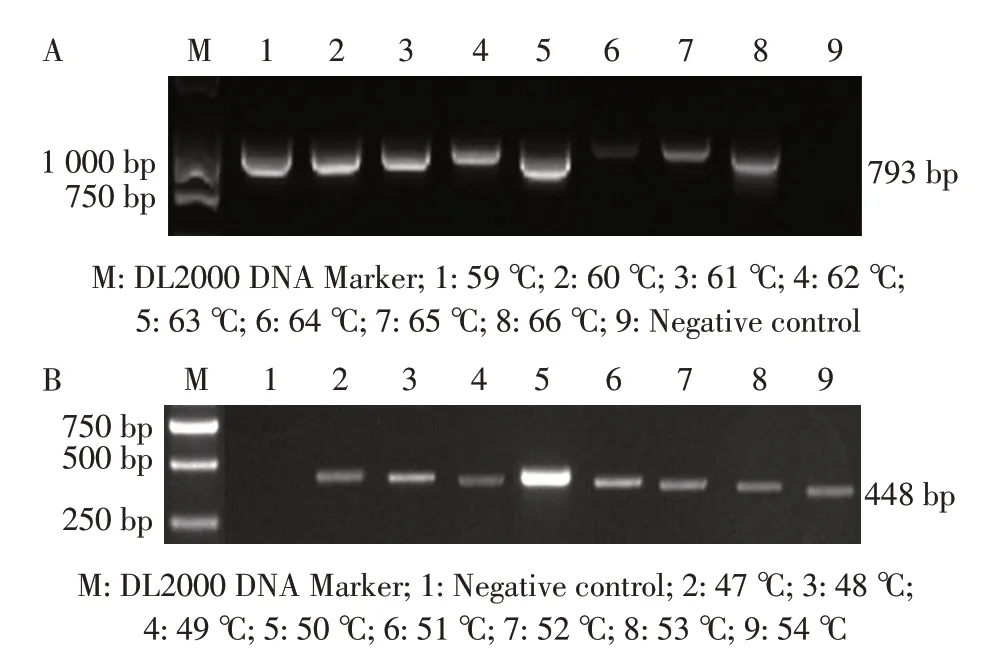
图1 套式PCR 外套PCR 扩增(A)与内套PCR 扩增(B)的退火温度优化结果Fig.1 The optimized annealing temperature for the nested PCR external(A)and internal(B)amplification
2.3 套式PCR 产物的测序鉴定以Mhp 168 株DNA 为模板,利用建立的套式PCR 扩增。结果显示,扩增出外套793 bp 和内套448 bp 的目的条带,将内套PCR 产物测序序列经NCBI BLAST 比对分析显示,扩增的448 bp Mhp 目的片段与GenBank 中Mhp P36 基因(AY312243.1)的相应片段相似性高达99.89%,表明该套式PCR 适用于对Mhp 的检测。
2.4 特异性试验结果利用该套式PCR 方法,分别 对MG、 BRP、 SS、 APP、 HPS、 PCV2、 PRV、Mhp 168 株DNA 进行扩增。结果显示,仅Mhp 扩增出外套793 bp 和内套448 bp 的目的条带,其余病原扩增结果均为阴性(图2),表明建立的该套式PCR方法特异性较强。
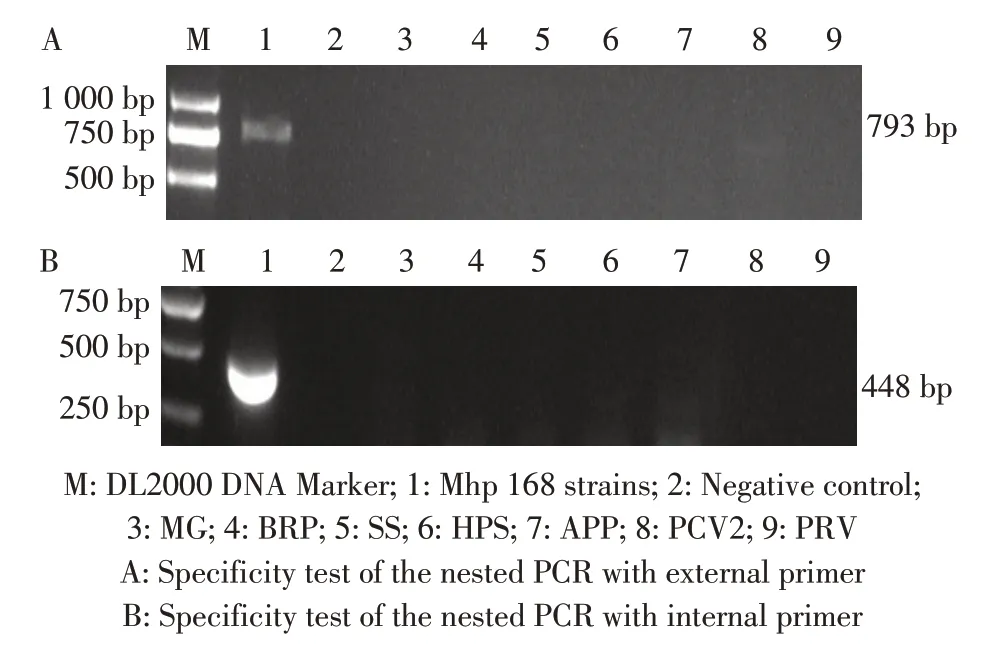
图2 套式PCR 特异性的试验结果Fig.2 The result of specificity test
2.5 敏感性试验结果利用核酸蛋白分析仪测得Mhp 168 株的核酸浓度为20 ng/μL,经计算得出其核酸浓度为1×106拷贝/μL。将其10 倍倍比稀释后,利用套式PCR 方法和常规PCR 方法分别进行PCR 扩增。结果显示,该套式PCR 和常规PCR 的检测下限分别为10 拷贝/μL 和103拷贝/μL(图3),套式PCR的敏感性是常规PCR 方法的100 倍,表明本研究建立的Mhp 套式PCR 方法敏感性较高。
2.6 临床样品的检测结果提取50 份含Mhp 的培养基的全基因组DNA,利用该套式PCR、常规PCR、Mhp 分离培养方法分别进行检测。结果显示,这3种方法对Mhp 的检出率分别为88%(44/50)、82%(41/50)、88%(44/50)。套式PCR 与常规PCR 阳性符合率为93.2%,阴性符合率为66.7%,总体符合率为94%;套式PCR 方法与Mhp 分离培养方法的符合率为100%(表2)。表明套式PCR 方法检测的准确率较高,可以用于临床样品的检测。

图3 套式PCR(A)与常规PCR(B)的敏感性试验结果Fig.3 The sensibility test of the nested PCR(A)and conventional PCR(B)
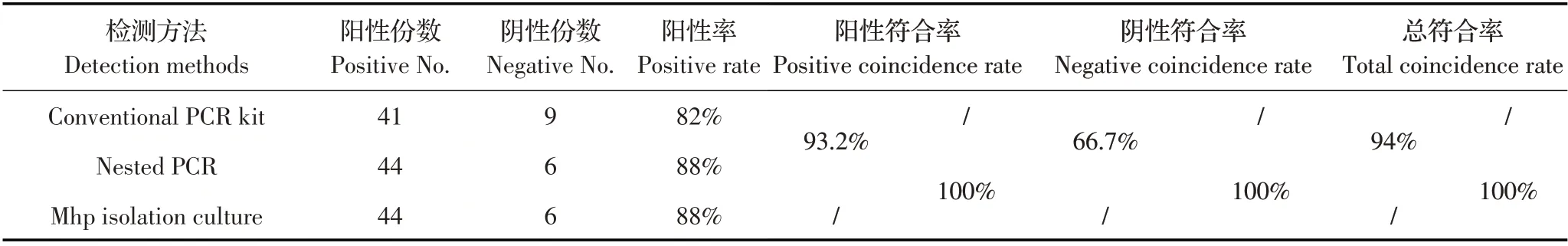
表2 3 种不同的方法对临床样品的检测结果Table 2 Detection of clinical samples by three different methods
3 讨 论
近年来,由Mhp 与细菌、病毒等病原协同作用而引起的猪病严重影响到猪业经济发展和效益,阻碍我国养猪业的扩大和发展[12],因此,急需开发快速、高效、准确的检测方法来检测Mhp。随着分子生物学检测技术的发展,有研究人员已于2014 年建立了基于Mhp P46 基因的常规PCR 方法,其对Mhp的检测下限为0.675 μg/μL[13]。徐引弟等于2019 年建立了基于16S rRNA 基因的常规PCR 方法,其对Mhp的检测下限为0.1 μg/μL[14],而吉玛等人[5]和张旭等人[15]建立的基于P36 基因的套式PCR 方法,其对Mhp 的检测下限分别为0.1 pg/μL 和3.3 pg/μL,表明套式PCR 的敏感性明显高于常规PCR。套式PCR 具有敏感性高、费用相对便宜,不需要特殊仪器设备等优势[16-18],能够广泛应用于临床病原的检测。
Mhp 中有一些重要的免疫原性蛋白,包含3 个膜蛋白P46、P65、P74 以及黏附素P97,细胞溶脂蛋白P36 等[19],但有研究表明基于Mhp P36 基因设计的引物建立的套式PCR 方法的敏感性明显高于其它基因引物[20]。所以本研究首先分析了Mhp 168 株的P36 基因序列与8 个不同血清型的Mhp 标准株P36 基因序列的同源性。结果显示,Mhp 168 株P36 基因序列与GenBank 中8 个Mhp 标准株P36 基因序列及其编码的氨基酸序列同源性均很高。所以本研究选用Mhp 168 株的P36 基因保守区域,设计出内外套引物,通过条件优化建立了检测Mhp 的套式PCR方法。
由于套式PCR 要进行两轮PCR 扩增,引起交叉污染的几率较大,在检测Mhp 时极易出现假阳性的结果。为了克服此缺点,本研究将外套PCR 产物10倍倍比稀释后,作为内套PCR 扩增的模板,来降低DNA 模板量,且在生物安全柜中配置PCR 反应体系,避免了检测Mhp 时出现假阳性的结果,同时内外套引物退火温度不同,也可以减少交叉污染的几率。从而提高其特异性。本研究建立的套式PCR 方法,对Mhp 的最低检测限为10 拷贝/μL,且特异性较强。通过对临床样品的检测,套式PCR 方法与常规PCR 的总体符合率为94%,与Mhp 分离培养方法的符合率为100%。表明该套式PCR 方法检测的准确率较高,可以用于临床样品的检测,为Mhp 的流行病学调查提供了检测手段。
