犬腺病毒和犬细小病毒双重TaqMan 荧光定量PCR 检测方法的建立
2020-08-04王艳杰巨敏莹王秀明刘亭岐刘东霞刘建奇孔彩平范秀丽赵丽霞宋庆庆
王艳杰,巨敏莹,王秀明,刘亭岐,刘东霞,刘建奇,孔彩平,范秀丽,赵丽霞,宋庆庆*
(1. 金宇保灵生物药品有限公司,内蒙古 呼和浩特 010030; 2. 国家工程实验室,内蒙古 呼和浩特 010030;3. 内蒙古农业大学,内蒙古 呼和浩特 010018)
犬腺病毒(Canine adenovirus,CAV)属腺病毒科,哺乳动物腺病毒属,其基因组为双股,线状DNA 病毒,根据其血凝和中和试验等特性不同可将CAV 分为I 型和II 型[1-2], CAV-I 型主要引起犬的致死性肝炎,引起野生犬脑炎病理学变化;CAV-II 型则引起上呼吸道感染和肠道感染,不引起肺炎症状,可引起幼犬咳嗽又叫犬窝咳[1-3]。
犬细小病毒病又称犬传染性出血性肠炎(Ca⁃nine prvovirus,CPV),属于细小病毒科,细小病毒属成员,是一类无囊膜、单股DNA 病毒。临床症状表现分为肠炎型和心肌炎型,肠炎型潜伏期1~2周,多见于青年犬,病情较轻且治愈率高,而心肌炎型多见于8 周龄以下的幼犬,突然发病,数小时死亡[4-6]。
这两种病毒单一感染或混合感染均可给养犬业带来严重的打击,两种犬病原临床症状较为相似,且常伴有混合感染,给临床诊断造成了一定的困难[7-8]。现有学者建立了用于同时检测犬瘟热病毒(CDV)、CPV、CAV-II 型和犬副流感病毒(CPIV)的多重普通PCR 检测技术[3],以及CDV、CPV、I 型和II 型CAV 多重普通PCR 检测方法[1],本研究拟建立CAV 和CPV 双重TaqMan 荧光定量PCR 检测方法,以提高产品检测敏感度和提高产品检测的效率,并降低气溶胶污染的风险,本研究利用TaqMan 检测技术原理,设计了扩增CAV 的Hexon 基因和CPV 的VP2 基因的2 对引物和2 条探针,建立双重TaqMan荧光定量PCR 检测方法,以实现CAV 和CPV 的快速鉴别检测,为两种病毒的检测提供有效的技术保障,同时为CAV 和CPV 疫苗半成品的抗原定量和疫苗产品的质量监控提供技术手段。
1 材料与方法
1.1 主要实验材料CAV DNA、CPV DNA、CDV RNA、CPIV RNA、犬冠状病毒(CCV)RNA 均由金宇保灵生物药品有限公司提供。用于感染实验犬的CAV、 CPV 株均由金宇保灵生物药品有限公司分离、鉴定和保存。比格犬购自江苏省常州市某试验动物犬基地。MDCK 细胞购自ATCC;AceQ qPCR Probe Master Mix 试剂盒购自Vazyme 公司;DL2000 DNA Marker、pMD19-T 载体、JM109 感受态细胞、质粒提取试剂盒、凝胶回收试剂盒等均购自TaKaRa公司;Axyprep 病毒核酸提取试剂盒(AxyprepTMBody Fluid Viral DNA/RNA Miniprep Kit)购自AxyGen 公司。
1.2 引物、探针的设计与合成根据GenBank 中登录的CAV 基因序列(EU717145.1)和CPV 基因序列(EF028071.1),利 用DNAStar 软 件 进 行 同 源 性 分析,采用Primer3 设计引物和探针(表1),引物和探针均由上海生工生物工程技术服务有限公司合成。

表1 CAV 和CPV 引物、探针序列Table 1 Primers and probes sequence of CAV and CPV
1.3 重组质粒标准品的构建与鉴定分别以CAV 和CPV DNA 为模板,采用表1 引物进行PCR扩增,反应体系为:2×AceQ qPCR Probe Master Mix 12.5 μL,上下游引物(10 μmol/L)各为0.5 μL,模板为2 μL,加无酶水补充至25 μL;反应条件为: 95 ℃5 min;95 ℃30 s、56 ℃30 s、72 ℃30 s,共35 个循环;72 ℃7 min。扩增的CAV 和CPV 目的片段长度分别为132 bp 和192 bp,PCR 产物回收经试剂盒纯化后克隆至pMD19-T 载体,转化至JM109 感受态细胞,选取经菌落PCR 鉴定和序列测定分析验证的阳性重组质粒pMD-Hexon-CAV 和pMD-VP2-CPV 作为质粒标准品。测定重组质粒浓度,并根据拷贝数计算公式换算成拷贝数。
1.4 双重荧光定量PCR 检测方法反应条件的优化采用25 μL 反应体系,其中2×AceQ qPCR Probe Master Mix 12.5 μL,上 下游引物(10 μmol/L)各为0.125 μL、0.25 μL、0.375 μL、0.5 μL、0.625 μL,探针(10 μmol/L)为0.25 μL、0.5 μL、0.75 μL、1.00 μL、1.25 μL,模板为5 μL,加dd H2O 补充至25 μL,采用棋盘法进行引物和探针浓度优化。CAV 和CPV 双重荧光定量PCR 体系比例配置按照1:0.5、1:1、1:1.5 和1:2 进行优化。扩增循环条件如下:95 ℃,10 min;95 ℃10 s、52 ℃~62 ℃30 s Read,循环数为45,进行退火温度优化。
1.5 双重荧光定量PCR 标准曲线的绘制将pMDHexon-CAV 和pMD-VP2-CPV 重组质粒标准品稀释至108拷贝/μL 后再作10 倍倍比稀释,采用已建立的双重荧光定量PCR(模板为2 种重组质粒标准品混合物)方法进行荧光定量PCR 扩增,通过分析软件生成标准曲线。
1.6 特异性试验利用优化的反应体系和条件对CDV、CPIV、CCV 核酸进行双重荧光定量PCR 扩增,以MDCK 细胞培养的CAV-I 型、CAV-II 型和CPV 培养液提取的核酸作为阳性对照,同时设立阴性对照。验证该方法的特异性。
1.7 敏感性试验以分别10 倍倍比稀释的(101拷贝/μL~108拷贝/μL)的两个质粒标准品混合物作为模板,按照本研究建立的CAV 和CPV 双重TaqMan荧光定量方法进行PCR 扩增,每个稀释度做3 次重复。确定TaqMan 双重荧光定量PCR 的敏感性,同时设立阴性对照。
1.8 重复性试验以103拷贝/μL~106拷贝/μL 4 个稀释度CAV 和CPV 混合重组质粒标准品为模板分别进行3 次重复扩增,利用本研究建立的方法检测,进行组内重复性分析;9 个不同批次的CAV 和CPV 混合模板重组质粒标准品为模板,利用本研究建立的方法检测,进行组间重复性分析,计算变异系数,分析该方法重复性。同时设立阴性对照。
1.9 临床模拟样品检测选择2~3 月龄健康易感犬6 只,分成3 组,一组口服感染2 mL 103.0TCID50/mL CPV 细胞培养病毒液,一组分别口服、滴鼻各1 mL 106.0TCID50/mL 的CAV 细 胞 培 养 病 毒 液,另 一 组 作 为未感染对照,连续观察感染犬临床症状,并于第14 d 解剖。将采集的分别感染CAV(10 份)和CPV(27 份)的犬新鲜口、鼻、眼、尿、肛式子和心、肝、脾、肺、肾、脑、肠、胃、气管、扁桃体、颌下淋巴结、肠系膜淋巴结组织,反复冻融并研磨后加入裂解液进行裂解,以提取的样品基因组DNA/RNA 为模板。分别采用本实验建立的荧光定量PCR和检测CAV(DB51/T 1710.7-2013)、CPV 的普通PCR方法[9]进行检测,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 质粒标准品的构建与鉴定以CAV 和CPV DNA 为模板,利用设计的引物进行PCR 扩增,结果显示扩增获得预期大小目的片段(图略)。目的片段回收纯化后克隆于pMD19-T 载体中,构建重组质粒pMD-Hexon-CAV 和pMD-VP2-CPV,重组质粒经菌落PCR 鉴定和测序鉴定正确,测得重组质粒浓度为103 ng/μL 和81.7 ng/μL,换算成拷贝数分别为2.27×1010拷贝/μL 和1.80×1010拷贝/μL,作为双重荧光定量PCR 的标准品。
2.2 双重荧光定量PCR 反应条件的优化及标准曲线的建立经优化后,确定反应体系为(25 μL):2×AceQ qPCR Probe Master Mix 为12.5 μL,CAV 上下游引物(10 μmol/L)各为1 μL,CAV 探针(10 μmol/L)为0.75 μL,CPV 上下游引物(10 μmol/L)各为1 μL,CPV 探针(10 μmol/L)为0.75 μL,CAV 和CPV 1:1 混合模板为5 μL,加dd H2O 补充至25 μL。反应程序为: 95 ℃10 min; 95 ℃15 s,56 ℃30 s Read,循环数为45。经优化后CAV 和CPV 双重荧光定量PCR检测方法阴性对照无CT 值,CAV 和CPV 阳性对照CT 值均小于30,扩增曲线呈现典型的扩增曲型曲线,每一样品均进行了两个重复(图1)。将重组质粒标准品稀释至108拷贝/μL 并作10 倍倍比稀释,采用优化后的双重荧光定量PCR 扩增,生成标准曲线(图1)。结果显示,CAV和CPV相关系数分别为0.999和0.998,效率分别为99.8 和104.3,均在90%~110%之间,具有良好的线性关系。其回归方程分别为,CAV:y=-3.326x+38.933; CPV:y=-3.223x+39.882,因此可以根据所检测临床样品的Cq 值,参照标准曲线可以计算出待测样品的拷贝数。

图1 CAV 和CPV 双重荧光定量PCR 扩增曲线Fig.1 Amplification curve of CAV and CPV by the duplex qPCR assay
2.3 特异性试验结果采用建立的CAV 和CPV 双重荧光定量PCR 检测方法对CDV、CPIV、CCV 核酸进行PCR 扩增,设置2 个重复,并设立阴性和CAV-I、CAV-II、CPV 的核酸作为阳性对照。结果显示只有CAV-I、CAV-II 和CPV 核酸出现扩增曲线,且CT 值均小于30,而其他病原和阴性对照均无扩增曲线,呈阴性(图2),表明所建立的方法具有较强的特异性。
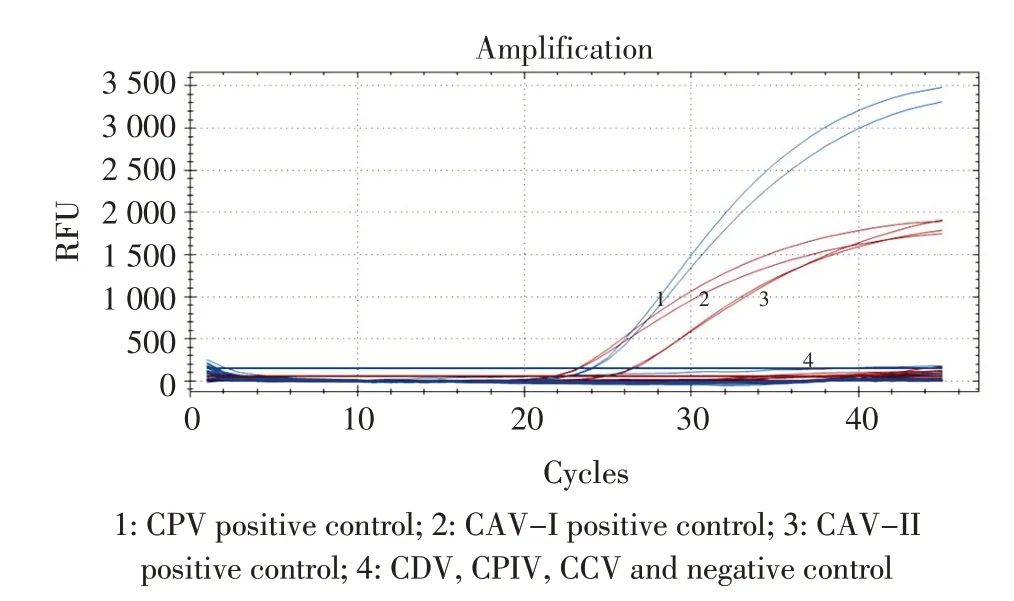
图2 双重荧光定量PCR 检测方法特异性试验Fig.2 The specific test of the duplex qPCR assay
2.4 敏感性试验结果应用本研究建立的CAV 和CPV 双重荧光定量PCR检测方法对经10倍倍比稀释的两个质粒标准品pMD-Hexon-CAV 和pMD-VP2-CPV 混合物(每一个质粒每个稀释度各取2.5 μL)作为模板进行该方法敏感性检测,结果显示,对质粒标准品pMD-Hexon-CAV 和pMD-VP2-CPV 的最小检出量均为101拷贝/μL(图3)。表明本研究建立的双重荧光定量PCR 方法敏感性较高。

图3 双重荧光定量PCR 检测方法敏感度检测Fig.3 The sensitivity test of the duplex qPCR assay
2.5 重复性试验结果利用CAV 和CPV 的4 个稀释度的各两个质粒标准品DNA模板混匀后进行组内和组间的重复性试验,利用变异系数计算公式计算变异系数,结果显示,CAV和CPV组内和组间变异系数均小于2%(表2),表明该方法具有较好的重复性。

表2 重复性试验结果Table 2 Repeatability test of the duplex qPCR assay
2.6 临床模拟样品检测结果将分别采集的10 份(CAV)和27 份(CPV)人工感染犬组织样品,分别利用建立的双重荧光定量PCR方法和普通PCR方法进行检测。结果显示,双重荧光定量PCR方法CAV检测阳性率为0(0/10),CPV 检测阳性率为88.89%(24/27),普通PCR 方法CAV 检测阳性率为0(0/10),CPV 检测阳性率为85.18%(23/27),根据金标准计算符合率的方法,所建立的双重荧光定量PCR 方法与普通PCR方法CAV 和CPV 的符合率分别为100%和96.30%。表明,所建立的双重荧光定量PCR 方法与普通PCR 方法符合率高,且CAV 阳性率低、CPV 阳性率高与感染动物典型临床症状相符,同时本检测阳性率只能代表本次感染样品的结果,受感染病毒株、剂量、途径和采样位置的不同,阳性率会存在差异,本临床模拟样品检测试验仅为验证方法的符合率。
3 讨 论
本研究分别根据CAV 和CPV 的保守基因,设计了分别检测CAV 和CPV 的1 对引物及其对应的1 条探针,实现两个病毒的同时检测,CAV 和CPV 双重荧光定量PCR 检测方法大大缩短了普通PCR 检测的时间,并且因其封闭式避免了PCR 产物气溶胶的污染,更好的保护了实验室环境,而且双重荧光定量PCR 相比于单重荧光定量PCR 降低了试验时间、成本以及同一样品中CAV 和CPV 两指标分别检测的误差,操作更加准确、快速。
本研究为避免双重PCR 两种不同检测指标之间的干扰,在PCR 引物探针设计阶段,尽可能将CAV和CPV 的目的片段设计得大小接近,且引物,探针退火温度接近,同时优化了CAV 和CPV 两种体系的引物和探针浓度对应比例关系和退火温度,使两种病毒检测干扰因素尽可能最低,经优化发现两种病毒单重PCR 和双重PCR 不存在干扰,单重和双重检测敏感度均为10 拷贝/μL,8 个梯度标品CT 值也无明显差异,该荧光定量PCR 检测敏感度比文献2 的多重检测敏感度(106拷贝/μL)约高10 000 倍,比文献2 的单重检测敏感度(105拷贝/μL)约高1 000 倍,尽管检测敏感度的表述方式不一,但根据文献[10]的联合PCR 与TCID50检测敏感度比较,证明理论上PCR 检测方法的敏感度要优于TCID50。随着新型检测技术的开发,文献[11]的高效纳米检测技术的敏感度也具有一定的优势,但是同文献[12]和[13]的普通PCR 一样,均需要进行琼脂糖凝胶电泳,不利于实验室环境的保护,且无法实现定量检测,同时荧光定量PCR 检测结果直观,无干扰条带对结果判定不清的弊端。
将本研究建立的CAV 和CPV 双重荧光定量PCR检测方法与普通PCR 检测方法进行符合率分析,符合率高且CAV 和CPV 双重荧光定量PCR 不仅能实现双指标的同时检测,并且可实现两种病毒的定量检测,因此本研究所建立的CAV 和CPV 双重荧光定量PCR 检测方法不仅可用于CAV 和CPV 感染监测还可实现兽用疫苗生产企业中CAV 和CPV 联苗抗原含量的检测,具有一定的指导生产意义,大大缩短疫苗抗原含量测定时间。
