白细胞分化抗原36的棕榈酰化位点突变对HepG2细胞自噬的影响*
2020-08-04俞婷,夏珺,赵蕾
俞 婷, 夏 珺, 赵 蕾
(重庆医科大学脂糖代谢性疾病重庆市重点实验室,重庆400016)
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,是一种正常的生理现象[1]。自噬参与了各种疾病的发生发展,包括肿瘤、非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)等[2-3]。
白细胞分化抗原36(cluster of differentiation 36,CD36)是一种模式识别受体,能识别多种内源性和外源性有害物质,与多种疾病的发生发展密切相关[4]。既往研究表明,在肝细胞中过表达CD36 可以抑制自噬,下调CD36 的表达则可激活自噬[5]。我们课题组近期研究表明CD36 棕榈酰化修饰与其功能密切相关,CD36 棕榈酰化修饰能够改变其在细胞膜上的定位,增加细胞对游离脂肪酸的摄取,抑制脂肪酸β 氧化,导致细胞内脂质积聚和炎症,而CD36 棕榈酰化位点突变能减少CD36在细胞膜上的定位,降低细胞对脂肪酸的摄取,改善细胞内脂质积聚和炎症[6]。然而,目前尚不清楚CD36 棕榈酰化修饰在自噬中的作用。因此本研究拟通过构建CD36 棕榈酰化位点突变的HepG2细胞,探讨CD36棕榈酰化位点突变对HepG2细胞自噬的影响及其分子机制。
材 料 和 方 法
1 细胞
参照本实验室已发表文献[6],构建过表达野生型CD36(WT-CD36)和棕榈酰化位点突变型CD36(AA-SS)的HepG2细胞。用PCI-CD36作为模板和突变引物,用多点定向诱变试剂盒(Quick Change ⅡXL,Agilent Technologies)生成 CD36 突变体。慢病毒构建体由上海基因化学公司提供,包括GV341 空载体(阴性对照,negative control,NC)、含WT-CD36的 GV341 载体(WT-CD36)及含 AA-SS 的 GV341 载体。按MOI=10来感染HepG2细胞,并用Sangon提供的嘌呤霉素筛选细胞,分别命名为NC-HepG2、WTCD36-HepG2和AA-SS-HepG2。
2 主要试剂
棕榈酸(palmitate acid,PA)和牛血清白蛋白(bovine serum albumin,BSA)购于Sigma;GFP-mRFP标记的微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)双荧光腺病毒购于上海吉凯基因化学技术有限公司;BCA 蛋白定量检测试剂盒和兔抗人β-actin 多克隆抗体购于北京鼎国公司;兔抗人转录因子EB(transcription factor EB,TFEB)多克隆抗体购自于Proteintech;兔抗人FAT/CD36 和鼠抗人FAT/CD36 单克隆抗体购于Novus;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG 抗购于北京中杉金桥公司;TRIT 荧光Ⅱ抗购于北京中杉金桥公司;PVDF 膜和磁珠购于Millipore;ECL 化学发光试剂购于Bio-Rad;羟胺(hydroxylamine,HAM)购于Sigma。
3 主要方法
3.1 细胞培养 细胞用含有10%胎牛血清和1%青霉素-链霉素的DMEM 高糖培养液培养,置于37℃、5%CO2培养箱中。
3.2 荧光共聚焦显微镜检测自噬小体和自噬-溶酶体以及TFEB核转位 将WT-CD36-HepG2和AA-SSHepG2 细胞分别种到共聚焦皿中,待细胞完全贴壁后,加入 LC3 双荧光腺病毒(1∶20 000),72 h 后,0.2% BSA 饥饿处理 12 h,0.2 mmol/L PA 处理24 h,通过共聚焦显微镜观察荧光情况,反映细胞自噬状态(红色荧光增强,同时绿色荧光增强,表明自噬小体形成增加,自噬-溶酶体形成减少;红色荧光增强伴绿色荧光减弱,表明自噬小体形成增加,自噬-溶酶体形成增加)。另将WT-CD36/AA-SS-HepG2 细胞种到共聚焦皿,0.2% BSA 饥饿处理12 h,0.2 mmol/L PA 处理 24 h,冰甲醇固定细胞,3% BSA 封闭,TFEB 抗体(1∶50)4℃孵育过夜,荧光Ⅱ抗室温孵育30 min,DAPI 染色5 min,共聚焦显微镜下观察TFEB的核转位情况。
3.3 免疫共沉淀-酰基-生物素置换实验(IPABE) 用含有蛋白酶抑制剂和N-乙基马来酰亚胺的裂解缓冲液提取总蛋白质。用抗CD36 抗体和磁珠沉淀CD36 蛋白后,将样品用缓冲液重悬。在pH 7.2 缓冲液稀释的样品中加入羟胺(+HAM)或加入羟胺缓冲液(-HAM),室温旋转混匀50 min。加入生物素BMCC 缓冲液,4℃旋转混匀50 min,然后用样品缓冲液煮沸来洗脱磁珠上的蛋白质,通过SDSPAGE 分离上清液,并将其电转至PVDF 膜。检测棕榈酰化的CD36 时,将膜与HRP 偶联的链霉亲和素(streptavidin,Strep)在37℃下孵育1 h;检测总CD36时,将膜与抗CD36抗体4℃孵育过夜,随后用HRP偶联的Ⅱ抗室温孵育1 h。
3.4 Western blot 检测蛋白表达 用试剂盒提取蛋白质,用BCA 试剂盒检测并标化蛋白,SDS-PAGE 分离蛋白,PVDF膜转膜后用3%BSA于37℃封闭1 h,I抗4℃孵育过夜,HRP 标记的Ⅱ抗室温孵育1 h,TBST 洗膜,ECL 试剂显影。通过ImageJ 软件分析条带。
3.5 免疫共沉淀检测CD36/Fyn 共聚体的形成 将裂解好的蛋白与抗体孵育(4℃)过夜,然后添加蛋白A/G 磁珠,4℃旋转混匀1~3 h。在SDS 样品缓冲液中煮沸5 min,洗脱结合的蛋白质,并通过SDS-PAGE 分离上清液,PVDF 膜转膜后用3% BSA 于37℃封闭1 h,I 抗4℃孵育过夜,HRP 标记的Ⅱ抗室温孵育1 h,使用ECL试剂进行检测。通过ImageJ分析条带。
4 统计学处理
所有数据均采用GraphPad Prism 软件进行统计分析。所得到的数值均以均数±标准误(mean±SEM)表示。两组间均数比较采用两独立样本t检验;多组间均数比较采用单因素方差分析,多重比较采用Tukey检验。以P<0.05为差异有统计学意义。
结 果
1 构建过表达野生型/棕榈酰化位点突变型CD36的HepG2细胞
Western blot 检测结果显示,与NC 组相比,WTCD36 和 AA-SS 组 CD36 蛋白的表达均显著增加(P<0.01),见图1A;IP-ABE 检测到在 WT 组中 CD36 蛋白发生了棕榈酰化修饰,而在AA-SS 组中CD36 未发生棕榈酰化修饰(P<0.01),表明模型构建成功,见图1B。
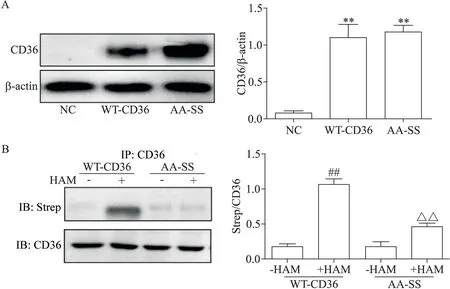
Figure 1.Identification of HepG2 cells overexpressing wild-type CD36(WT-CD36)/mutated CD36 at palmitoylation sites(AA-SS).A:the protein expression of CD36 in NC,WT-CD36 and AA-SS cell lines;B:palmylation modification in WT-CD36 and AA-SS cell lines.HAM:hydroxylamine;Strep:streptavidin.Mean±SEM. n=3.**P<0.01 vs NC group;##P<0.01 vs WTCD36-HAM group;△△P<0.01 vs WT-CD36+HAM group.图1 HepG2细胞中过表达野生型CD36/棕榈酰化位点突变型CD36细胞的鉴定
2 HepG2 细胞中CD36 的棕榈酰化位点突变可以增强自噬
与WT-CD36 组细胞比,AA-SS 组细胞红色荧光显著增强,绿色荧光显著减弱(P<0.01),自噬小体增加,且自噬-溶酶体也增加,自噬-溶酶体流增强,见图2。
3 HepG2 细胞中CD36 的棕榈酰化位点突变可以促进TFEB核转位
AA-SS 组细胞中红色荧光(TFEB)较WT-CD36组明显增强,且红色荧光与细胞核的共定位也明显增强,即TFEB核转位显著增加(P<0.05),见图3。
4 CD36 的棕榈酰化位点突变对LKB1/AMPK 途径的影响
Western blot 结果显示,与WT-CD36 组相比,AA-SS 组p-LKB1/LKB1 比值显著降低(P<0.01),p-AMPK/AMPK比值显著升高(P<0.01),见图4。
5 CD36 的棕榈酰化位点突变使CD36/Fyn 的蛋白共聚体减少
免疫共沉淀的结果表明,与WT-CD36 组相比,AA-SS 组的CD36/Fyn 共聚体形成显著减少(P<0.01),见图5。

Figure 2.Effect of palmitoylation site mutation of CD36 on the autophagy of HepG2 cells.A:autophagy in WT-CD36/AA-SS-HepG2 cells was detected by dual fluorescent adenovirus(scale bar=10 μm);B,C:the Pearson correlation coefficient and correlation rate.Mean±SEM. n=3.**P<0.01 vs WT-CD36 group.图2 CD36蛋白棕榈酰化位点突变对HepG2细胞自噬的影响

Figure 3.Effect of palmitoylation site mutation of CD36 on TFEB nuclear translocation in HepG2 cells.Scale bar=10 μm.Mean±SEM. n=3.*P<0.05 vs WT-CD36 group.图3 CD36蛋白棕榈酰化位点突变对HepG2细胞中TFEB核转位的影响

Figure 4.Effect of CD36 palmitoylation site mutation on LKB1/AMPK pathway in HepG2 cells.Mean±SEM. n=3.**P<0.01 vs WTCD36 group.图4 CD36蛋白棕榈酰化位点突变对HepG2细胞中LKB1/AMPK通路的影响
讨 论
自噬与NAFLD 的发生发展密切相关,自噬不仅影响肝细胞中脂质的降解,还参与肝细胞损伤和肝脏炎症的发生和发展[3]。本研究构建了WT-CD36-HepG2 和 AA-SS-HepG2 细胞,LC3 双荧光腺病毒结果显示,与WT-CD36 组相比,AA-SS 组自噬小体增加,且自噬-溶酶体也增加,表明CD36 棕榈酰化位点缺失会增强HepG2细胞的自噬-溶酶体流。
TFEB属于碱性螺旋-环-螺旋亮氨酸拉链转录因子家族,TFEB 的核转位是启动溶酶体生物发生和调控自噬-溶酶体流的关键因素[7]。TFEB 的核转位受到磷酸化修饰的严密调控。当TFEB 发生去磷酸化时,其进入细胞核内,与核内自噬相关基因结合,启动自噬;而磷酸化的TFEB 则滞留在细胞质内,不能与核内自噬相关基因结合,从而使自噬处于较低水平[7]。生物能量代谢调节的关键分子AMPK 可以通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),抑制 TFEB 的磷酸化,增加TFEB 核转位[8]。本研究结果显示,AA-SS 组 AMPK的磷酸化水平比WT-CD36 组明显增加,TFEB 在细胞核的定位也显著增加,表明了CD36棕榈酰化位点突变可能通过激活AMPK 通路,促进TFEB 的核转位。

Figure 5.Effect of CD36 palmitoylation site mutation on formation of CD36/Fyn complex in HepG2 cells.Mean±SEM. n=3.**P<0.01 vs WT-CD36 group.图5 CD36 棕榈酰化位点突变对HepG2 细胞中CD36/Fyn蛋白共聚体形成的影响
研究表明,CD36 能与 Fyn 形成共聚体[6],促进LKB1 的磷酸化,促使LKB1 进入细胞核,抑制AMPK磷酸化[9-10]。在本研究中,我们探讨了CD36 棕榈酰化位点突变激活AMPK 的可能机制。与WT-CD36-HepG2 细胞相比,AA-SS-HepG2 细胞 CD36/Fyn 蛋白共聚体显著减少,p-LKB1/LKB1 的明显降低,表明CD36 棕榈酰化位点突变可能通过抑制LKB1 的磷酸化促进AMPK的活化。
综上所述,CD36的棕榈酰化位点突变可通过减少CD36/Fyn 蛋白共聚体的产生,抑制LKB1 的磷酸化,从而激活AMPK,促进TFEB 核转位,最终引起HepG2细胞自噬增加。
