丹参酮ⅡA对ApoE-/-小鼠肝脏脂质沉积及铁死亡相关蛋白表达的影响*
2020-08-04贾连群曹慧敏
吴 瑶, 宋 囡, 贾连群, 王 杰, 陈 丝, 曹慧敏
(辽宁中医药大学中医药创新工程技术中心,辽宁沈阳110847)
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病前期的主要病理基础,其基本病理改变皆因脂质代谢障碍或转运异常所引起。脂质代谢异常造成的脂类物质沉积于肝细胞内是导致AS 发生的重要危险因素之一,同时肝脏生产了各种炎症因子来调控全身的炎症反应,而AS 的发生与发展过程又与很多炎细胞及炎症因子参与密切相关。因此,肝脏是AS 及其相关疾病启动和发展中最易受损的器官之一,肝细胞内脂质沉积以及胆固等流出障碍等亦成为AS 形成与发展的重要因素。研究发现,铁死亡(ferroptosis)是一种区别于细胞凋亡、自噬及焦亡的全新细胞死亡方式,其主要特点是铁离子大量沉积而致活性氧簇(reactive oxygen species,ROS)大量产生,氧化应激激活状态下的脂质过氧化反应致使细胞大量死亡[1]。目前,铁死亡在缺血再灌注损伤、动脉粥样硬化、肿瘤、神经系统疾病等疾病中均发挥重要作用[2]。
丹参酮ⅡA(tanshinone ⅡA)来源于我国的传统中药丹参,具有抑制炎症反应、抗动脉粥样硬化、降低氧化应激损伤、减少肝脏脂质沉积等作用[3-5]。本课题组前期研究发现,丹参酮ⅡA 通过降低ROS 和丙二醛(malondialdehyde,MDA)的产生、增强总超氧化物歧化酶(total superoxide dismutase,T-SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性来减轻氧化应激,从而抑制肝细胞凋亡,减轻肝脏脂肪变性[6]。那么丹参酮ⅡA 抑制肝脏脂质过氧化的产生且保护肝脏细胞免受ROS损伤的作用有可能是通过拮抗肝细胞发生铁死亡实现的。因此,本研究以载脂蛋白E 基因敲除(apolipoprotein E gene knockout,ApoE-/-)小鼠为 AS 动物模型,以细胞铁死亡为切入点,探讨丹参酮ⅡA 对ApoE-/-小鼠肝脏脂质沉积的影响及作用机制,为中医药的临床应用提供科学实验依据。
材 料 和 方 法
1 动物
实验所用ApoE-/-小鼠和C57BL/6J品系小鼠均为雄性,8周龄,体质量(20±2)g,均购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2012-0001。动物饲养于辽宁中医药大学实验动物中心,SPF 级,自由饮食饮水,环境温度为(22±1)℃,湿度50%±5%。
2 主要药品、试剂及仪器
丹参酮ⅡA 购自上海源叶生物科技有限公司(货号S31459,纯度≥95%);辛伐他汀(浙江海正药业股份有限公司)。总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDLC)测定试剂盒(上海科华生物技术有限公司);还原型谷胱甘肽(glutathione,GSH)检测试剂盒购自南京建成生物工程研究所有限公司;ROS 检测试剂盒、I抗稀释液和HE 染色液购自碧云天生物科技有限公司;抗铁蛋白重链1(ferritin heavy chain 1,FTH1)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、p53 和 xCT/SLC7A11 抗 体 购 于 ABclonal Technology。Tanon 5200 化学发光成像系统(上海天能科技有限公司);7180 型全自动生化分析仪(Hitachi High-Tech);BOND-MAX 全自动免疫组化染色机(Leica Biosystems)。
3 主要方法
3.1 模型制备、分组及干预 将32 只ApoE-/-小鼠随机分为 4 组:模型(model)组、丹参酮ⅡA 高剂量(high-dose tanshinone ⅡA)组、丹参酮ⅡA 低剂量(low-dose tanshinone ⅡA)组及辛伐他汀(simastatin)组,每组8只。8只C57BL/6J小鼠作为正常对照(normal control)组。正常对照组每日给予基础饲料。动脉粥样硬化模型制备采用ApoE-/-小鼠给予高脂饲料喂饲,每日给予高脂饲料(含0.15%胆固醇和21%脂肪)喂饲8 周。造模8 周后灌胃给药,给药剂量按人与动物体表面积折算系数进行换算,丹参酮ⅡA高剂量组、丹参酮ⅡA 低剂量组及辛伐他汀组分别采用60 mg·kg-1·d-1丹参酮ⅡA、30 mg·kg-1·d-1丹参酮ⅡA 和 2.275 mg·kg-1·d-1辛伐他汀灌胃 4 周,正常对照组与模型组给予等体积生理盐水灌胃4周。
3.2 血脂检测 小鼠取材前12 h 内禁食不禁水,取材当天称重,10%水合氯醛麻醉,摘除眼球取血,室温静置后,3 500 r/min 离心25 min,-20℃保存待用。全自动生化分析仪检测小鼠血清TC、TG、LDL-C和HDL-C的含量。
3.3 HE 染色观察肝组织的病理形态 将小鼠肝组织固定于4%多聚甲醛72 h,按HE 染色常规方法进行,70%~100%梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(切片厚度5 μm)、贴片及烤片后,二甲苯脱蜡,70%~100%梯度乙醇复水,苏木精染色,70%盐酸乙醇分色,伊红复染,再用70%~100%梯度乙醇脱水,二甲苯透明,中性树胶封片,石蜡包埋,光学显微镜下观察肝组织形态。
3.4 油红O 染色观察肝脏脂质沉积 取各组肝脏依次放入15%和30%蔗糖中脱水,包埋做成冰冻切片,油红O 染色10 min,75%乙醇分化2 s,苏木素复染2 min,流水冲洗返蓝,甘油明胶封片。
3.5 各组小鼠肝组织ROS 和GSH 含量的检测 取0.1 g 的小鼠肝组织研磨成组织匀浆液,用预冷PBS将其50 倍稀释待用。将100 μL 的待测样品稀释液与0.2 μmol/L 的DCFH-DA 荧光染料等体积混合均匀后,37℃恒温箱避光孵育15 min。用酶标仪在激发波长499 nm 和发射波长525 nm 下检测吸光度(A)。分光光度法检测肝组织中GSH表达。上述检测均按试剂盒说明书操作。
3.6 全自动免疫组化一体机检测小鼠肝脏p53 和GPX4 蛋白的表达 将小鼠肝脏进行石蜡包埋后,以5μm 厚连续切片5 张并标记序号,全自动免疫组化机中将切片分别进行p53 和GPX4 免疫组织化学染色,将染色后的标本进行脱水、封片,在光学显微镜下观察并采集图像,各组标本图像运用Image-Pro Plus 6.0图像分析软件计算平均吸光度。
3.7 Wes 全自动蛋白质印迹定量分析系统检测GPX4、xCT、p53及FTH1蛋白的表达 不同样品上样量均为4.5 μL(包括5× Master Mix 0.9 μL,待检样品与0.1× Sample Buffer合为3.6 μL),95℃、5 min变性。样品制备完全,按照样品、封闭液、I 抗、II 抗、发光液及清洗缓冲液的顺序分别加入板内,机器自检后分别放入毛细管芯及板子,设计板子布局,开始检测,150 min完成检测,进行结果分析。
3.8 RT-qPCR 法检测肝组织相关mRNA 的表达水平 取20 mg 肝组织,采用离心柱法提取总RNA,严格按照试剂盒说明书进行操作,测定浓度,将样本总RNA浓度稀释为200 mg/L后反转录为cDNA,加入扩增反应体系运用RT-qPCR 法扩增,40 个循环结束后采用2-ΔΔCt法进行相对定量分析,检测基因mRNA 相对表达水平。引物由武汉金开瑞生物工程有限公司合成,序列见表1。

表1 RT-qPCR相关引物的序列Table 1.The sequences of the primers for RT-qPCR
4 统计学处理
采用SPSS 19.0 软件进行统计分析。实验数据均为计量资料,用均数±标准差(mean±SD)表示。多组之间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 各组小鼠血脂水平比较
与正常对照组相比,模型组小鼠血清中TG、TC和LDL-C 水平显著升高(P<0.01),HDL-C 水平无显著变化;与模型组相比,辛伐他汀组、丹参酮ⅡA 低剂量组及丹参酮ⅡA 高剂量组小鼠血清中TG、TC 和LDL-C水平显著降低,并且丹参酮ⅡA高剂量组和辛伐他汀组效果优于丹参酮ⅡA 低剂量组(P<0.05 或P<0.01),各组间HDL-C 水平的差异无统计学显著性(P>0.05),见表2。

表2 各组小鼠血清TG、TC、LDL-C和HDL-C含量的比较Table 2.Comparison of the serum lipid levels in the mice from each group(mmol/L.Mean±SD. n=8)
2 各组小鼠肝脏病理学变化
正常对照组肝小叶结构正常,肝细胞为圆形,细胞核居中,胞浆内未见脂滴,排列方式为条索状且肝窦不狭窄;模型组肝细胞体积变大,胞浆内可见大量的脂肪空泡,且大小不等,肝窦狭窄或消失;辛伐他汀组脂滴明显减少,其病理改变较模型组明显减轻,可见到正常的肝细胞,肝窦狭窄程度有所减轻;丹参酮ⅡA 高剂量组恢复程度与辛伐他汀组类似,肝细胞脂肪变性程度减轻,脂肪空泡明显减少,肝窦狭窄有所减轻;丹参酮ⅡA 低剂量组较模型组相比,病理改变有所减轻,肝细胞形态变小,胞浆内脂滴减少,但其治疗效果不如辛伐他汀组和丹参酮ⅡA 高剂量组,见图1。
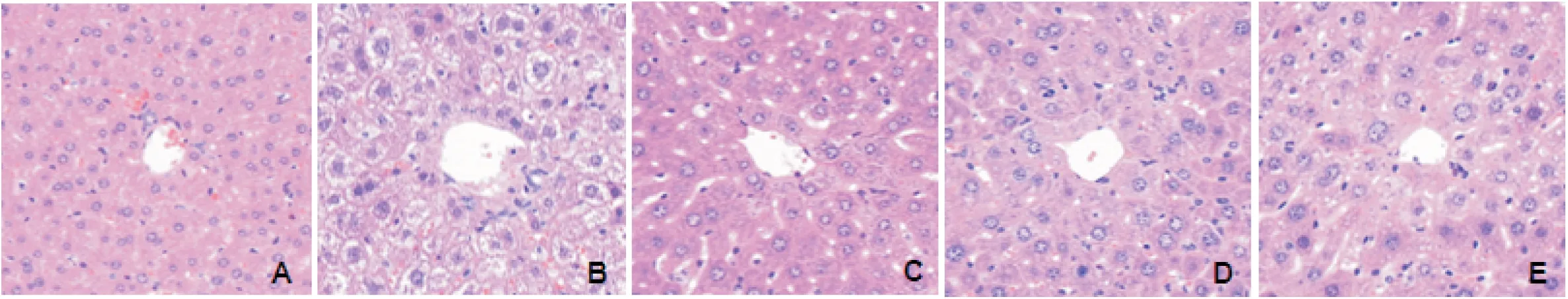
Figure 1.Morphological characteristics of liver tissues in all groups(HE staining,×400).A:normal control group;B:model group;C:simvastatin group;D:low-dose tanshinoneⅡA group;E:high-dose tanshinone ⅡA group.图1 HE染色观察各组肝组织的形态学特点
3 油红O染色结果
正常对照组小鼠肝脏细胞排列规整,肝细胞内未见橘红色脂滴,细胞核为蓝色,肝窦结构正常;模型组小鼠肝脏细胞肿胀明显,肝细胞间隙变宽,视野出现弥漫性橘红色脂滴,细胞核大小不等,脂质蓄积程度明显加重;辛伐他汀组和丹参酮ⅡA 高剂量组肝脏细胞内橘红色脂滴显著减少,细胞核明显变小,肝窦结构有所恢复或恢复正常,脂质蓄积程度显著减轻;丹参酮ⅡA 低剂量组肝脏细胞内橘红色脂滴有所减轻,但相邻肝细胞内脂滴有融合现象,脂质蓄积减轻效果不如辛伐他汀组和丹参酮ⅡA 高剂量组,见图2。
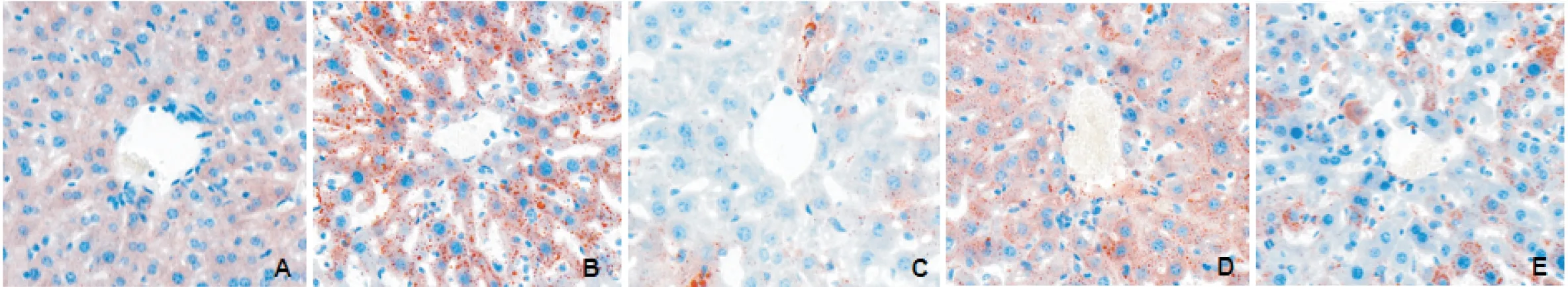
Figure 2.Oil red O staining of liver tissues in all groups(×400).A:normal control group;B:model group;C:simvastatin group;D:low-dose tanshinone ⅡA group;E:high-dose tanshinone ⅡA group.图2 油红O染色观察各组肝组织脂质沉积情况
4 各组小鼠肝组织ROS和GSH含量的比较
与正常对照组相比,模型组小鼠肝组织ROS 含量显著增高(P<0.01),GSH 含量显著降低(P<0.01);与模型组相比,辛伐他汀组、丹参酮ⅡA 低剂量组及丹参酮ⅡA 高剂量组小鼠肝组织ROS 含量显著降低(P<0.01),GSH 含量显著升高(P<0.01);丹参酮ⅡA 高剂量组的作用效果较丹参酮ⅡA 低剂量组更显著(P<0.01),见表3。

表3 各组小鼠肝组织ROS和GSH含量的变化Table 3.The contents of ROS and GSH in the liver tissues of mice in all group(Mean±SD. n=3)
5 免疫组化结果
与正常对照组相比,模型组小鼠肝组织p53 蛋白阳性表达呈现棕黄色颗粒状,染色较深,数量较多,排列密集,肝细胞核被染成蓝色,统计结果表明p53 蛋白阳性表达显著升高(P<0.01);与模型组相比,辛伐他汀组及丹参酮ⅡA 高、低剂量组小鼠肝组织棕黄色较淡,密度下降,排列稀疏,p53蛋白阳性表达显著下降(P<0.01);丹参酮ⅡA 高剂量组治疗效果优于丹参酮ⅡA低剂量组(P<0.01),见图3。
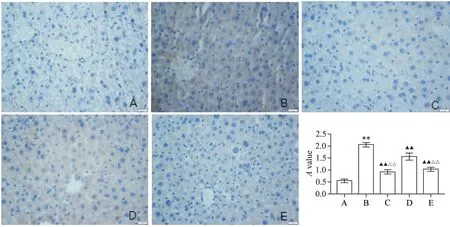
Figure 3.p53 expression in the liver tissues of mice in each group(×400).A:normal control group;B:model group;C:simvastatin group;D:low-dose tanshinone ⅡA group;E:high-dose tanshinone ⅡA group.Mean±SD. n=3.**P<0.01 vs normal control group;▲▲P<0.01 vs model group;△△P<0.01 vs low-dose tanshinone ⅡA group.图3 各组小鼠肝组织中p53的表达情况
正常对照组中GPX4 蛋白阳性免疫产物呈现棕黄色颗粒状或点状标记,数量较多,染色较深,排列密集,细胞核被染成蓝色;与正常对照组相比,模型组小鼠肝组织GPX4 蛋白阳性表达显著降低(P<0.01);与模型组相比,辛伐他汀组及丹参酮ⅡA 高、低剂量组小鼠肝组织GPX4 蛋白阳性表达显著上升(P<0.01);丹参酮ⅡA 高剂量组治疗效果优于丹参酮ⅡA低剂量组(P<0.01),见图4。
6 Wes全自动蛋白质印迹定量分析结果
与正常对照组相比,模型组小鼠肝组织GPX4、xCT 及FTH1 蛋白表达均呈现下降趋势,p53 蛋白表达呈上升趋势(P<0.05 或P<0.01);与模型组相比,辛伐他汀组、丹参酮ⅡA低剂量组和丹参酮ⅡA高剂量组肝组织GPX4、xCT 及FTH1 蛋白表达均呈现上升趋势,p53 蛋白表达呈下降趋势,其中辛伐他汀组促进GPX4、xCT 和FTH1蛋白表达及降低p53蛋白表达的效果均优于丹参酮ⅡA 低剂量组(P<0.01),丹参酮ⅡA高剂量组促进FTH1蛋白表达及降低p53蛋白表达的效果亦优于丹参酮ⅡA 低剂量组(P<0.01),见图5。
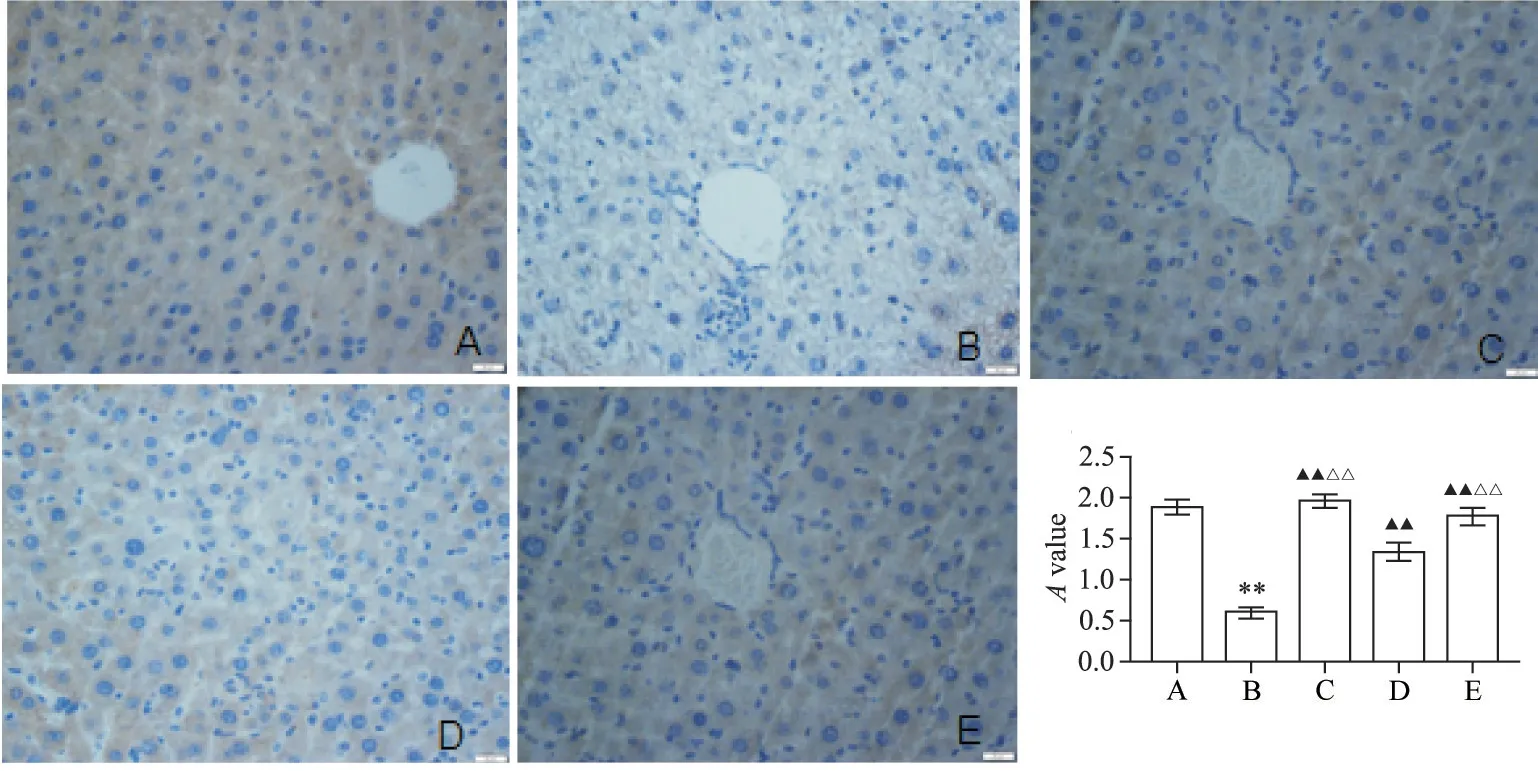
Figure 4.GPX4 expression in liver tissues of mice in each group(×400).A:normal control group;B:model group;C:simvastatin group;D:low-dose tanshinone ⅡA group;E:high-dose tanshinone ⅡA group.Mean±SD. n=3.**P<0.01 vs normal control group;▲▲P<0.01 vs model group;△△P<0.01 vs low-dose tanshinone ⅡA group.图4 各组小鼠肝组织中GPX4的表达情况
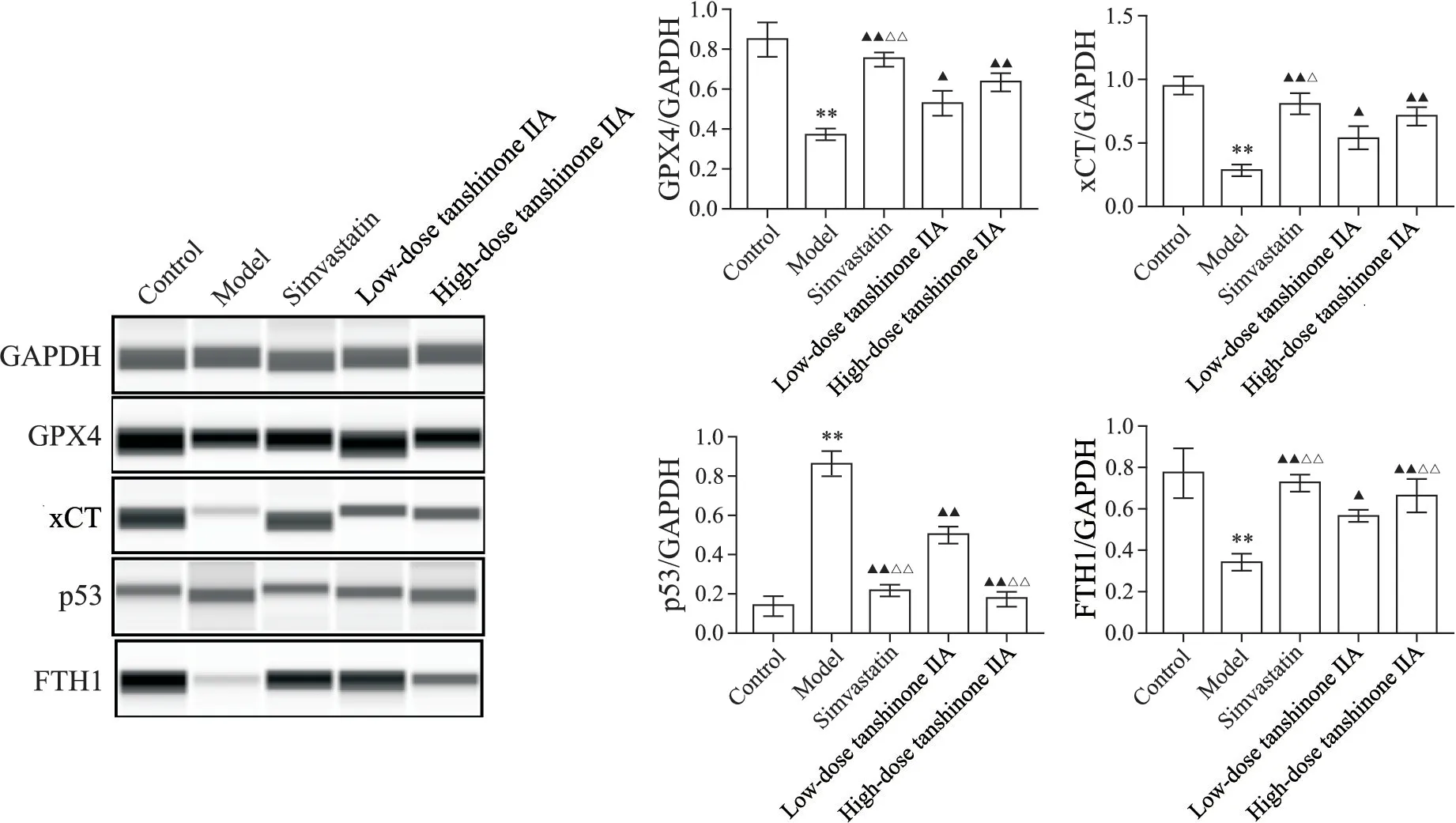
Figure 5.The protein levels of GPX4,xCT,p53 and FTH1 in liver tissues of the mice in each group.Mean±SD. n=3.*P<0.05,**P<0.01 vs normal control group;▲P<0.05,▲▲P<0.01 vs model group;△P<0.05,△△P<0.01 vs low-dose tanshinone ⅡA group.图5 各组小鼠肝组织GPX4、xCT、p53及FTH1蛋白水平
7 RT-qPCR 检测 GPX4、SLC7A11、p53 及 FTH1的mRNA表达
与正常对照组比较,模型组小鼠肝组织GPX4、SLC7A11 和 FTH1 的 mRNA表达显著下降(P<0.01),p53 的mRNA 表达显著上升(P<0.01);与模型组相比,辛伐他汀组及丹参酮ⅡA 高、低剂量组小鼠肝组织 GPX4、SLC7A11 和 FTH1 的 mRNA 表达显著上升(P<0.01,P<0.05),p53的mRNA 表达显著下降(P<0.01),且丹参酮ⅡA 高剂量组的效果高于丹参酮ⅡA低剂量组(P<0.05),见表4。

表4 丹参酮ⅡA对小鼠肝脏GPX4、SLC7A11、p53和FTH1 mRNA表达水平Table 4.Effects of tanshinone ⅡA on the mRNA expression of GPX4,SLC7A11,p53 and FTH1 in the liver tissues of mice(Mean±SD. n=3)
讨 论
随着人们生活水平显著提高,饮食结构也有所改变,在高胆固醇饮食与高强度工作压力等因素下,心血管疾病的发病率逐渐增高,AS 为心血管疾病最主要的死亡因素,对其防治具有重要的意义。中医典籍中并无“动脉粥样硬化”这一病名,但据其不同的临床表现及受累部位,将其分散于“中风”、“眩晕”、“胸痹”、“脉痹”等病症中。窥其致病因素多有脏腑功能失调,气虚血瘀、痰浊、津液运行不畅等。中医理论讲到脾居中焦,主运化水谷精微。《医宗必读》曰:“脾土虚弱,清者难升,浊者难降,留中滞膈,瘀而成痰”。若脾失健运,则清阳不升,浊阴不降。脾为生痰之源,痰浊亦从水谷化生而来,且依赖于脾敷布周身,而后黏滞于血脉,日久瘀阻于脉络,逐渐形成AS[7]。由此可见,脂代谢紊乱是AS 发生发展最重要的危险因素之一[8],因此调控脂代谢平衡即为防治AS主要手段之一。
丹参自古以来便作为活血化瘀的良药,具有祛瘀、凉血、养心除烦等功效,临床中血瘀、疼痛等症大多配伍此药。丹参酮ⅡA 是从丹参中提取的重要活性成分之一,其抗AS、抗心室肥厚、抗氧化、抗心律失常等药理作用都已明确[9]。
课题组前期研究发现,丹参酮ⅡA 具有抗炎、抗氧化的作用,且能够调控血脂水平,减少脂质沉积,采用高脂饲料喂养ApoE-/-小鼠发现,丹参酮ⅡA 能够降低ApoE-/-小鼠肝脏 LDL-R 和 LCAT 的 mRNA 表达,从而减少肝脏脂质沉积[5,10-12]。本实验研究结果显示,模型组ApoE-/-小鼠血清中的TC、TG 和LDL-C水平显著升高,HDL-C 含量并无显著差异;HE 染色显示小鼠肝脏存在大量脂肪空泡,脂肪变性明显。相对于模型组而言,治疗组ApoE-/-小鼠血清中的TC、TG 和LDL-C 水平显著下降,肝细胞脂肪变性程度也明显减轻,提示丹参酮ⅡA 在降低ApoE-/-小鼠血脂水平的同时可减少肝脏脂质沉积。
铁死亡是由GPX4 活性丧失以及脂质ROS 大量累积所致的一种细胞死亡形式,这种由铁依赖的细胞死亡形式在遗传、生化和形态学上均不同于其他细胞死亡模式。2003 年,Dolma 等[13]发现由 erastin致死的RAS 突变的肿瘤细胞,没有细胞核形态学的改变及DNA片段化等。几年后,Yang等[14]研究证实这一过程可被铁螯合剂所抑制,并伴随细胞内脂质过氧化水平的大量增加。近几年研究发现,铁死亡与脂质代谢性疾病密切相关,脂质过氧化反应的发生可能是导致铁死亡发生所必需的条件之一[15]。GPX4 是一种抗氧化酶,作用于底物GSH 后,可将过氧化氢及脂质ROS 分别降解为水和相应的醇,可减少细胞内脂质过氧化的损伤,对细胞能否生存至关重要[16]。GPX4也是铁死亡环节中的关键因子,GSH是GPX4 的主要底物,若GSH 水平下降可导致GPX4丧失活性,GPX4的抑制将导致大量脂质过氧化物聚集进而致使大量ROS 产生,从而导致铁死亡的发生[17]。细胞膜上的转铁蛋白受体可将Fe3+转运进入细胞,多余铁则储存于铁蛋白之中。铁蛋白内含有FTH1 和铁蛋白轻链(ferritin light chain,FTL),可调控储存的铁离子[18]。膜钠离子依赖性胱氨酸/谷氨酸反向转运体(membrane Na+-dependent cysteine/glutamate antiporter,System xC-)是由重链亚基(CD98hc/SLC3A2)和轻链亚基(xCT/SLC7A11)组成的。System xC-可将胞内谷氨酸转移至细胞外,并将胱氨酸转移进来,细胞内的胱氨酸可用于GSH 的合成[19]。在细胞发生铁死亡的过程中p53、GPX4和FTH1均发挥了重要的作用。研究表明,p53 可抑制SLC7A11 的表达,阻止细胞对胱氨酸的摄取,进而降低GSH的合成并促进铁死亡的形成。此外,细胞内p53 的增加可致使细胞内ROS 的大量积累,并触发其诱导脂质过氧化反应,进而加速铁死亡的进程。本研究结果表明,模型组小鼠肝脏 GPX4、SLC7A11、p53 和FTH1的蛋白及mRNA 表达均显著升高,提示细胞铁死亡发生于AS 小鼠模型肝细胞的损伤过程,而引起肝细胞铁死亡发生的一系列相关因子GPX4、SLC7A11、p53 和 FTH1 可能是肝脏 ROS 含量升高、GSH 减少而致肝脏脂质过氧化发生的重要因素。经丹参酮ⅡA治疗后,小鼠肝脏GPX4、SLC7A11、p53 和FTH1 蛋白及mRNA 表达均显著降低,且高剂量比低剂量的效果更好一些,表明丹参酮ⅡA 具有抑制ApoE-/-小鼠肝脏细胞铁死亡的作用。
综上所述,丹参酮ⅡA 可通过拮抗肝细胞铁死亡相关因子进而实现对AS 小鼠肝脏的保护作用,也可降低肝细胞脂质过氧化的发生,从而减轻肝脏脂质沉积。本研究可为临床防治AS 肝脏疾病提供新靶点。
