HET0016对LPS诱导大鼠小胶质细胞增殖和迁移的抑制作用研究*
2020-08-04舒仕瑜
许 燕, 舒仕瑜
(1重庆医科大学附属儿童医院麻醉科,2重庆医科大学附属第二医院麻醉科,重庆400000)
小胶质细胞(microglia)是中枢神经系统内的巨噬细胞,一直以来被认为是大脑中枢神经系统抵御病原入侵的第一道防线[1]。在正常的大脑内,小胶质细胞能不断运动,执行多种功能,例如突触调节、吞噬凋亡的细胞碎片、防御感染等。当组织发生损伤时,小胶质细胞会迁移到损伤部位周围,发挥屏障作用[2]。但是在脑缺血、感染等病理状态下,小胶质细胞可被迅速激活,活化的小胶质细胞将释放多种炎症因子,包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素 1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)等,从而诱导周围细胞损伤。已有研究表明,活化的小胶质细胞在中枢神经系统损伤(如神经退行性疾病[3]、脑出血[4]等)中起着重要的作用。因此,抑制小胶质细胞的活化并减少炎症因子释放,对缓解神经系统损伤炎症反应有重要意义[5]。
花生四烯酸(arachidonic acid,AA)代谢网络调节着机体的细胞分化、增殖、激素分泌、凝血及纤溶系统动态平衡等生理过程。20-羟二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)是AA 的代谢产物,其水平上升对于炎症反应、氧化应激、心血管疾病发生等都有重要意义[6]。HET0016 是 20-HETE合成酶的抑制剂,研究证实HET0016 可减小小鼠脑梗死局灶性缺血的体积,并改善神经功能评分,其机制与增强 Na+-K+-ATP 酶活性有关[7]。此外,有实验证明,HET0016可通过抑制 MMP-9 表达、JNK 通路和氧化应激以激活紧密连接蛋白的表达,从而减轻实验性创伤后脑水肿,发挥保护脑屏障功能[8]。但是HET0016 是否能在调节小胶质细胞增殖和迁移中发挥作用,目前并不清楚。
核因子κB(nuclear factor-κB,NF-κB)是一种快反应因子,以无活性的形式广泛存在于多种组织和细胞中,被激活以后参与基因的转录调控[9]。近年来的研究显示,NF-κB 活化与神经系统疾病如阿尔茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson disease,PD)等[10]的发生有密切的联系。此外,在小胶质细胞中,NF-κB 激活可通过核移位而参与调节炎症因子的基因表达,而阻断NF-κB 所介导的炎症反应很可能是修复中枢神经相关损伤的途径之一[11]。本研究通过分离、培养原代小胶质细胞,观察HET0016 对小胶质细胞活力及迁移的影响,进一步检测小胶质细胞内炎症因子TNF-α 和IL-1β 的表达水平及NF-κB 信号通路中p50 和p65 两种蛋白的表达情况,为探究小胶质细胞炎症反应的机制提供参考资料。
材 料 和 方 法
1 仪器和试剂
HET0016(Sigma);抗 CD11b、p50 和 p65 抗体(Abcam);DMEM/F12 培养液、PBS 和0.25%胰蛋白酶(HyClone);胎牛血清(Gibico);CCK-8 试剂盒(Dojindo);20-HETE ELISA 试剂盒(上海生工);TNF-α 和IL-1β ELISA 试剂盒(北京欣博盛生物科技有限公司)。
2 主要方法
2.1 小胶质细胞的原代培养 取出生24 h 内SD 大鼠放入75%乙醇中进行浸泡消毒,取出小鼠并转移至无菌干净的平皿中,用剪刀剪开颅骨,取出脑组织,剪去脑干后置于D-Hanks 洗液中清洗,去除血污后转移至新的盛有D-Hanks 洗液的无菌培养皿中,仔细去除脑组织表面脑膜和血管(尽量在15 min 内完成)。将剥离完血管膜的组织放入预置有1 mL 解剖液的青霉素小瓶中,用显微剪剪碎(<1 mm×1 mm×1 mm),加入2 滴DNA 酶和1 mL 胰酶(胰酶终浓度为0.125%),于37℃孵箱中孵育15 min。结束后取出小瓶,将液体转移至离心管中,并加5 mL 完全培养液,900×g离心 5 min 弃上清,重悬在 5 mL 无血清培养液中,转移至75 cm2培养瓶中,加入10 mL 完全培养液(37℃预热)。5% CO2、37℃培养箱培养5 d,全量换液,以后每3 d半量换液。
2.2 小胶质细胞的分离纯化 待原代细胞培养到9~14 d 时,细胞充分分层生长,用封口膜封闭培养瓶瓶口,将培养瓶置于37℃恒温振荡摇床上,在160×g下震荡6 h,收集上清至无菌离心管中,400×g离心8 min,弃上清,加入4 mL 无血清培养液轻轻吹打重悬,均匀滴加于24孔培养板的中央4个孔中,于孵箱中培养半小时使小胶质细胞贴壁,取出,吸出上清,再向每个孔加1 mL 培养液,所得细胞可用于细胞纯度鉴定及下一步实验。
2.3 免疫荧光细胞化学染色 取种于载玻片中的小胶质细胞,PBS 洗3 次,每次5 min。加入4%多聚甲醛进行固定,20 min 后用PBS 清洗三次,每次5 min。用0.1%Triton X-100进行破膜处理,一共3次,每次5 min。将载玻片置于湿盒内,加入5%山羊血清,室温封闭30 min。加入抗CD11b 抗体(1∶200)于4℃过夜孵育。将载玻片从湿盒中取出,PBS 洗3 次,每次5 min。加入Goat anti-Rat IgG H&L(1∶1 000)置于湿盒内,室温孵育30 min。用PBS 洗3 次,每次5 min。DAPI(1∶2 000)染核10 min。PBS洗3次,每次5 min,用免疫荧光防淬灭剂封片,晾干后置于荧光显微镜下观察。
2.4 细胞实验分组 取小胶质细胞,分为对照(control)组(培养液+细胞)、脂多糖(lipopolysaccharide,LPS)组(50 μg/L LPS+培养液+细胞)、HET0016 组(1 μmol/L HET0016+培养液+细胞)和LPS+HET0016 组(50 μg/L LPS+1 μmol/L HET0016+培养液+细胞);其中LPS 和HET0016 的处理时间均为24 h,共处理时先用LPS处理24 h,再用HET0016处理24 h。
2.5 流式细胞术检测S 期细胞比例 处理结束后,将小胶质细胞离心收集,用300 μL 含10%胎牛血清的PBS 重悬,转移至新的1.5 mL 的EP 管中,加入0.7 mL 无水乙醇,于4℃固定过夜;次日,将EP 管于500×g离心 1 min 后,加入 1 mL PBS 重悬细胞,再加入400 μL 50 mg/L PI,避光孵育10 min,用流式细胞术分析S期细胞比例。
2.6 CCK-8 法检测细胞活力 将小胶质细胞制备成细胞悬液,以每孔100 μL(含约8 000 个细胞)细胞悬液接种于96 孔板,培养24 h 后,按照实验分组在培养板加入不同浓度的待测物,处理结束后,根据试剂盒说明书进行操作,向每个孔加入CCK-8 工作液(100 μL 培养液+10 μL CCK-8 溶液),于37℃培养箱中孵育2 h 后,用酶标仪测定450 nm 处的吸光度(A)。细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2.7 细胞迁移实验
2.7.1 Transwell 迁移实验 将细胞消化离心后,用完全培养液重悬,进行细胞计数后,将细胞稀释成为1×108/L 的细胞悬液;先向Transwell 板中加入500 μL的完全培养液,将小室放入板中;再向Transwell小室中加入 200 μL 的细胞悬液,将 Transwell 板放入细胞培养箱培养24 h;处理结束后,取出Transwell 小室,吸掉培养液,用PBS 清洗。最后用结晶紫溶液染色10 min,PBS 清洗去除多余染料后,置于显微镜下观察并拍照,计算迁移细胞的数量。
2.7.2 细胞划痕实验 取适量小胶质细胞接种于6孔板中,待细胞长满后,用200 μL吸头垂直于培养板划痕;用PBS 清洗细胞3 次,去除细胞碎片和未贴壁细胞,加入无血清培养液,立刻在显微镜下观察,并拍摄划痕区域图像(即0 h);继续培养24 h 后,再次于同一区域进行观察并拍摄(即24 h)。
2.8 ELISA 法检测 20-HETE、TNF-α 和 IL-1β 的水平 将小胶质细胞接种于6孔板中,每孔约4×105个,并分为对照组、LPS 组、HET0016 组和 LPS+HET0016组,每组设3 个复孔,处理结束后收集细胞上清液进行后续检测。按照20-HETE、TNF-α 和IL-1β 检测试剂盒步骤进行测定,在酶标仪中于490 nm 波长处测定A值。绘制标准曲线,并根据曲线计算对应的浓度。
2.9 Western blot 检测蛋白表达 依次提取各组细胞总蛋白,用BCA 法进行蛋白定量。制备用于SDSPAGE 的凝胶,每孔加入 40 μg 细胞总蛋白,90 V 电泳约30 min 后,调整电压至120 V,电泳至溴酚蓝到达玻璃板底部。取出凝胶,采用湿转法于砖模夹子中210 mA 电泳2 h,蛋白可被转到PDVF 膜上。转膜结束后用5%牛血清白蛋白室温下封闭1 h;TBST 清洗 3 次,每次 5 min;加入 I 抗(抗p50 和p65 抗体均按1∶1 000 稀释),4℃孵育过夜;TBST 清洗3 次,每次5 min;加入II 抗,室温孵育2 h;TBST 清洗 3 次,每次5 min;结束后加入显色剂进行化学发光,在多功能凝胶成像系统下,观察并拍照分析。
3 统计学处理
应用SPSS 17.0 软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,采用单因素方差分析进行组间比较,以P<0.05为差异有统计学意义。
结 果
1 小胶质细胞的培养和纯度鉴定
分离并培养原代小胶质细胞后,显微镜下可见小胶质细胞贴壁生长,单个细胞呈细长或椭圆形,从胞体发出两个或多个突起,胞体形态清晰,生长附着良好,成团情况少见,见图1A、B。进一步用免疫荧光法检测小胶质细胞特异性表面抗原CD11b(呈绿色荧光),用DAPI 标记其胞核(呈蓝色荧光)。结果显示,视野内所见细胞均呈绿色荧光,证实所检测的细胞为CD11b 阳性细胞,即为小胶质细胞,见图1C、D。这说明通过本方法可获得状态良好、纯度较高的小胶质细胞,可用于继续培养并进行下一步实验。
2 HET0016对LPS刺激后小胶质细胞活力的影响
CCK-8 结果显示,与对照组相比,LPS 组小胶质细胞活力显著提高(P<0.01);当 HET0016 浓度为0.5~1.5 μmol/L 时,小胶质细胞的活力显著下降(P<0.05);当应用1 μmol/L 的HET0016处理小胶质细胞24~48 h 时,小胶质细胞活力相比于LPS 组也有所下降(P<0.05),见图2。因此在后续实验中,HET0016处理小胶质细胞的浓度为1 μmol/L,处理时间为24 h。

Figure 2.HET0016 inhibited the viability of microglia induced by LPS.A:the effects of different concentrations of HET0016 on the viability of microglia;B:the viability of microglia after treated with 1 μmol/L HET0016 for different time.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图2 HET0016抑制LPS诱导的小胶质细胞活力
3 HET0016对小胶质细胞上清液20-HETE 水平的影响
ELISA 结果显示,与对照组相比,LPS 组小胶质细胞上清液 20-HETE 水平显著上升(P<0.05),HET0016 处理组20-HETE 水平显著下降(P<0.05);与 LPS 组相比,LPS+HET0016 组 20-HETE 水平显著下降(P<0.05),见图3。
4 HET0016对小胶质细胞S期比例的影响
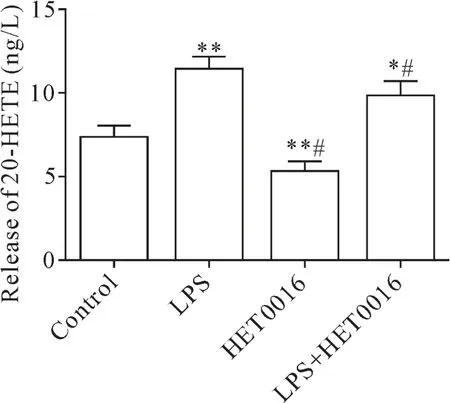
Figure 3.The level of 20-HETE was decreased in the supernatant of microglia after HET0016 treatment.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图3 HET0016下调小胶质细胞上清液20-HETE水平
流式细胞术结果显示,对照组、HET0016组、LPS组和LPS+HET0016 组小胶质细胞S 期比例分别为36.19%、27.37%、43.8%和34.48%;与对照组相比,LPS 处理能够增加 S 期细胞百分比(P<0.05);而与LPS 组相比,LPS+HET0016 组S 期细胞百分比下降,即HET0016 处理能降低S 期细胞百分比(P<0.05),见图4。
5 HET0016对小胶质细胞迁移的影响
Transwell实验结果显示,LPS组穿膜小胶质细胞数量较对照组显著增多(P<0.05);与LPS 组相比,HET0016 组和LPS+HET0016 处理组穿膜细胞数量显著减少(P<0.05),见图5A。细胞划痕实验结果显示,LPS 组划痕缩减面积显著大于对照组(P<0.05);与 LPS 组相比,HET0016 组和 LPS+HET0016 组划痕缩减面积显著减小(P<0.05),见图5B。这2 个实验结果一致,均说明HET0016 能抑制LPS 引起的小胶质细胞迁移。
6 HET0016 对小胶质细胞炎症因子(TNF-α 和IL-1β)释放的影响
ELISA 结果显示,与对照组相比,LPS 组小胶质细胞上清液TNF-α和IL-1β水平显著上升(P<0.05);与 LPS 组相比,HET0016 组和 LPS+HET0016 组小胶质细胞上清液 TNF-α 和 IL-1β 水平显著下降(P<0.05),见图6。
7 HET0016 对小胶质细胞 NF-κB 通路 p50 和 p65蛋白表达的影响
Western blot 结果显示,与对照组比较,LPS 组p50 和p65 蛋白表达水平显著升高(P<0.05);与LPS组相比,HET0016 组和 LPS+HET0016 组 p50 和 p65蛋白表达量显著下降(P<0.05),见图7。
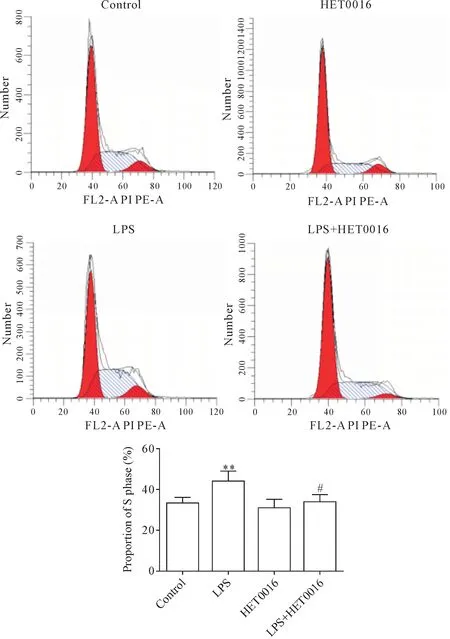
Figure 4.HET0016 decreased the S-phase proportion in microglia induced by LPS.Mean±SD. n=3. *P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图4 HET0016降低LPS诱导的小胶质细胞S期比例
讨 论
小胶质细胞是中枢神经系统主要的免疫细胞,介导中枢神经系统损伤的内源性免疫反应。有研究证实,LPS 可诱导小胶质细胞活化并大量释放NO、TNF-α、IL-6 等炎症因子,导致神经系统出现炎症反应;与此同时,小胶质细胞的大量增殖将使得更多小胶质细胞被活化,从而加重神经系统的损伤[12]。而应用非甾体抗炎药水杨酸甲酯糖苷处理LPS 刺激的小胶质细胞,可抑制小胶质细胞内炎症因子IL-6 的释放,且不同程度地抑制iNOS、COX-1和COX-2蛋白的表达,以缓解小胶质细胞内炎症反应,进而对LPS刺激的小胶质细胞发挥保护作用[13-14]。因此,调控小胶质细胞增殖活化及炎症反应对缓解神经系统的损伤有着重要意义。
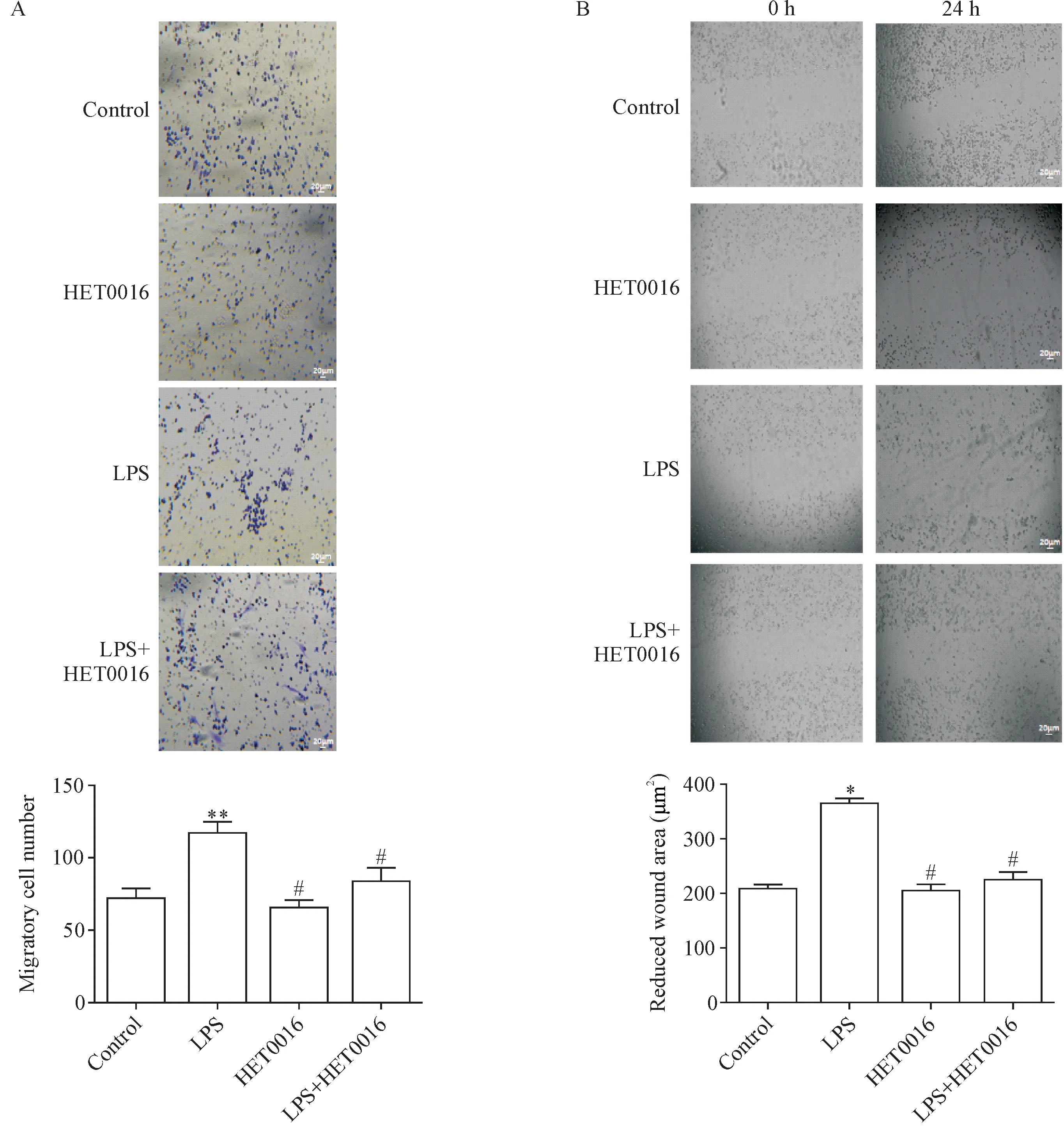
Figure 5.HET0016 inhibited the migration of microglia exposed to LPS.A:results of Transwell assay;B:results of scratch wound healing assay.Scale bar=20 μm.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图5 HET0016抑制LPS诱导的小胶质细胞迁移

Figure 6.HET0016 decreased the levels of TNF-α(A)and IL-1β(B)in the supernatant of microglia.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图6 HET0016下调小胶质细胞上清液TNF-α和IL-1β水平
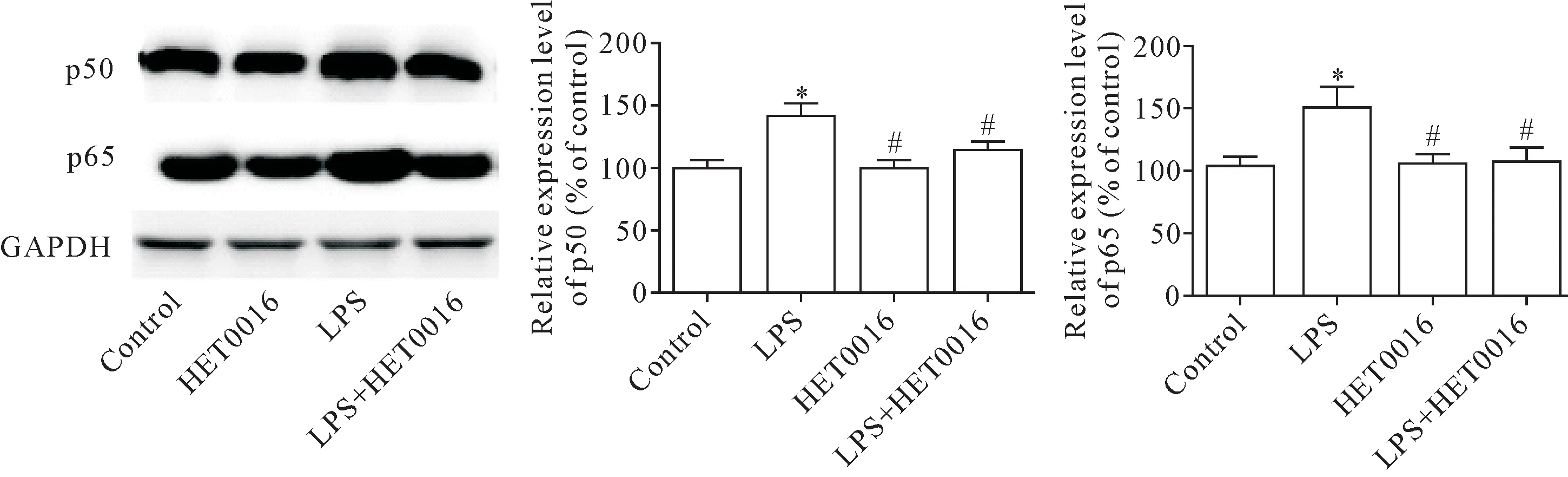
Figure 7.HET0016 decreased the protein expression of p50 and p65 in microglia.Mean±SD. n=3.*P<0.05,**P<0.01 vs control group;#P<0.05 vs LPS group.图7 HET0016下调小胶质细胞p50和p65蛋白表达水平
本实验结果显示,LPS可引起小胶质细胞增殖和迁移能力增强,炎症因子IL-1β 和TNF-α 的水平均有所增加,这与文献报道结果一致[15]。小胶质细胞的增殖和迁移能力增强将导致更多小胶质细胞被活化,释放大量炎症因子,其中,IL-1β 和TNF-α 都被证实参与了神经炎症反应[13]。此外,本研究还检测到LPS 能引起20-HETE 表达增加,而已有研究指出20-HETE的增加不仅与脑梗死的发生相关[16],还可以通过激活NF-κB 促进血管内皮炎症反应[17]。HET0016作为20-HETE 合成的特异性抑制剂,对20-HETE 的抑制效果比17-十八炔酸(17-octadecynoic acid,17-ODYA)和1-氨基苯并三唑(1-aminobenzotriazole,1-ABT)更为明显,因此在很多由于20-HETE 失衡导致的神经系统疾病及心血管疾病中具有潜在价值[18-20]。本研究进一步探究HET0016 在LPS 刺激小胶质细胞中的作用,结果显示,HET0016在有效降低20-HETE水平的同时,不仅抑制了小胶质细胞的增殖和迁移,还减少了LPS 所诱导的细胞内炎症因子IL-1β 和TNF-α的释放。与我们实验结果相似的是,HET0016在其它疾病模型中也发挥了一定作用。有研究证实,HET0016 能抑制缺血/再灌注大鼠模型中的超氧阴离子的产生,减轻脂质过氧化程度,降低血脑屏障通透性,以减轻脑水肿[18]。而在纹状体脑出血小鼠模型中,HET0016 可减少活化小胶质细胞和变性坏死神经元的数量,减小脑损伤体积,从而减轻脑出血后周围神经的损伤[21]。而在本研究中,HET0016 可通过抑制小胶质细胞的活力和迁移能力,减少炎症因子释放,进而减轻小胶质细胞对机体的损伤。
NF-κB 转录因子广泛存在于多种细胞中,激活后参与多种基因的转录调控,在中枢神经系统疾病的发生发展中有重要的意义。有研究显示,雷公藤内酯可抑制小胶质细胞的活化,缓解神经系统损伤,其机制与下调 NF-κB 的表达有关[22]。另外,20-HETE 可通过激活NF-кB 通路,进一步对血管内皮细胞发挥氧化应激和促炎作用,参与心血管疾病的发生发展[23]。由于 NF-κB 以 p65/p50 异源二聚体发挥主要作用,因此本研究检测了p50 和p65 蛋白的表达水平。结果显示,LPS 处理后细胞内p50 和p65 蛋白的表达水平显著上升,而HET0016 处理不仅下调细胞中p50 和p65 蛋白表达水平,且抑制LPS 所引起的p50 和p65 蛋白表达上调。此外,p65/p50 蛋白表达水平增加还见于急性肾损伤模型、食管鳞癌组织等[24-25]。张思思等[26]研究证实,羟基积雪草苷可以有效抑制LPS 刺激的小胶质细胞炎症因子生成,其机制也与抑制 NF-κB 的表达有关,因此 NF-κB 可能是调控小胶质细胞炎症反应的重要途径之一。由于激活的NF-κB 需要转移入核内才能发挥功能,因此尽管HET0016 处理引起的p50 和p65 蛋白表达水平下调可在一定程度上抑制NF-κB 通路的功能,但是其中的机制需要更深入的研究。
综上所述,本研究结果显示HET0016 能抑制LPS刺激的小胶质细胞增殖和迁移能力,减少炎症因子的释放,其发挥作用的途径很可能与NF-κB 通路有关,然而更深入的作用机制有待进一步研究。
