ZVI/Cu双金属活化过硫酸钠降解甲基橙及影响因素的研究*
2020-08-03刘钰龙马国峰
刘钰龙,马国峰,2
(1. 沈阳大学 辽宁省先进材料制备技术重点实验室,沈阳 110044; 2. 沈阳大学 科技创新研究院,沈阳 110044)
0 引 言
ZVI(零价铁)作为一种绿色、廉价的催化剂被广泛应用于去除水中的污染物,但零价铁反应活性低并且在反应过程中生成的铁氧化物会进一步降低其反应活性[2]。尽管零价铁无法对污染物的完全矿化,但其具有将部分有机污染物非生物降解分解为可生物降解的中间体的能力。因此,已经广泛尝试改进零价铁方法以改善零价铁催化剂的反应性[3]。目前已经提出ZVI双金属材料作为增强零价铁的替代物,通过在零价铁表面上沉积过渡金属以达到提高降解有机污染物活性的目的[4]。铜是过渡金属之一,可作为改善零价铁反应性的催化剂[5-9]。过渡金属在ZVI双金属催化剂中去除污染物的两种功能:(1)过渡金属添加剂有助于产生吸附在双金属催化剂上的活化原子氢,并通过形成原电池增强ZVI的氧化;(2)在过渡金属表面上形成的原子氢导致有机污染物的还原性降解的增强[10]。
由于ZVI/Cu双金属具有良好的活化作用,因此其对活化过硫酸盐的机理的研究将对处理偶氮污水等有机废料方面具有重要意义。本研究采用零价铁粉与五水硫酸铜制备ZVI/Cu双金属,并使其活化Na2S2O8对目标有机物甲基橙进行降解,考察各影响因素对ZVI/Cu双金属活化性能的影响,并对比了不同条件下甲基橙的去除率,以期为进一步探索制备ZVI/Cu双金属的最佳活化性能的条件以及其处理有机染料提供理论依据。
1 实 验
1.1 ZVI/Cu双金属的制备
1.1.1 实验试剂
平均粒径为120 μm,铁含量约为98%的ZVI颗粒(天津市恒兴化学试剂制造有限公司,分析纯);硫酸铜(天津博迪化工股份有限公司,分析纯);过硫酸钠(PDS,天津博迪化工股份有限公司,分析纯);甲基橙(国药集团化学试剂有限公司);无水乙醇(天津市富宇精细化工有限公司,分析纯);HCl和NaOH(天津市科密欧试剂有限公司,分析纯)。
1.1.2 实验仪器
60目检验筛;PHS-25 pH计;JJ-1电动搅拌器;坩埚;干燥箱;恒温水浴锅;Lambda750S型紫外-可见分光光度计;X射线衍射(XRD);带有X射线能量色散光谱(EDS)分析仪的日立S-4800扫描电子显微镜(SEM)。
1.2 实验方法
通过置换反应制备ZVI/Cu双金属催化剂,在最佳pH值为4.6的CuSO4水溶液中加入ZVI颗粒得到ZVI/Cu双金属催化剂[11]。在200 mL的CuSO4水溶液中加入10 g的ZVI颗粒(过60目筛)并使用JJ-1电动搅拌器以400 r搅拌30 min,经5 min沉淀后磁铁从上清液中分离出ZVI/Cu双金属,并用去离子水冲洗3次,乙醇冲洗1次,在100 ℃下烘箱中干燥2 h。Cu在ZVI上的沉积在有氧条件下进行,在pH值为4.6下ZVI和Cu的溶解小于ZVI和Cu量的约3%(质量分数),因此,ZVI和Cu的释放在ZVI/Cu双金属催化剂的制备中可忽略不计。
1.3 分析方法
称取50 mg的甲基橙,放入烧杯中加入100 mL蒸馏水搅拌溶解,然后将溶液移到1 000 mL的容量瓶中用蒸馏水定容,此时甲基橙溶液的质量浓度为50 mg/L的。采用Lambda750S型紫外-可见分光光度计,以蒸馏水作为参照,将配制好的甲基橙溶液用紫外-可见分光光度计在200~800 nm波段进行扫描,如图1所示,甲基橙溶液在波长为464 nm处吸光度最大。
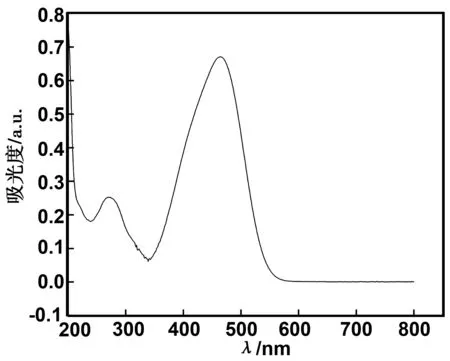
图1 甲基橙溶液紫外/可见光光谱Fig 1 UV-Vis spectrum of MO
取配置好的甲基橙溶液100 mL放入烧杯中,把烧杯置于恒温水浴锅中预热至实验所需温度,根据实验调节溶液pH值、ZVI/Cu双金属添加量、PDS浓度等,在设定的时间点(0~60 min)每隔10 min取样,用紫外-可见分光光度计进行吸光度和波长检测,同一实验重复2次。
2 结果与讨论
2.1 表面形貌表征
图2所示,由日立S-4800扫描电子显微镜(SEM)观察制备的ZVI/Cu双金属颗粒的表面形貌。从图像上可以看到ZVI表面被一层物质所覆盖。

图2 ZVI/Cu双金属的SEM图像Fig 2 SEM image of ZVI/Cu bimetallic
通过X射线能谱(EDS)分析了ZVI/Cu双金属颗粒的表面基本组成,如图3所示, ZVI/Cu双金属颗粒在不同ZVI/Cu 质量比下的EDS能谱,EDS分析表明ZVI/Cu双金属表面元素主要为Fe、Cu、O。图3(a)为ZVI/Cu质量比为10∶1(ZVI颗粒表面理论Cu质量载荷为0.11 g Cu/g ZVI),Fe的质量为69.57%,Cu的质量为13.21%。图3(b)为ZVI/Cu质量比为10∶3(ZVI颗粒表面理论Cu质量载荷为0.41 g Cu/g ZVI),Fe的质量为41.88%,Cu的质量为23.74%,相对于0.11 g Cu/g ZVI来说,Cu的质量上升了将近10%,而Fe的质量下降了接近30%,这说明0.41 g Cu/g ZVI的双金属表面存在着大量的Fe3O4。图3(c)为 ZVI/Cu质量比为10∶6(ZVI颗粒表面理论Cu质量载荷为1.26 g Cu/g ZVI),Fe的质量为12.16%,Cu的质量为69.42%,从SEM图像上可以看出,较0.11 g Cu/g ZVI 和0.41 g Cu/g ZVI相比,表面形貌更加平滑,这可能是由于Cu的含量过多,导致Cu过载沉积在ZVI的表面。从SEM图像中可以看出当理论Cu载荷大于0.41 g Cu/g ZVI时,大量的Cu会从ZVI表面脱落,形成大量细小Cu颗粒。
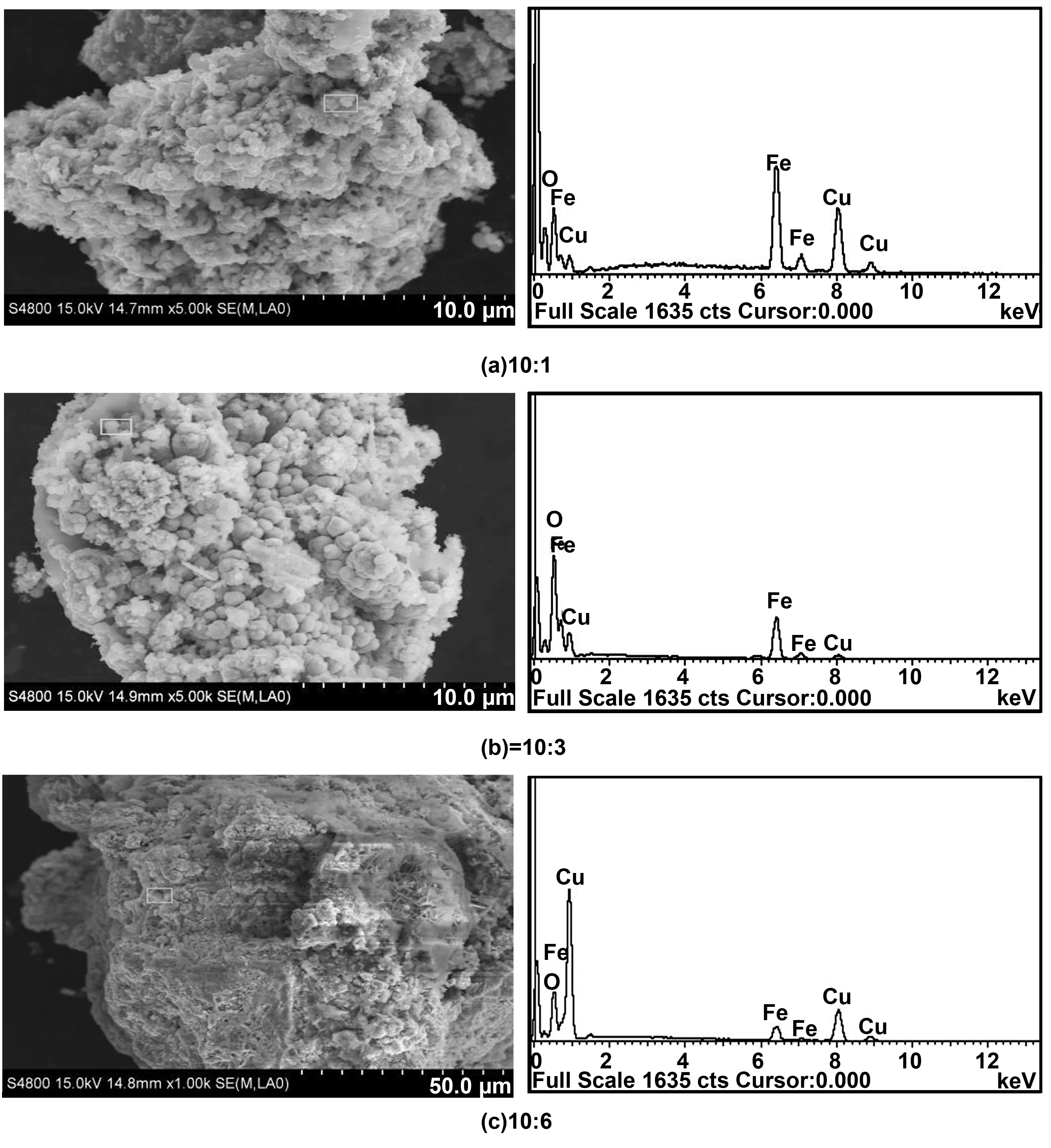
图3 ZVI/Cu双金属在不同ZVI/Cu 质量比下的EDS能谱(ZVI/Cu )Fig 3 EDS energy spectra of ZVI/Cu bimetals at different mass ratios of ZVI/Cu
通过X射线衍射(XRD)进一步分析其化合物组成,如图4所示,ZVI/Cu双金属的XRD图谱。从XRD图谱可以分析得到制备所得的物质主要由Fe、Cu、Fe3O4构成。
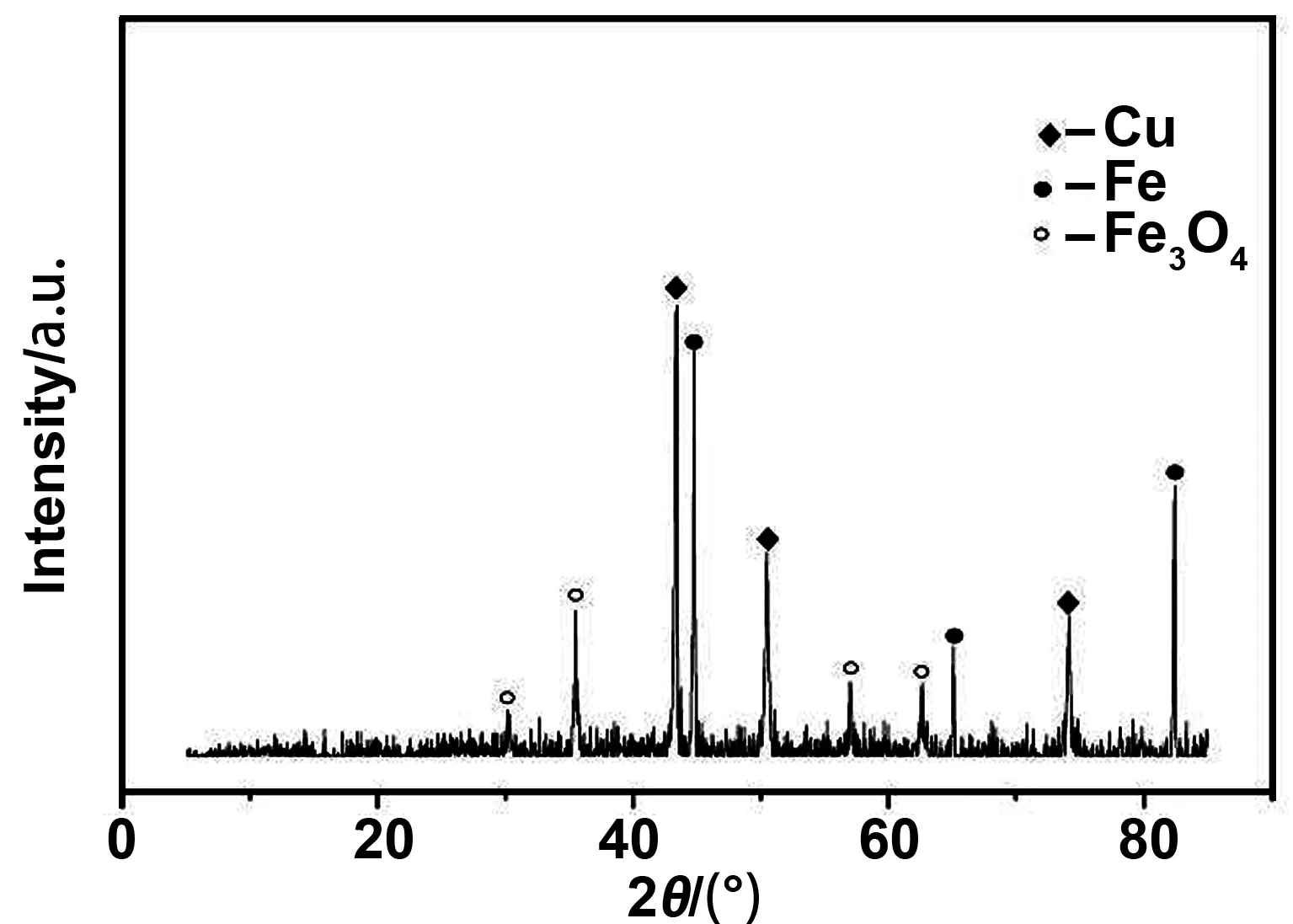
图4 ZVI/Cu双金属的XRD图谱Fig 4 XRD pattern of ZVI/Cu bimetallic catalyst
2.2 活化机制分析
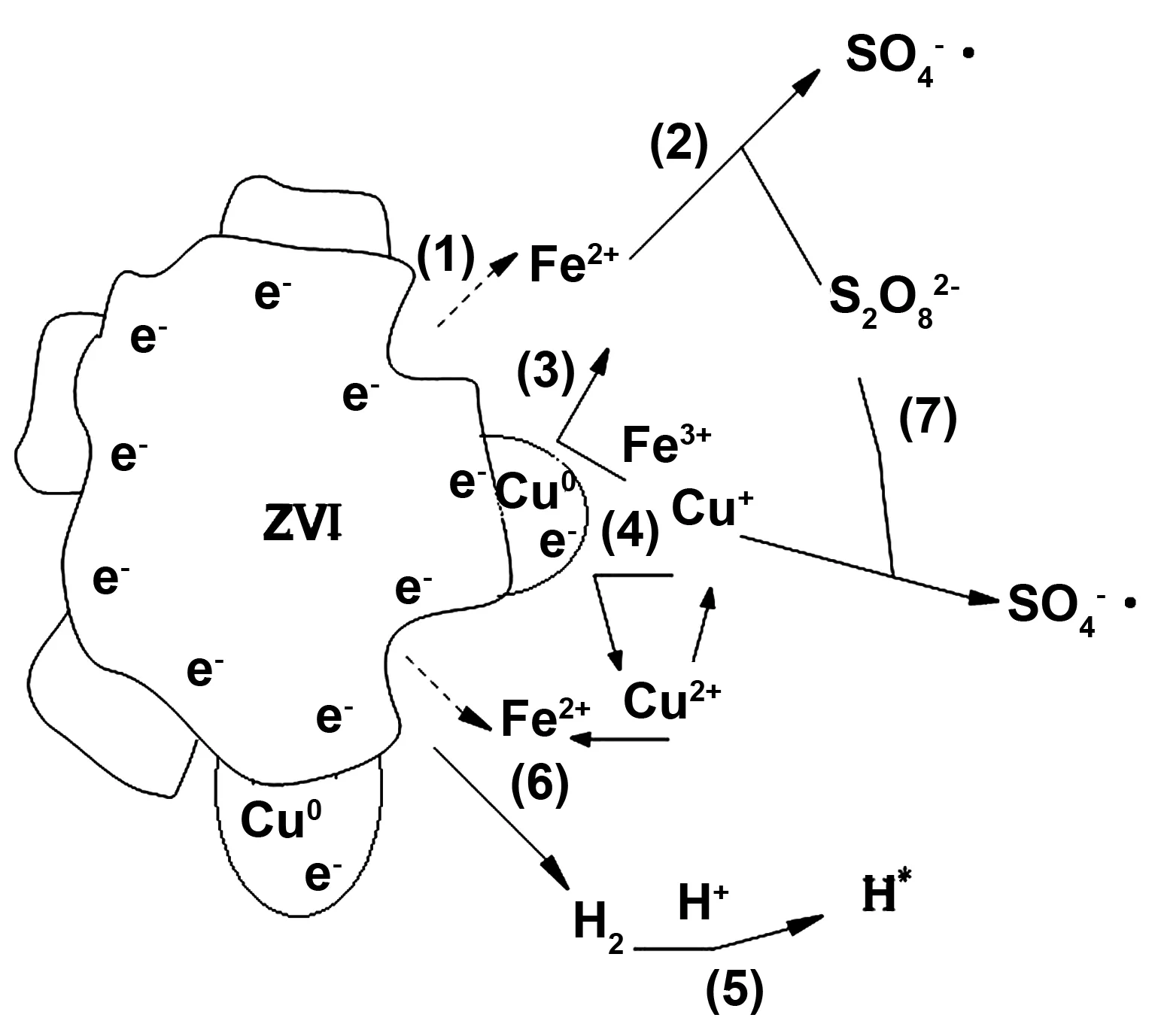
图5 ZVI/Cu双金属生成示意图Fig 5 Schematic model for radical generation by ZVI/Cu bimetallic catalyst
(1)
(2)
2Fe3++ZVI → 3Fe2+
(3)
ZVI+Cu2+→Fe2++ZVI/Cu
(4)
(5)
(6)
(7)
图6可见,60 min ZVI、Cu和ZVI/Cu双金属活化过硫酸钠对甲基橙的去除率分别为63.4%、61%和86.4%。这是由于在ZVI上镀上一层过渡金属Cu有效地提升了ZVI对过硫酸钠的活化能力。Cu有助于产生吸附在双金属催化剂上的活化原子氢,并通过形成原电池增强ZVI的氧化,并在过渡金属表面上形成的原子氢增强了有机污染物的还原性降解的能力。
如果只需要实现简单的AI,那么使用局部最优的策略就可以完成,但要进一步提升胜率,就必须考虑通过四叉树来预判多步之后的情况。不过因为游戏中是随机在空格中生成数字,所以简单的四叉树的遍历效果会大打折扣,故需要考虑风险与收益的情况,从而剪去高风险的枝叶。整个过程是依次递进,总体思路较为清晰,实现不算困难。
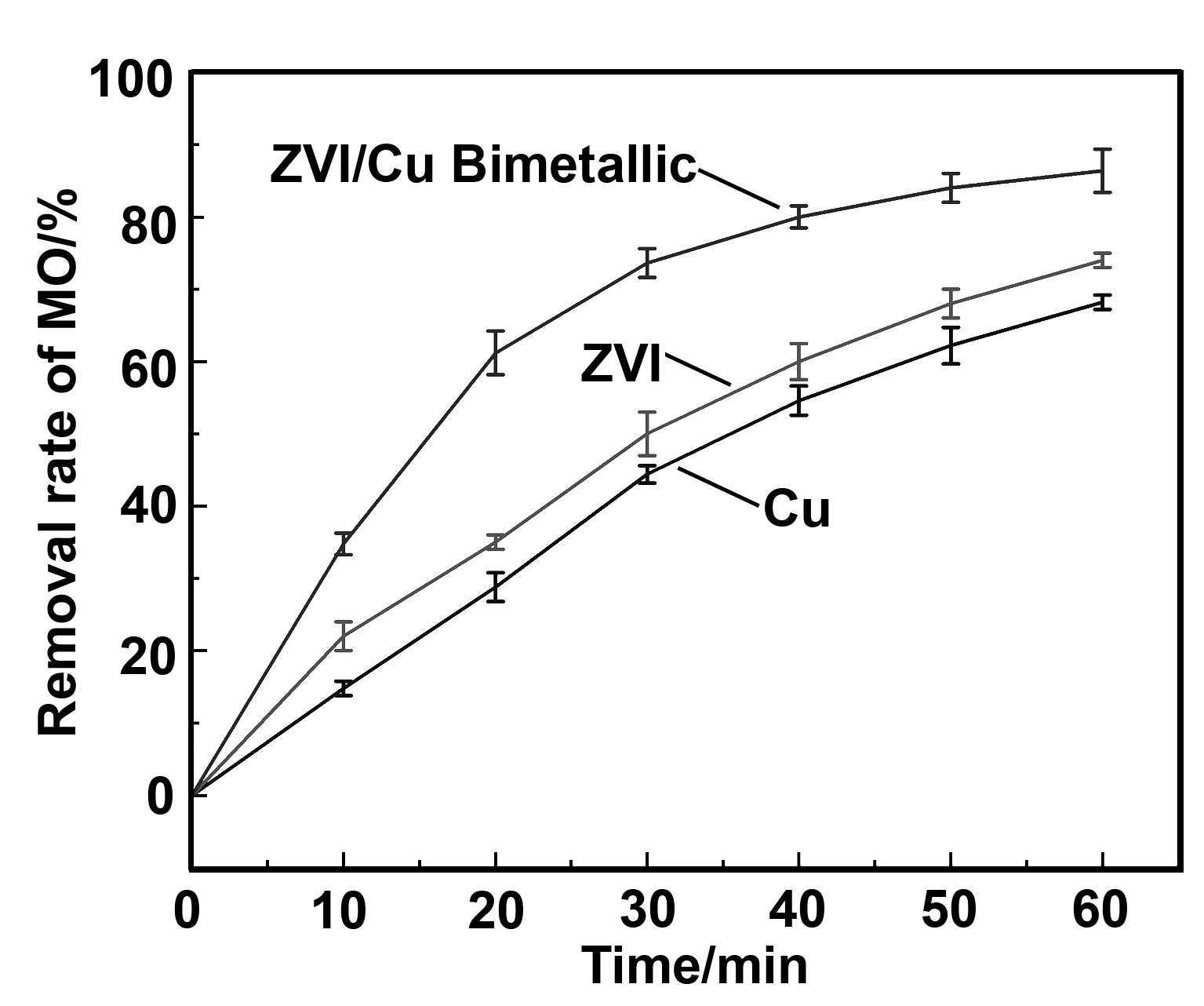
图6 ZVI、Cu和ZVI/Cu双金属空白对比实验Fig 6 Blank contrast experiment of ZVI, Cu and ZVI/Cu bimetallic particles
2.3 Cu质量载荷对降解甲基橙的影响
通过调节CuSO4溶液浓度改变ZVI/Cu双金属Cu质量载荷,以此探究ZVI颗粒表面Cu质量载荷(ZVI∶Cu质量比)对催化活性的影响。分别在不同浓度的200 mL CuSO4溶液(6.25、12.50、25.00、37.50和75.00 g/L)添加10 g ZVI颗粒。表1为不同ZVI∶Cu质量比制备所得的ZVI/Cu双金属粒子参数。
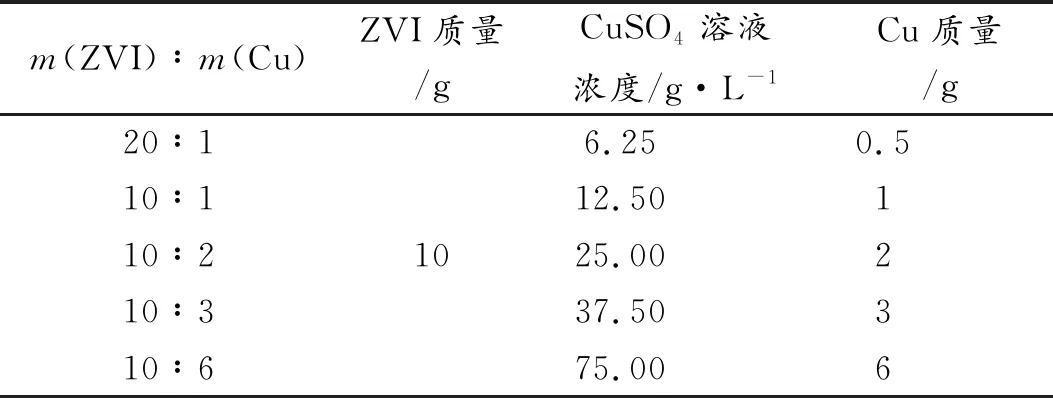
表1 不同ZVI∶Cu质量比制备的ZVI/Cu双金属粒子参数
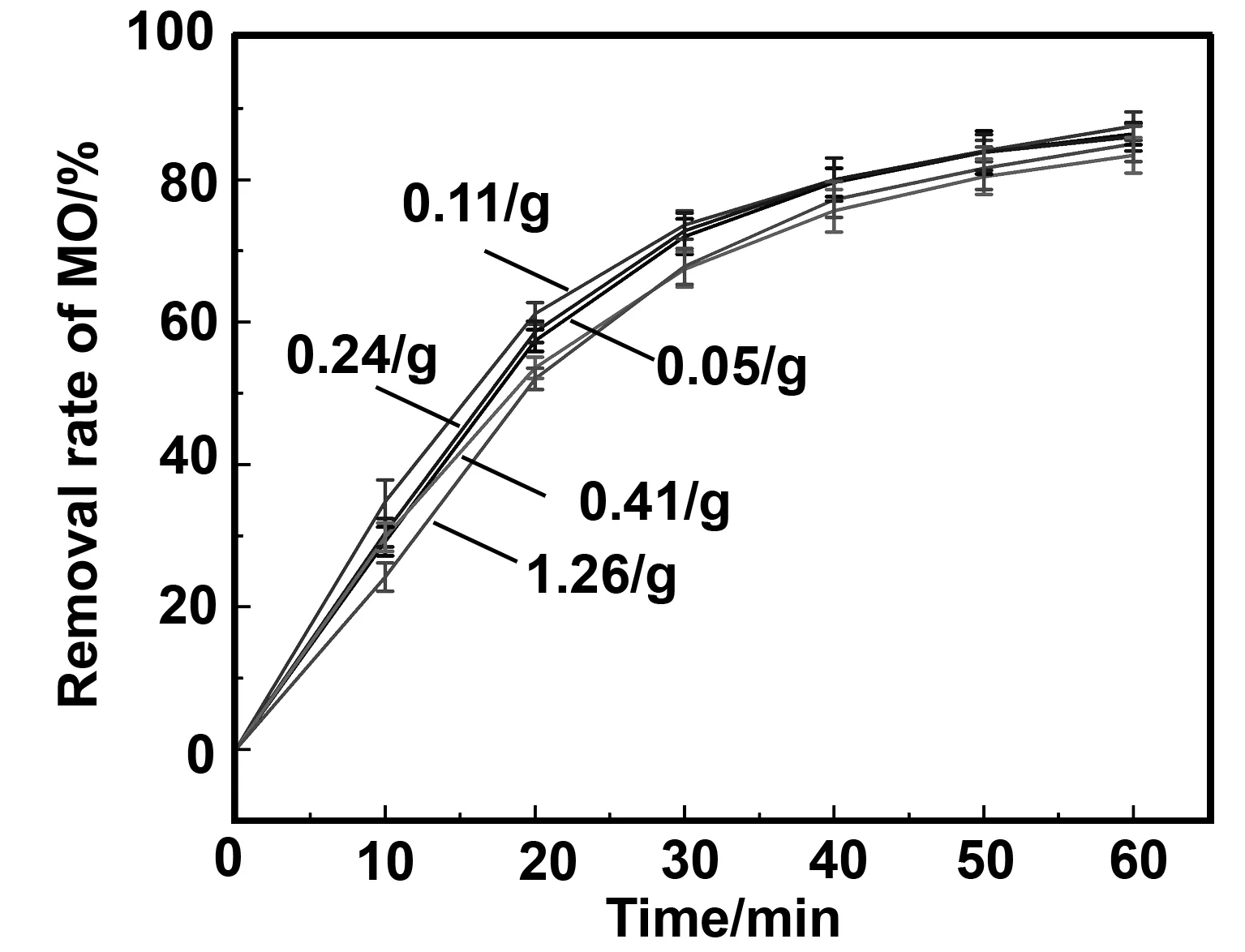
图7 Cu质量载荷(ZVI∶Cu比)对降解甲基橙的影响Fig 7 Effect of Cu mass load (ZVI∶Cu ratio) on degradation of MO
2.4 ZVI/Cu双金属的量对降解甲基橙的影响

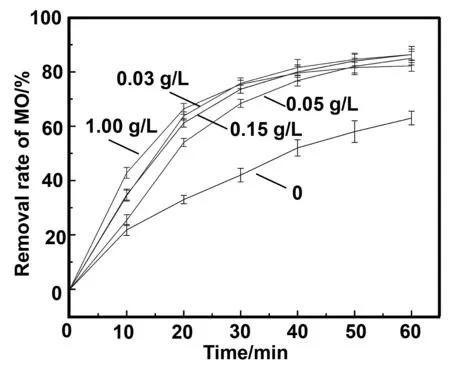
图8 ZVI/Cu双金属的量对降解甲基橙的影响Fig 8 Effect of ZVI/Cu bimetal amount on degradation of MO
2.5 过硫酸钠的浓度对降解甲基橙的影响
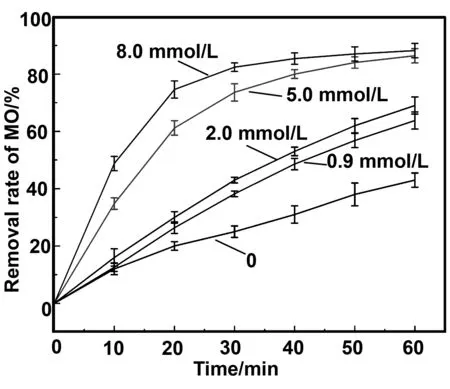
图9 过硫酸钠的浓度对降解甲基橙的影响Fig 9 Effect of PDS concentration on degradation of MO
2.6 pH对降解甲基橙的影响
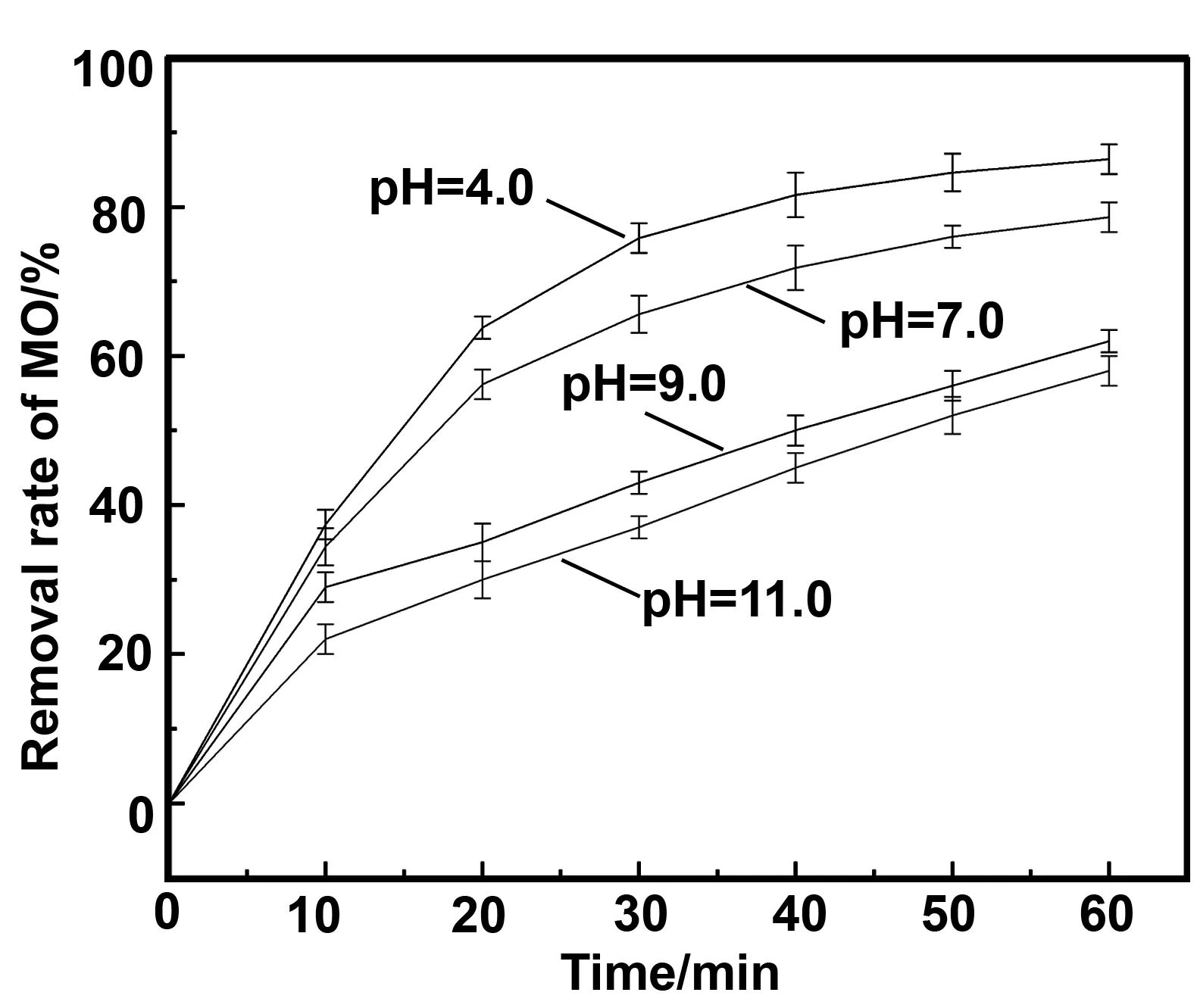
图10 pH对降解甲基橙的影响Fig 10 Effect of pH on degradation of MO
2.7 温度对降解甲基橙的影响
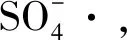
图11 温度对降解甲基橙的影响Fig 11 Effect of temperature on degradation of MO
(8)
dC/dt=-kC
(9)
式中,C为t时刻甲基橙的浓度,mg/L;k为降解速率常数,min-1。拟合曲线如图12所示。
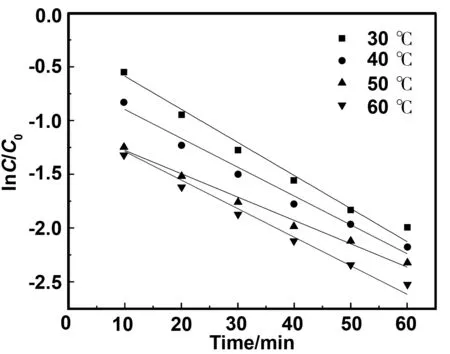
图12 不同温度下甲基橙的一级降解动力学Fig 12 Pseudo-first-order degradation of MO at different temperatures
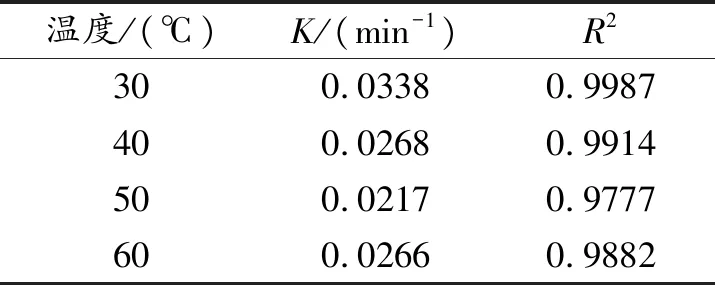
表2 不同温度下降解甲基橙的动力学数据
从上述实验结果中选取最佳条件进行对比,如图13所示,综合来看,Cu质量载荷和温度对降解效率的影响是很大的。在反应进行到20 min时,ZVI/Cu双金属量的速率开始减慢,所以甲基橙去除率最好的时间点为20 min时。前20 min影响最大的是Cu质量载荷,后20 min是温度,由于温度高导致分子运动加快,加快了反应的进行,使降解率提高。通过对比发现前20 min对降解效果的各影响因素的大小关系为Cu质量载荷>PDS的浓度>温度>ZVI/Cu双金属的质量>pH值。20 min后大小关系为温度>Cu质量载荷>PDS的浓度>ZVI/Cu双金属的质量>pH值。
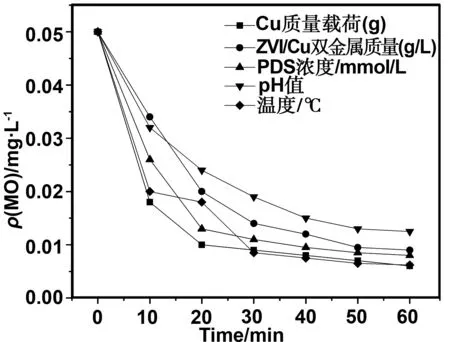
图13 不同影响因素对降解的影响Fig 13 Effects of different influencing factors on degradation
3 结 论
通过在pH值为4.6的CuSO4水溶液中加入ZVI颗粒置换得到ZVI/Cu双金属催化剂。利用制备所得的ZVI/Cu双金属颗粒活化过硫酸钠产生的硫酸根自由基作为氧化剂降解偶氮染料甲基橙。研究了不同因素对目标产物降解效率的影响,结论如下:
(1)ZVI/Cu双金属具有良好的催化活性,通过XRD和SEM表征,发现当ZVI颗粒表面理论Cu质量载荷为0.11 g时,表面形貌更加平滑且Cu沉积更加均匀。ZVI/Cu双金属活化过硫酸钠60 min甲基橙去除率达到80%以上。
(2)ZVI/Cu双金属颗粒的加入量、过硫酸钠的浓度、pH值、温度在反应前20 min内对甲基橙的去除率有较大的影响。ZVI/Cu双金属的加入量在0~0.15 g/L,过硫酸钠的浓度在0~2.0 mmol/L的范围内对甲基橙的去除有着良好的效果,当pH为酸性时是最适宜的反应环境。
(3)实验中甲基橙的降解符合反应动力学,对不同温度下甲基橙的去除进行拟合,结果表明甲基橙的降解过程分为快速和慢速两个阶段,前一阶段反应速度较后一阶段快。
(4)选取最佳条件将不同因素对降解影响进行对比,发现在前20 min对降解效果的各影响因素的大小关系为Cu质量载荷>PDS的浓度>温度>ZVI/Cu双金属的质量>pH值;20 min后大小关系为温度>Cu质量载荷>PDS的浓度>ZVI/Cu双金属的质量>pH值。
