固相萃取结合高效液相色谱-三重四极杆质谱快速分离检测益气养血口服液中人参皂苷的新方法
2020-08-03吴冬雪刘淑莹陈思键赵幻希王淑敏
吴冬雪,刘淑莹,2,陈思键,赵幻希,修 洋*,王淑敏
(1.长春中医药大学 吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,吉林 长春 130022;3.长春中医药大学 药学院,吉林 长春 130117)
人参是著名的中草药之一,其主要化学成分有皂苷、多糖、蛋白质、挥发油、多肽等[1-3]。现代医学与药理研究证明,人参皂苷为人参的主要活性成分[4-9],但人参总皂苷的含量仅占人参干重的4%~5%[10-12],高效的提取、富集、分离、纯化是进一步研究人参皂苷的基础。近年来,人参皂苷的提取方法发展迅速,涌现了超声波辅助提取、微波辅助提取、超高压萃取、CO2超临界流体萃取等新方法[13-16]。然而关于中药复方中人参皂苷快速富集、分离、纯化的研究相对较少,目前仍主要采用传统的柱色谱法、液-液萃取法等[17]。这些方法虽然有效,但溶剂消耗量大、耗时长、易污染环境。高效液相色谱-质谱等高灵敏分析技术在一定程度上缓解了对样品前处理的需求。但分析中药复方口服液等复杂体系中的微量成分时,大量的基质易产生基质效应、污染离子源,堵塞毛细管和色谱柱,不适于高灵敏仪器的高通量直接分析。因此,建立有效富集、分离、纯化的前处理方法仍然是中药分析领域的研究热点。
固相萃取(SPE)技术具有操作简便、回收率高、溶剂消耗量小等优点[13,18-19],是分析复杂体系中待测物的常用前处理方法。吸附剂是SPE技术的关键,直接影响富集、分离、纯化的效果[20]。无机多孔材料通常具有独特的孔道结构、较高的孔体积和比表面积。在有机合成和石油化工等领域,无机多孔材料已作为吸附剂显示出良好的应用前景[21-23]。以无机多孔材料为吸附剂的SPE技术也被用于食品、环境样品的富集和净化研究[24-26]。Wu等[27]利用多壁碳纳米管(MWCNTs)富集水中多环芳烃类化合物(PAHs),气相色谱-质谱分析结果显示MWCNTs可以有效净化水中PAHs。然而,利用无机多孔材料分离纯化中药复方有效成分的研究相对较少。一方面是因为中药复方组成复杂,吸附剂需对待测组分有较高的选择性。另一方面是因为检测中药复方中的微量有效成分时,分析方法需有良好的检出限和回收率。本文通过考察多种无机多孔材料对人参皂苷的吸附活性,建立了一种快速富集、分离中药复方益气养血口服液中人参皂苷的SPE方法,并利用高效液相色谱-三重四极杆质谱(HPLC-QqQ/MS)分析了Re、Rg1、Rb1、Ro 4种主要人参皂苷的含量,为中药复方中微量有效成分的快速分离、检测提供了研究基础。
1 实验部分
1.1 试剂与仪器
人参皂苷Re、Rg1、Rb1、Ro标准品(纯度≥98.0%,上海源叶生物科技有限公司);甲醇、正丁醇、丙酮、乙醇、氯仿(分析纯,北京化工厂);乙腈、甲醇、甲酸(色谱纯,美国Thermo Scientific公司);SAPO-11、SAPO-34、SBA-15、ZSM-5、Y型分子筛(纯度≥97.0%,先丰纳米材料有限公司);MWCNTs(纯度≥97.0%,深圳纳米港有限公司);水系和有机系针式过滤器(0.22 μm,天津津腾实验设备有限公司);超纯水(电阻率18.25 MΩ·cm)由Milli-Q纯水机(美国Merck Millipore公司)制备;益气养血口服液(吉林省银诺克药业有限公司,批号:20181204)。
高效液相色谱-三重四极杆质谱联用仪(Ultimate 3000-TSQ Endura)、Thermo Syncronis C18色谱柱(2.10 mm×100 mm×1.70 μm,均购于美国Thermo Scientific公司);KM-5200DE型超声清洗机(江苏昆山美美超声仪器有限公司);12孔SPE装置、SPE柱(6.00 mL,天津博纳艾杰尔公司);A-1000S型真空泵、MG-2200型氮吹仪(上海爱朗仪器有限公司)。
1.2 实验条件
1.2.1 高效液相色谱条件色谱柱:Thermo Syncronis C18(2.10 mm×100 mm×1.70 μm);流动相:0.10%甲酸水溶液(A)和乙腈(B);流速:0.20 mL/min;进样量:1.00 μL;柱温:35.0 ℃。梯度洗脱:0~8 min,25%~30%B;8~13 min,30%~36%B;13~20 min,36%~48%B;20~32 min,48%~70%B;32~34 min,70%~90%B;34~35 min,90%B;35~37 min,90%~25%B;37~40 min,25%B。
1.2.2 质谱条件电喷雾电离源(ESI),负离子扫描模式,离子源毛细管温度:325 ℃;鞘气压力:241 kPa;辅助气流速:3.30 L/min;吹扫气流速:1.00 L/min;毛细管电压:-2 500 V;采集范围:m/z100~2 000。多反应监测(MRM)模式定性与定量分析人参皂苷Re、Rg1、Rb1、Ro的离子对信息及碰撞能量如表1所示。

表1 4种人参皂苷的离子对信息及碰撞能量Table 1 The ion-pairs and collision energies of four ginsenosides
1.3 实验方法
1.3.1 人参皂苷储备溶液的配制准确称量人参皂苷Re、Rg1、Rb1、Ro标准品,用甲醇(色谱纯)分别配制质量浓度为1.00×103μg/mL的单一标准储备液。将储备液分别稀释至100 μg/mL,用于优化人参皂苷的离子对信息。将储备液按比例混合后稀释至10.0、80.0、100、200、300、500、800 μg/mL,用于建立人参皂苷定量分析的标准曲线。
1.3.2 无机多孔材料分离人参皂苷吸附:取50.0 mg无机多孔材料置于SPE柱中,加入30%甲醇(色谱纯)溶液,充分浸没后打开真空泵,使溶液完全流出SPE柱,再加入5.00 mL人参皂苷标准溶液,静置吸附一段时间后打开真空泵,使溶液完全流出SPE柱。收集流出液,以甲醇(色谱纯)定容,过0.22 μm有机系针式过滤器,HPLC-QqQ/MS分析人参皂苷含量,并计算吸附率。
脱附:取2.00 mL洗脱溶剂加至上述已吸附人参皂苷的多孔材料中,静置一段时间后打开真空泵,使洗脱溶剂流出SPE柱。洗脱液氮吹至干后用甲醇(色谱纯)定容,过0.22 μm有机系针式过滤器,HPLC-QqQ/MS分析人参皂苷含量,并计算回收率。
1.3.3 MWCNTs分离益气养血口服液中的人参皂苷吸附:取50.0 mg MWCNTs置于SPE柱中,以30%甲醇活化,加入1.00 mL益气养血口服液,静置3 min后打开真空泵,收集流出液,以甲醇(色谱纯)定容,过0.22 μm水系针式过滤器,HPLC-QqQ/MS分析人参皂苷含量,并计算吸附率。
脱附:取2.00 mL正丁醇加至吸附人参皂苷的MWCNTs中,静置3 min后打开真空泵,收集流出液,氮吹至干后,以甲醇(色谱纯)定容,过0.22 μm有机系滤膜,HPLC-QqQ/MS分析人参皂苷含量,并计算回收率。
1.3.4 吸附率与回收率的计算多孔材料分离人参皂苷的吸附率(Ar)和回收率(Re)计算公式如下:Ar=(c0-ca)/c0×100%;Re=cd/c0×100%。式中:c0(μg/mL)为人参皂苷吸附溶液的初始质量浓度;ca(μg/mL)为达到吸附平衡后吸附溶液中人参皂苷的质量浓度;cd(μg/mL)为达到脱附平衡后脱附溶液中人参皂苷的质量浓度。
1.4 方法学验证
利用HPLC-QqQ/MS的MRM模式定量分析人参皂苷。以“1.3.1”配制的7个不同质量浓度的人参皂苷标准溶液的色谱峰面积(y)对人参皂苷质量浓度(x)作图,得到4种人参皂苷的标准曲线方程以及线性范围。以MWCNTs能够分离并被HPLC-QqQ/MS检测(S/N≥3)的人参皂苷最低质量浓度为检出限。通过加标回收实验评价方法的准确度:在益气养血口服液中加入100%含量的4种人参皂苷标准品,加标前人参皂苷Re、Rg1、Rb1、Ro的质量浓度分别为26.8、23.6、35.4、12.8 μg/mL,利用MWCNTs富集、分离后,HPLC-QqQ/MS进行检测并计算回收率。所有实验均平行3次,结果取平均值并计算相对标准偏差(RSD)。
2 结果与讨论
2.1 SPE吸附剂的选择
人参皂苷根据皂苷元结构分为原人参二醇(PPD)型、原人参三醇(PPT)型、齐墩果酸(OA)型。种植人参中含量较高的人参皂苷为PPD型Rb1、PPT型Re和Rg1、OA型Ro,含量可达到人参总皂苷的70.0%以上[28]。因此,选择这4种人参皂苷考察6种常见的硅基、碳基、硅铝和磷酸硅铝构成的无机多孔材料(MWCNTs、SAPO-34、SAPO-11、ZSM-5、Y型分子筛、SBA-15)对人参皂苷的吸附活性(见图1)。
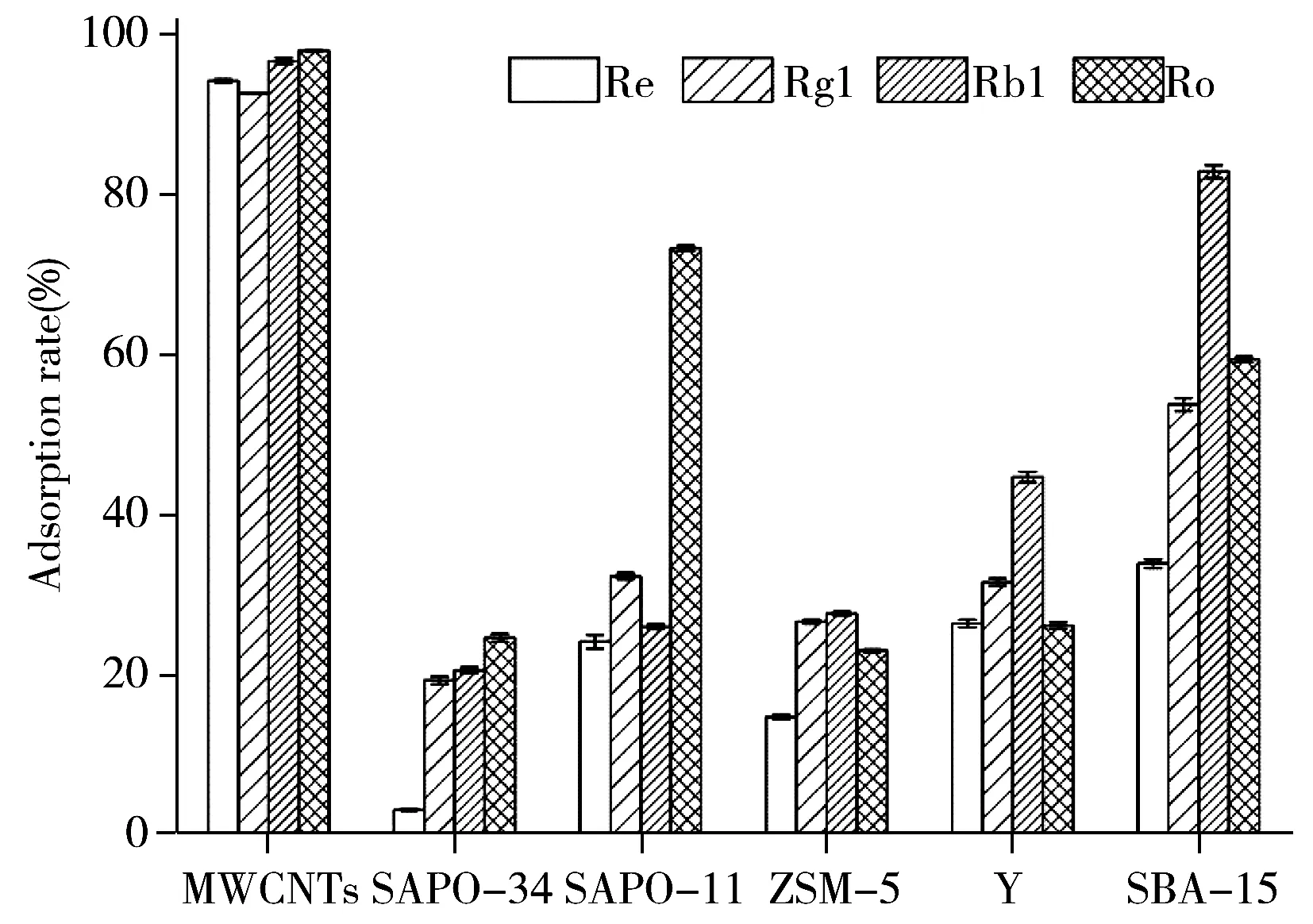
图1 6种无机多孔材料对人参皂苷的吸附率Fig.1 Adsorption rates of six kinds of inorganic porous materials on ginsenoside
结果显示,SAPO-34对4种人参皂苷的吸附率均不足30.0%,这是由于其孔径约为0.43 nm,较小的孔道尺寸不利于人参皂苷分子的吸附。同样为磷酸硅铝分子筛的SAPO-11的孔径约为0.60 nm,略大于SAPO-34,因此其吸附人参皂苷的能力略高于SAPO-34,尤其对Ro的吸附率显著提升,表现出选择性吸附OA型皂苷的潜力。硅铝分子筛Y和ZSM-5对Re、Rg1、Rb1的吸附率与SAPO-11相近,但对Ro的吸附率明显低于SAPO-11。由于Y型分子筛有孔径更大的超笼结构,因此对PPD和PPT型皂苷的吸附能力总体高于SAPO-34、SAPO-11、ZSM-5。SBA-15的介孔孔道使其对人参皂苷的吸附活性更高,且更易于吸附PPD型皂苷,对Rb1的吸附率达到80.0%以上,但对PPT型皂苷的吸附率相对较低。
而MWCNTs的吸附性能明显高于其他5种多孔材料,对4种人参皂苷的吸附率均达到90.0%以上。其中,对Ro的吸附率略高于其他皂苷,对Rg1的吸附率最低,但仍达到90.0%以上。MWCNTs是具有一维孔道的纳米材料,其表面高度离域的大π键易与人参皂苷的四环三萜结构和烯烃链形成非共价相互作用,可将人参皂苷吸附于管壁表面或孔道内部,从而表现出更好的吸附活性。上述结果表明,无机多孔材料对人参皂苷的吸附活性随孔径的增加有一定提高,但孔径尺寸并非决定因素。吸附剂的元素组成和电子构型也是影响吸附活性的重要因素。良好的吸附活性是快速富集、分离待测物的前提。因此本实验选择MWCNTs作为SPE吸附剂。
2.2 分离条件的优化
2.2.1 MWCNTs对人参皂苷的吸附容量首先计算MWCNTs对不同浓度人参皂苷的吸附率,通过拟合曲线计算得到MWCNTs对人参皂苷Re、Rg1、Rb1、Ro的吸附容量分别为31.5、30.1、32.8、34.4 μg/mg。可见,MWCNTs对4种人参皂苷有较高的吸附容量,且不同类型皂苷的吸附容量差异较小,对OA型皂苷的吸附容量略高于PPD和PPT型皂苷。这是因为Ro的2个羰基基团有利于吸收MWCNTs的离域电子,增强了与MWCNTs的非共价相互作用。
2.2.2 MWCNTs用量的影响考察了MWCNTs用量对30 μg/mL人参皂苷溶液吸附率的影响,由图2可知,当MWCNTs用量为10.0 mg时,其对不同类型人参皂苷的吸附率差异较大。随着MWCNTs用量的增加,4种人参皂苷的吸附率逐渐提高,且对不同类型皂苷的吸附率差异明显降低。当MWCNTs用量高于50.0 mg时,4种人参皂苷的吸附率变化不明显,表明已趋于吸附平衡。最终确定MWCNTs的用量为50.0 mg。

图2 MWCNTs用量对人参皂苷吸附率的影响Fig.2 Effects of MWCNTs dosage on the adsorption rates of ginsenosides
2.2.3 吸附溶剂的影响吸附溶剂直接影响人参皂苷在吸附溶液和吸附剂中的分配比例,因此考察了吸附溶剂甲醇体积分数对人参皂苷吸附率的影响(见图3)。结果显示,人参皂苷的吸附率随甲醇体积分数的增加先升高再降低,其中30%甲醇溶液对4种人参皂苷的吸附率最高,100%甲醇不利于吸附PPT型人参皂苷。这是由于MWCNTs具有疏水的表面结构,降低吸附溶剂的极性有利于人参皂苷与吸附剂的充分接触,提高吸附率。PPT型人参皂苷的极性通常强于PPD和OA型皂苷。当甲醇体积分数过大时,PPT型皂苷溶解度的降低程度高于其他皂苷,影响了其与MWCNTs的接触几率,进而导致吸附率降低。Ro结构中含有强极性的羧基基团和弱极性的OA型皂苷元,具有一定的双亲性质,因此甲醇体积分数对Ro吸附率的影响并不明显。实验选择30%甲醇溶液作为吸附溶剂。

图3 甲醇体积分数对人参皂苷吸附率的影响Fig.3 Effects of methanol percentage on the adsorption rates of ginsenosides
2.2.4 脱附溶剂类型的影响分别考察了正丁醇、水饱和正丁醇、丙酮、乙腈、50%乙腈、氯仿、50%甲醇(分析纯)、乙醇、70%乙醇、40%乙醇10种脱附溶剂对人参皂苷回收率的影响,结果显示,以正丁醇为脱附溶剂时,4种人参皂苷的回收率最高,均在90.0%以上,且不同类型皂苷的回收率相近。以水饱和正丁醇脱附时,PPD和PPT型皂苷的回收率可达到75.0%~80.0%,但OA型皂苷Ro的回收率不高于20.0%。乙醇和70%乙醇对PPT型皂苷的回收率同样为75.0%~80.0%,且明显高于PPD和OA型皂苷,表现出选择性脱附PPT型皂苷的能力。其他6种脱附溶剂的脱附能力较差,回收率均未达到60.0%。值得注意的是,除正丁醇外的其他溶剂对OA型皂苷Ro的脱附率均较低,且MWCNTs对Ro的吸附率高于PPT和PPD型皂苷。因此,可以推断MWCNTs与OA型皂苷的非共价相互作用强于PPT和PPD型皂苷,而正丁醇与OA型皂苷的作用力更强,足以将其从MWCNTs中洗脱。因此选择正丁醇作为脱附溶剂。
2.2.5 吸附与脱附平衡时间吸附和脱附平衡的时间是考察吸附剂活性的重要指标,直接影响富集、分离方法的时间成本。MWCNTs对4种人参皂苷的吸附率随时间的变化如图4A所示,吸附30 s时吸附率已达95.0%以上,60 s时吸附率达到98.6%以上,随后逐渐达到平衡。进一步利用正丁醇脱附人参皂苷,回收率随脱附时间的变化如图4B所示,脱附60 s时即达到脱附平衡,4种人参皂苷的回收率均超过95.0%,说明正丁醇是快速洗脱人参皂苷的理想溶剂。结果表明,MWCNTs有较高的人参皂苷吸附容量,可在短时间内达到吸附和脱附平衡,吸附和脱附平衡时间分别为2 min和1 min。

图4 人参皂苷吸附(A)和脱附(B)的平衡时间Fig.4 Adsorption(A) and desorption(B) equilibrium times of ginsenosides
2.2.6 脱附溶剂体积的影响以正丁醇为脱附溶剂,考察了脱附溶剂体积对人参皂苷回收率的影响。结果表明,对50.0 mg吸附人参皂苷至饱和的MWCNTs进行洗脱,当脱附时间一定时,1.00 mL正丁醇能够回收96.8%以上的人参皂苷,2.00 mL正丁醇即可达到脱附平衡。由于正丁醇对4种人参皂苷均有较高的溶解度,因此少量的正丁醇即可有效洗脱人参皂苷,得到较高回收率的同时也降低了溶剂用量。最终确定脱附溶剂体积为2.00 mL。
2.3 益气养血口服液中人参皂苷的快速分离分析
2.3.1 方法学验证结果按照“1.4”进行方法学验证,Re、Rg1、Rb1、Ro的线性关系、检出限、回收率及RSD如表2所示。结果表明,4种人参皂苷在10.0~800 μg/mL范围内线性良好,相关系数(r2)均不低于0.996,检出限为0.01~0.05 μg/mL,平均回收率为90.5%~99.7%,RSD为2.2%~4.9%,表明建立的方法可以快速、准确地分离分析微量的人参皂苷。

表2 4种人参皂苷的线性关系、检出限、回收率及相对标准偏差Table 2 Linear relations,limits of detection,recoveries and relative standard deviations of four ginsenosides
2.3.2 MWCNTs分离益气养血口服液中的人参皂苷益气养血口服液由人参、黄芪、麦冬等14种中药组成,人参皂苷作为其主要的活性成分含量较低。采用本方法对未经MWCNTs吸附的益气养血口服液中人参皂苷进行测定,如图5A所示,糖类等基质对检测产生明显干扰。利用基于MWCNTs的SPE方法快速富集、分离口服液中的皂苷类成分后,检测结果如图5B和C所示。经MWCNTs吸附后的口服液谱图中无皂苷类成分的色谱峰,主要为强极性的糖类成分,脱附溶液的谱图中主要为人参皂苷的色谱峰,表明建立的方法能够选择性吸附人参皂苷,且对糖类等其他成分无明显吸附作用,适用于口服液中人参皂苷的快速富集、分离。进一步利用HPLC-QqQ/MS测定脱附溶液中的人参皂苷,计算得到益气养血口服液中Re、Rg1、Rb1、Ro的质量浓度分别为(27.1±0.01)、(23.4±0.02)、(35.9±0.01)、(13.0±0.02) μg/mL。
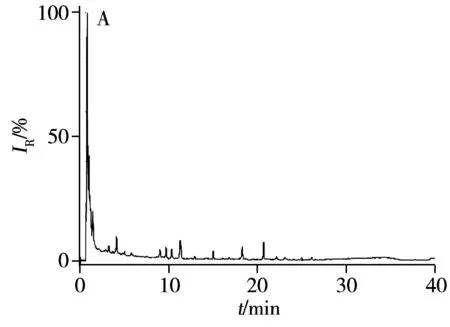
图5 益气养血口服液(A)、MWCNTs吸附后的口服液(B)、脱附的人参皂苷(C)的基峰强度图Fig.5 Base peak intensity chromatograms of Yiqiyangxue oral liquid(A),oral liquid after being adsorbed by MWCNTs(B) and desorbed ginsenosides(C)
3 结 论
本文考察了6种无机多孔材料作为SPE吸附剂富集、分离人参皂苷的活性,与其他5种材料相比,MWCNTs具有更高的吸附容量,可在2 min内分别达到吸附和脱附平衡,且吸附率和回收率分别达到98.6%和96.8%以上。并结合HPLC-QqQ/MS建立了快速分离检测益气养血口服液中Re、Rg1、Rb1和Ro 4种人参皂苷的方法。建立的方法准确度高、检出限低、耗时短、操作简便、节省溶剂,可有效降低益气养血口服液的基质干扰,提高人参皂苷检测的准确度,具有准确分析复杂体系中微量人参皂苷的潜力。
