PTPMT1稳定敲减细胞株的建立及其表型分析
2020-08-03沈金花陈春发
沈金花,陈春发
(中南民族大学 生命科学学院,医学生物研究所&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
CRISPR(clustered, regularly interspaced, short palindromic repeats)系统是细菌降解入侵的外源DNA的一种免疫机制,CRISPR 系统可分为三类:Ⅰ型、Ⅱ型和Ⅲ型[1].在化脓链球菌中发现的Ⅱ型 CRISPR/Cas9系统组分较简单,操作起来较容易,应用最为广泛,是目前研究的热门工具. KARVELIS T等[2]在不影响该系统剪切效率的前提下,将crRNA和tracrRNA合二为一成sgRNA(single guide RNA),在此基础上,由Cas9蛋白和sgRNA 共同组成CRISPR/Cas9系统. CRISPR/Cas9系统应用时先由sgRNA靶向预设的DNA切割位点前的一段序列,Cas9蛋白切割DNA造成DNA双链断裂(DSB, double strand break)[3].DNA损伤后细胞启动DNA修复机制。细胞内的修复机制主要有两种:一是同源介导的DNA修复(HR, homology-directed repair),这种机制可实现例如:基因敲进、基因条件性敲除、基因替换等基因组的精确编辑;二是低保真性的非同源末端连接(NHEJ,non-homologous end joining),该机制在修复过程中非常容易发生DNA上的碱基缺失或插入而造成移码突变,最终该基因不能正常翻译成蛋白达到基因敲除的目的[4-5].
PTPMT1是一种定位于线粒体的蛋白络氨酸磷酸酶,具有调节细胞信号的双特异性蛋白酪氨酸磷酸酶活性[6].它通过琥珀酸脱氢酶的过度磷酸化作为底物在体内起葡萄糖体内平衡的调节作用[7]. PTPMT1的缺陷会影响细胞代谢,这对于干细胞的维持和分化至关重要[8-9].已有研究表明PTPMT1在胰腺β细胞中的下调可增加细胞ATP水平和胰岛素的产生.在癌细胞中,PTPMT1缺失导致细胞死亡的代谢危机[10]. PTPMT1的缺失导致胚胎干细胞的分化阻滞进而导致胚胎发育性停滞和植入后致死[11].以上的研究表明:PTPMT1在细胞能量代谢和细胞增殖等方面有重要作用,然而在非小细胞肺癌中的作用尚不明确.磷酸酶MTMR14的敲减会影响A549细胞细胞的增殖[12],但不知同样是磷酸酶的PTPMT1在A549中减少的是否会影响细胞增殖.基于此,本文利用CRISPR/Cas9系统在A549细胞中敲减基因PTPMT1,进而研究该基因的敲减对A549细胞功能的影响,为进一步探究非小细胞肺癌的致病机理奠定基础.
1 实验材料
1.1 仪器与试剂
Real-Time PCR系统(7500Fast,Applied Biosystems);酶标仪(Infinite200,TECAN);超微量分光光度计(Nanodrop2000,Thermo Fisher Scientific).
人源肺癌细胞A549(Procell);RPMI-1640培养基、胰酶、双抗(HyClone);血清(Sciencell);质粒PX458、Stbl3感受态、Fast DigestBpiI、逆转录试剂盒(Thermo Scientific);10X T4 Ligation Buffer、10X Fast Digest Buffer、Fast AP、T4 PNK、T4连接酶(武汉淼灵生物);10X PCR Buffer(TaKaRa);去内毒素小提试剂盒、凝胶回收试剂盒(世纪康为);anti-PTPMT1、DTT (BIOSHARP);BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶快速配制试剂盒、PMSF、蛋白Marker、羊抗鼠IgG、羊抗兔IgG (碧云天);Lipo-3000、TRIzol Reagent(Invitrogen);SYBR Green(TOYOBO);引物合成和测序(武汉擎科生物).
1.2 基因敲减A549细胞株的构建
1.2.1 选择载体质粒和设计sgRNA序列
在张锋实验室网站上根据基因PTPMT1的外显子序列设计sgRNA,通过系统评分选择6对sgRNA序列(见表1).选择带有荧光标记、抗性筛选标记、插入位点、Cas9序列的PX458作为载体质粒,其序列分析见图1.

表1 PTPTM1 sgRNA序列
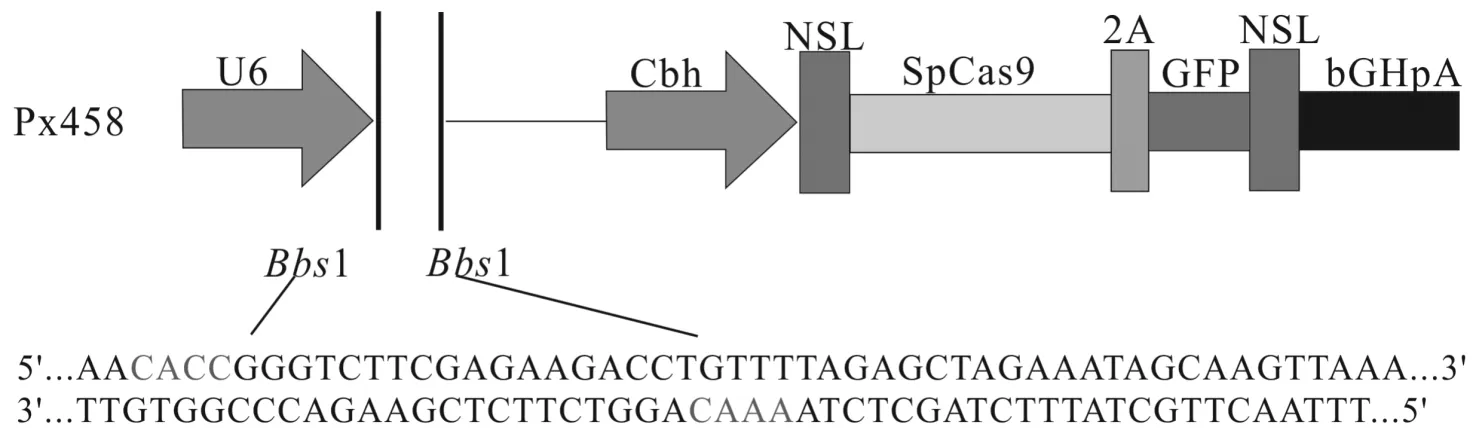
图1 PX458结构分析
1.2.2 PX458-sgRNA表达载体的构建
环形质粒PX458用Fast DigestBbs1酶切,跑琼脂糖凝胶后切胶回收得到酶切开的质粒.在酶切位点插入设计的sgRNA得到重组质粒,将重组质粒转化至stbl3感受态细胞中,涂平板于30 ℃培养箱中培养,次日挑取单菌落后扩大培养摇菌,菌液测序验证sgRNA是否正确地插入到打靶载体上.成功建立PX458-sgRNA表达载体后,摇菌提质粒备用.
1.2.3 细胞转染及流式细胞仪分选
取出1 d前已铺好的6孔板,细胞状态良好且密度达到70%~80%即可进行转染.转染前,将细胞培养液换成无血清的培养液饥饿1 h.转染时,将细胞培养液换回含血清的培养液,配制转染体系A:Opti-MEM,125 μL;重组质粒,2.5 μg;P3000,5 μL.转染体系B:Opti-MEM,125 μL;Lipo-3000,3.75 μL.混合A、B液,均匀滴加到A549细胞中.根据Lipo-3000使用说明按一定比例稀释PX458-sgRNA表达质粒载体,均匀滴加到A549细胞中,培养48 h后收集细胞,通过流式细胞仪将带荧光的细胞分选到96孔板中培养,每个孔一个细胞.
1.2.4 细胞基因敲除情况的鉴定
单克隆细胞扩大培养后,提取基因组通过PCR获得大量基因片段后测序鉴定,通过测序检验基因组的编辑情况.选择有移码突变的细胞株扩培后提蛋白,Western Blotting检测PTPMT1蛋白的表达.将基因组被编辑的细胞系扩培提RNA,用Real-Time PCR检测PTPMT1mRNA的表达.最后选出两株敲减细胞株用以进行后续实验.
1.3 MTT分析
分别接种敲减细胞和野生型细胞1000个/孔于96孔板中,以每孔培养液200 μL培养,每组6个平行孔,连续检测5 d,培养终止前4 h加入MTT,4 h后去除培养基,150 μL DMSO充分溶解结晶紫后设定酶标仪在490 nm检测每组细胞的OD值.
1.4 流式细胞仪分析
收集一个6 cm培养皿的细胞用预冷的PBS洗1次,1800 r·min-1离心5 min后弃去上清,加入1 mL预冷的75%乙醇后将细胞吹散成单细胞,-20 ℃过夜固定细胞.次日以1500 r·min-1离心细胞5 min,留沉淀,PBS洗2次后加入500 μL PI染色液,冰上反应30 min后用流式细胞仪检测细胞周期变化.
1.5 荧光定量PCR
提取PTPMT1敲减细胞和野生型细胞的总RNA,逆转录成cDNA后用 Real-Time PCR检测敲减细胞RNA水平的变化.
1.6 Western Blotting
提取敲减细胞和野生型细胞的总蛋白,测蛋白浓度后于-80 ℃备用.用SDS-聚丙烯酰胺凝胶跑电泳,蛋白上样量80 μg,浓缩胶80 V/40 min,分离胶100 V /1.5 h,然后转膜,200 mA冰上湿转50 min.转膜完成后,用5%的脱脂奶粉封闭1 h,封闭完成后用TBST洗3次,每次10 min,4 ℃孵一抗过夜后用TBST洗膜3次,室温孵1 h二抗后用TBST洗3次即可显影.
1.7 统计分析
采用GraphPad Prism 7、CorelDRAW X4、Microsoft office和FlowJo-V10绘图,T-test检验计算标准差.
2 结果
2.1 PX458-sgRNA表达载体的构建
重组质粒转化到感受态细胞中,涂平板于30 ℃培养箱中培养后挑取单菌落后扩大培养摇菌,菌液测序结果表明:PX458载体分别与6对sgRNA连接.以其中一对sgRNA插入PX458载体为例,结果见图2. 由图2可知:测序结果的峰图为单一、干净的峰,阴影部分为插入的、正确的sgRNA序列载体无突变,敲除表达载体构建成功.

图2 构建敲除表达载体测序结果
2.2 构建PTPMT1基因敲减的A549细胞系
选择肺腺癌中的A549细胞株作为研究对象.将测序正确的PX458-sgRNA表达载体通过脂质体转染A549细胞,经荧光筛选后单克隆细胞培养于96孔板中,转到中皿培养后,提细胞基因组PCR后测序鉴定细胞编辑情况,测序发现改造后的细胞株基因PTPMT1中有不同程度的碱基替换、缺失和插入;接着用Western Blotting检测PTPMT1蛋白的表达量,发现有多株细胞PTPMT1表达量下降,其中sg2-2和sg6-1变化最多,分别减少了70%和80%;用RT-PCR检测PTPMT1mRNA表达量实验结果与WB实验结果相符,结果见图3.由图3可见:细胞株sg2-2和sg6-1这2株细胞的基因均被编辑了,在蛋白层面来看细胞株sg2-2和 sg6-1的PTPMT1明显减少,而且细胞株sg2-2和sg6-1的PTPMT1mRNA表达量也有明显的减少,减少超过2/3认为PTPMT1基因稳定敲减的A549细胞系构建成功.
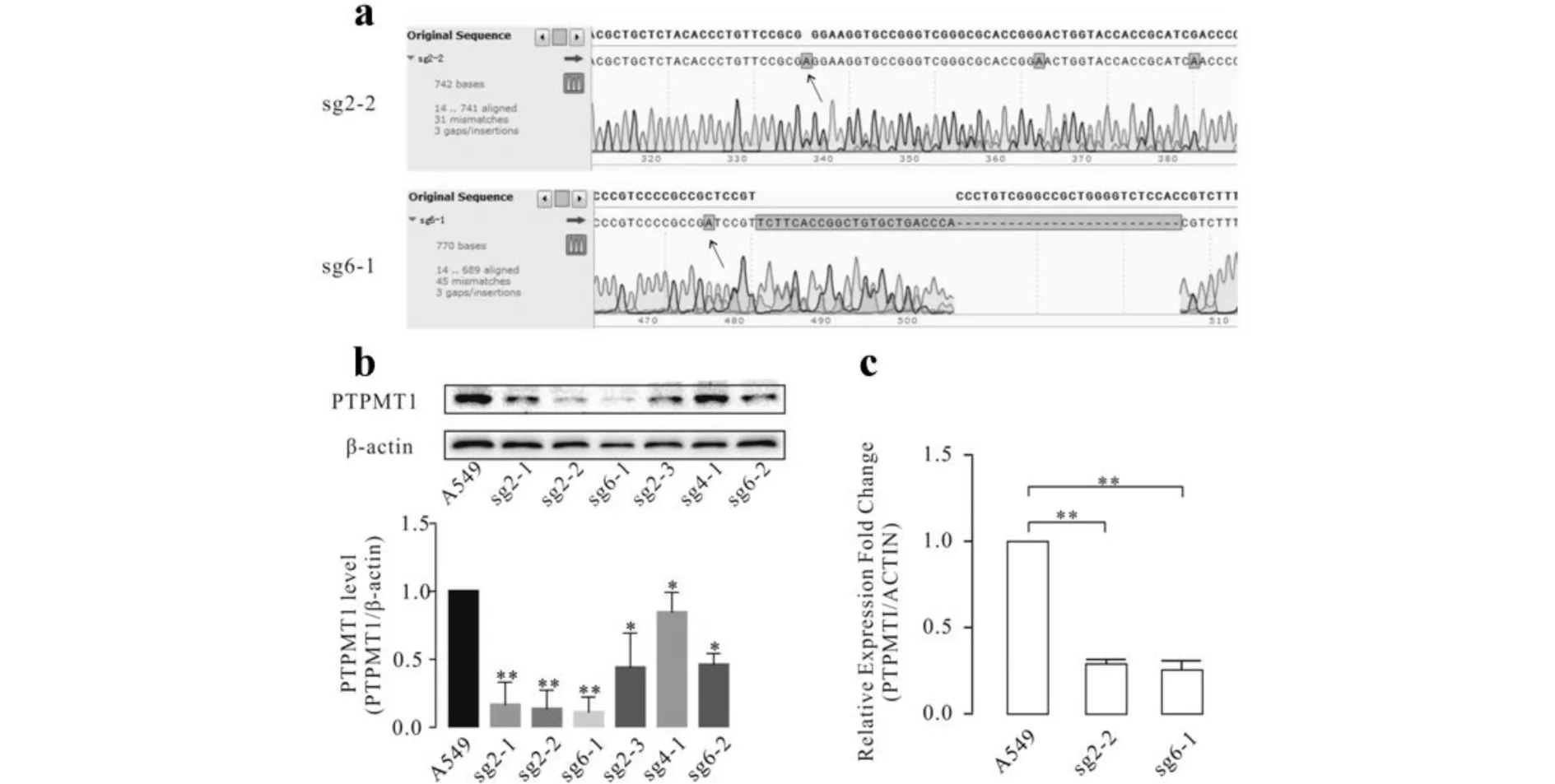
与A549组相比,*P<0.05, ** P<0.01
2.3 PTPMT1 表达量的减少导致A549 的细胞存活率降低
研究表明:在HeLa细胞(人宫颈癌细胞)中PTPMT1的缺失会促进细胞的凋亡[10],猜测PTPMT1的减少也会影响肺癌细胞A549的增殖,进行为期5 d的MTT实验验证.由图4可知:PTPMT1的减少导致A549细胞的存活率降低.
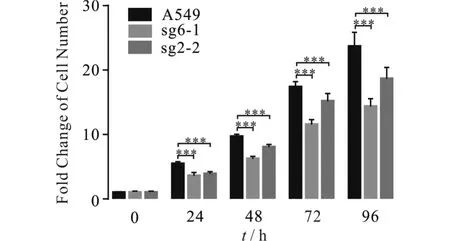
与A549组相比,** P<0.01, *** P<0.001
2.4 A549非同步化细胞周期检测
细胞周期的阻滞密切影响细胞增殖[13-14].用PI染色经流式细胞仪检测探究PTPMT1基因敲减对肺癌细胞A549细胞周期的具体影响.由图5和表2可知:在细胞非同步情况下,野生型和基因敲减的细胞处于G1、G2、S时期的数目无显著性差异故而PTPMT1基因敲减对肺癌细胞A549细胞周期无明显影响.

a) 对照组A549;b) 敲减细胞株sg2-2;c) 敲减细胞株sg6-1
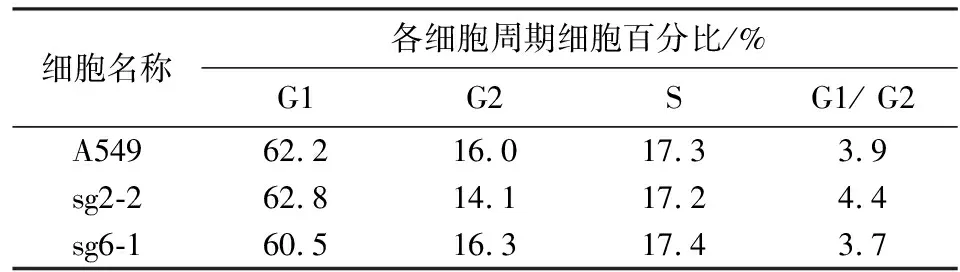
表2 细胞周期流式分析
2.5 荧光定量 PCR 检测细胞周期调控因子转录水平
细胞增殖受细胞周期的影响,而周期调控因子严密调控着细胞周期的进程,选择CyclinD1、CyclinE这两个促进细胞增殖的正调控因子和P21、P27这两个抑制细胞增殖的负调控因子,在mRNA表达水平检测相关周期调控因子的变化.结果见图6.如图6所示,细胞周期负调控因子P27mRNA表达水平显著升高.

与A549组相比,*P<0.05, ** P<0.01, *** P<0.001
3 讨论
PTPMT1是特异性定位于线粒体的双特异性磷酸酶,它锚定在线粒体内膜中,其磷酸酶结构域暴露于基质,使其接近许多负责能量生成和代谢的酶[15].PTPMT1作为哺乳动物磷脂酰甘油磷酸脂(PGP)脂质磷酸酶起作用,催化心磷脂生物合成途径的倒数第二步,可直接影响线粒体的脂质部分[16].心磷脂的稳态扰动与细胞凋亡有关.心磷脂是专门在线粒体内合成和利用,已知该途径的其他关键合成酶锚定在线粒体内膜中,研究表明线粒体膜内的心磷脂与细胞色素c结合,该脂质的氧化对于细胞色素c的释放和随后的线粒体依赖性凋亡所必需[17].已有研究表明PTPMT1缺陷会影响细胞代谢,这对于造血干细胞的维持和分化至关重要[8-9].而在胚胎干细胞中PTPMT1的缺失会导致其死亡[13],在人乳腺癌细胞中,PTPMT1缺失导致细胞死亡的代谢危机[10].
原发性支气管肺癌是最常见的恶性肿瘤之一,近年来全球肺癌的发病率和死亡率一直居高不下并呈上升态势[18].在中国,肺癌一度成为导致人类因癌症死亡的首要疾病[19].非小细胞肺癌约占所有肺癌的80%,许多患者发现患病时已处于中晚期,5年生存率很低,因此更需要深层次、多方面地研究该病的发病机理和潜在的治疗靶点.肺腺癌(lung adenocarcinoma)是肺癌的一种,属于非小细胞癌. A549细胞是腺癌人类肺泡基底上皮细胞,故本文选用A549细胞作为研究对象,研究PTPMT1的减少对A549细胞功能的影响.
本文基于CRISPR/Cas9系统建立了基因PTPMT1稳定敲减的A549细胞株,从DNA、RNA和蛋白三个层面检测了Knockdown细胞系的基因编辑情况,结果显示PTPMT1减少了70%~80%.为研究PTPMT1减少对A549细胞增殖的影响,通过MTT实验记录5 d WT细胞和KD细胞的增殖,结果显示:与WT细胞相比两株KD细胞的增殖被抑制,基因PTPMT1敲减得多一些的sg6-1株细胞生长减缓得更明显.为研究肺癌早期诊断及靶向治疗提供理论基础.进一步研究KD细胞生长减缓的原因,发现在细胞非同步化的条件下,WT细胞相比两株KD细胞各时期细胞的比例基本相当,细胞周期无明显变化,细胞周期负调控因子P27在两株KD细胞中明显上调.
P27是细胞周期的负调控因子,主要通过以下两个途径抑制细胞周期进程:抑制CDK激活和抑制激活后的Cyclin-CDK活性[20].P27对G1期Cyclin-CDK抑制作用最为重要,它能显著抑制Cyclin E-CDK2和Cyclin E-CDK4复合物的活性,使细胞周期停滞于G1期和S期的转换,是G1期限速因子[21].两株KD细胞的细胞周期被部分阻滞在G1期,因此细胞生长速率明显减缓.
综上所述,本文发现:基因PTPMT1的敲减上调了细胞周期调控因子P27,进而导致A549细胞生长明显减缓.说明PTPMT1的减少会导致肺癌A549细胞产生代谢危机,影响其细胞增殖.但PTPMT1敲减影响细胞周期调控因子P27变化的具体机制还需要更进一步研究.
