lncRNA FOXCUT调控FOXC1基因对结直肠癌HCT116细胞增殖、迁移的作用研究
2020-08-03王康康吴慧丽罗金键汪秀梅
王康康, 吴慧丽, 罗金键, 汪秀梅, 张 磊
郑州大学附属郑州中心医院消化内科,河南 郑州 450007
结直肠癌是临床常见消化系统恶性肿瘤之一,病死率高,近年来随着我国人口老龄化加剧及人们饮食结构不断调整,其发病率不断升高[1]。结直肠癌患者临床表现隐秘,确诊时多数患者已至中晚期,预后差,分析主要原因是肿瘤细胞的强侵袭和转移能力所致[2]。近年研究发现,结直肠癌与多基因表观遗传、转录、翻译等多层次异常变化有关,而长链非编码RNA(long-chain non-coding RNA, lncRNA)表达调控与上述变化关系密切,被认为是结直肠癌发生及恶化的关键标志物[3-4]。叉头框C1(forkhead box C1, FOXC1)是插头框转录因子家族重要成员,在细胞分化、胚胎发育及肿瘤发生发展等多种生物学过程中发挥重要作用[5]。已有研究证实,位于FOXC1基因启动子上游的lncRNA转录体FOXCUT(FOXC1 promoter upstream transcript)在乳腺癌、口腔鳞癌等细胞增殖或迁移中起重要作用[6],但关于FOXCUT对结直肠癌细胞增殖、迁移影响及调控机制仍不明确。本研究重点探讨FOXCUT是否能够通过调控FOXC1基因抑制结直肠癌HCT116细胞增殖及迁移能力。
1 材料与方法
1.1 主要试剂和仪器McCoy’s 5A培养基、胎牛血清(美国Hyclone公司),LipofectamineTM2000试剂盒(美国英杰生命技术有限公司),SYBR Premix Dimer Evaser(英国GE Healthcare Systems公司),二喹啉甲酸(diquinolinic acid,BCA)蛋白定量分析试剂盒(美国Thermo Fisher Scientific公司),兔抗人FOXC1、基质金属蛋白酶(matrix metalloproteinases,MMP)2、MMP9、波形蛋白(Vimentin)、E-钙黏蛋白(E-cadherin)单抗(一抗),辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗[艾博抗(上海)贸易有限公司];StepOne Real Time PCR仪(美国Applied Biosystems公司),800TS酶标仪(美国伯腾仪器有限公司),电泳仪、CheniDoc XRS化学发光成像分析系统(美国Bio-rad公司)。南京金斯瑞生物科技有限公司合成的lncRNA FOXCUT siRNA序列:5′-AGAUAAUUGUCUUAGUUCUCCAUCG-3′,siRNA control序列:5′-CGUAGUGCGUAGUGCUAGUG-CGUAG-3′。
1.2 细胞株结直肠癌HCT116细胞系购自上海生科院细胞库。
1.3 方法
1.3.1 细胞培养:结直肠癌HCT116细胞应用含质量浓度为100 g/L胎牛血清的McCoy’s 5A培养基,于37 ℃、体积分数为5% CO2中培养。
1.3.2 细胞转染及分组:倒置显微镜观察细胞增殖至80%~90%时,胰蛋白酶消化、收集HCT116细胞,磷酸盐缓冲液(phosphate buffer, PBS)重悬,调整细胞密度,以1×106个/ml,接种至24孔板,每孔5个复孔,分为空白组、空载组和沉默组,继续培养待细胞增殖至30%~50%。将5 μl lncRNA FOXCUT siRNA(100 pmol)与245 μl无血清培养基混匀,静置5 min备用(A液),将5 μl LipofectamineTM2000与245 μl无血清培养基混匀,静置5 min备用(B液),A、B液混匀,常温静置30 min,37 ℃继续培养48 h。空载组用siRNA control代替lncRNA FOXCUT siRNA同法转染HCT116细胞;空白组不做处理。
1.3.3 qRT-PCR法检测转染后各组细胞lncRNA FOXCUT基因沉默情况:收集培养48 h各组细胞,采用qRT-PCR法检测lncRNA FOXCUT基因表达抑制情况,引物见表1。TRIzol法提取细胞中总RNA,琼脂糖凝胶电泳法鉴定RNA完整性,逆转录法获取cDNA;根据SYBR Premix DimerEvaser体系qRT-PCR实验,dNTP酶10.0 μl,10 μmol/L上下游引物各0.4 μl,cDNA模板2 μl,ROX荧光剂0.4 μl,ddH2O 6.8 μl;反应条件:94 ℃预变性5 min;94 ℃变性10 s,58 ℃退火30 s,72 ℃延伸30 s,重复40个循环。以内参β-actin为管家基因,2-△△CT为目的基因的相对表达强度。
1.3.4 CCK-8法检测细胞增殖能力:收集各组HCT116细胞及空白组细胞,调整细胞密度以1×104个/ml接种于96孔板,每组5个复孔,培养至24、48、72 h时,每100 μl培养液中加入10 μl CCK-8溶液,37 ℃培养2 h后弃去上层培养液,应用酶标仪于450 nm处测定光密度(optical density,A)值。
1.3.5 划痕实验检测细胞迁移能力:收集稳定转染各组HCT116细胞及空白组细胞,调整细胞密度为1×106个/ml,接种至6孔板,每组5个复孔;同条件下继续培养,定期换液,待细胞再次融合,用100 μl无菌吸头于培养板中间垂直划线,移液管吸取培养液轻轻吹洗直线边缘,保证边缘整齐,加入完全培养基继续培养48 h,倒置显微镜下观察拍照,计算细胞迁移率。迁移率(%)=[(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度]×100%。
1.3.6 qRT-PCR法检测FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA表达:收集培养48 h各组细胞,采用qRT-PCR法检测FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA表达情况,RNA提取及扩增方法同1.3.3。以内参β-actin为管家基因,2-△△CT为目的基因的相对表达强度。引物序列见表1。

表1 引物序列
1.3.7 Western blotting法检测FOXC1、MMP2、MMP9、Vimentin、E-cadherin蛋白表达:收集培养48 h各组细胞,加入蛋白裂解液冰上充分裂解20~30 min,提取各组细胞中蛋白质,12 000 r/min离心5 min(离心半径10 cm),取上清液进行十二烷基硫酸钠聚丙烯酰氨凝胶电泳,电转缓冲液中转膜50 min,将蛋白转至硝酸纤维素膜上,将膜放入质量浓度为50 g/L脱脂奶粉封闭液中孵育2 h,洗膜后加入稀释一抗,4 ℃摇床孵育过夜,加入稀释二抗,常温孵育1 h,洗膜后于暗室中曝光显影,于凝胶成像系统扫描成像,应用Image J软件进行灰度值分析,以目的蛋白与内参β-actin灰度值比值表示其相对表达量。

2 结果
2.1 转染后lncRNA FOXCUT基因相对表达量比较
空白组、空载组及沉默组lncRNA FOXCUT基因相对表达量分别为1.05±0.15、0.97±0.14、0.37±0.05,组间比较,差异有统计学意义(F=49.341,P<0.001);沉默组lncRNA FOXCUT基因相对表达量低于空白组和空载组(t=7.449、6.991,P=0.002、0.002);空白组和空载组lncRNA FOXCUT基因相对表达量比较,差异无统计学意义(t=0.675,P=0.536)。
2.2 各组细胞CCK-8实验A值比较细胞CCK-8实验24 hA值组间比较,差异无统计学意义(P>0.05),48、72 hA值组间比较,差异有统计学意义(P均<0.01);沉默组细胞CCK-8实验48、72 hA值均低于空白组和空载组,差异均有统计学意义(沉默组vs空白组t=5.239、7.291,P=0.006、0.002;沉默组vs空载组t=5.135、7.282,P=0.007、0.002);空白组与空载组CCK-8实验48、72 hA值比较,差异均无统计学意义(t=0.040、0.067,P=0.970、0.950)。3组细胞CCK-8实验A值随时间的延长均升高(24 hvs48 h:t=6.838、7.420、3.389,P=0.002、0.002、0.028;24 hvs72 h:t=11.203、12.109、6.803,P=0.000、0.000、0.002;48 hvs72 h:t=4.750、4.720、3.243,P=0.009、0.009、0.032)(见表2)。

表2 各组细胞CCK-8实验A值比较
2.3 各组细胞迁移能力比较空白组、空载组及沉默组48 h细胞迁移率分别为(85.31±5.31)%、(84.78±5.49)%、(40.22±4.67)%,组间比较,差异有统计学意义(F=84.821,P<0.001);沉默组48 h细胞迁移率低于空白组和空载组(t=11.044、11.787,P均<0.001);空白组和空载组48 h细胞迁移率比较,差异无统计学意义(t=0.131,P=0.902)(见图1)。

图1 划痕试验(放大40倍)
2.4 各组细胞FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA表达比较FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA相对表达量组间比较,差异有统计学意义(P均<0.001);沉默组FOXC1、MMP2、MMP9、Vimentin mRNA相对表达量均低于空白组和空载组(沉默组vs空白组t=13.873、10.844、0.958、5.988,P=0.000、0.000、0.001、0.004;沉默组vs空载组t=11.961、10.457、9.731、5.235,P=0.000、0.000、0.001、0.006);沉默组E-cadherin mRNA相对表达量高于空白组和空载组(t=3.911、4.330,P=0.017、0.012),空白组与空载组FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA相对表达量比较,差异均无统计学意义(t=0.326、0.306、0.575、0.188、0.188,P=0.761、0.775、0.596、0.860、0.860)(见表3)。

表3 各组细胞FOXC1、MMP2、MMP9、Vimentin、E-cadherin mRNA表达比较
2.5 各组细胞FOXC1、MMP2、MMP9、Vimentin、E-cadherin蛋白表达比较FOXC1、MMP2、MMP9、Vimentin、E-cadherin蛋白相对表达量组间比较,差异有统计学意义(P均<0.001);沉默组FOXC1、MMP2、MMP9、Vimentin蛋白相对表达量均低于空白组和空载组(沉默组vs空白组t=8.521、8.407、9.393、10.936,P=0.001、0.001、0.001、0.000;沉默组vs空载组t=9.023、7.926、8.141、12.394,P=0.001、0.001、0.001、0.000);沉默组E-cadherin蛋白相对表达量高于空白组和空载组(t=11.295、10.697,P=0.000、0.000),空白组与空载组FOXC1、MMP2、MMP9、Vimentin、E-cadherin蛋白相对表达量比较,差异均无统计学意义(t=0.326、0.408、0.489、0.541、1.039,P=0.761、0.704、0.651、0.617、0.357)(见表4、图2~3)。

图2 Western blotting法检测各蛋白表达

表4 各组细胞FOXC1、MMP2、MMP9、Vimentin、E-cadherin蛋白表达比较
3 讨论
近年来,结直肠癌病死率呈上升趋势,尽管手术及放化疗等综合治疗手段不断进步,结直肠癌治疗成功率有所提高,但仍有部分患者由于病情进展迅速,预后不佳[7-8]。寻找结直肠癌新的治疗靶点有重要临床意义。lncRNA可通过调控微小RNA、修饰组蛋白等多种途径参与肿瘤发生、发展过程,其中lncRNA通过与临近mRNA间相互调控发挥相应功能受到人们重视。既往研究表明,乳腺癌等恶性肿瘤中FOXCUT、FOXC1均处于高表达状态,且两者表达呈正相关[9-10]。FOXCUT是FOXC1启动子上游转录体,序列高度保守且不编码蛋白质,因此探讨FOXCUT通过调控FOXC1对结直肠癌细胞的增殖、迁移能力的影响,对寻找结直肠癌新的治疗靶点有重要意义。
本研究采用RNAi技术沉默结直肠癌HCT116细胞中lncRNA FOXCUT基因的表达,结果显示沉默组lncRNA FOXCUT基因相对表达量显著降低,说明成功抑制基因表达。进一步研究发现,沉默lncRNA FOXCUT基因后CCK-8实验48、72 hA值及48 h细胞迁移率均低于空白组和空载组,表明抑制lncRNA FOXCUT基因表达可显著抑制结直肠癌HCT116细胞增殖及迁移能力。FOXC1属于Ⅱ类特异性转录因子,具有DNA结合域、插头区及核定位信号等结构[11-12]。基因测序已证实FOXC1具有调控胚胎发育、细胞周期及凋亡等过程,且在恶性肿瘤增殖、转移过程中发挥举足轻重的作用[13]。报道显示,FOXC1可通过复制、转录后修饰等多种途径引起表达水平升高,从而参与多种恶性肿瘤的发生、发展[14-15]。FOXCUT与下游编码区FOXC1距离小于10 kb,具有相同基因走向,两基因具有相关性。有研究证实,通过RNAi干扰FOXCUT基因表达可靶向干扰FOXC1表达,从而发挥间接调控细胞增殖、迁移等生物学活动的作用[16]。
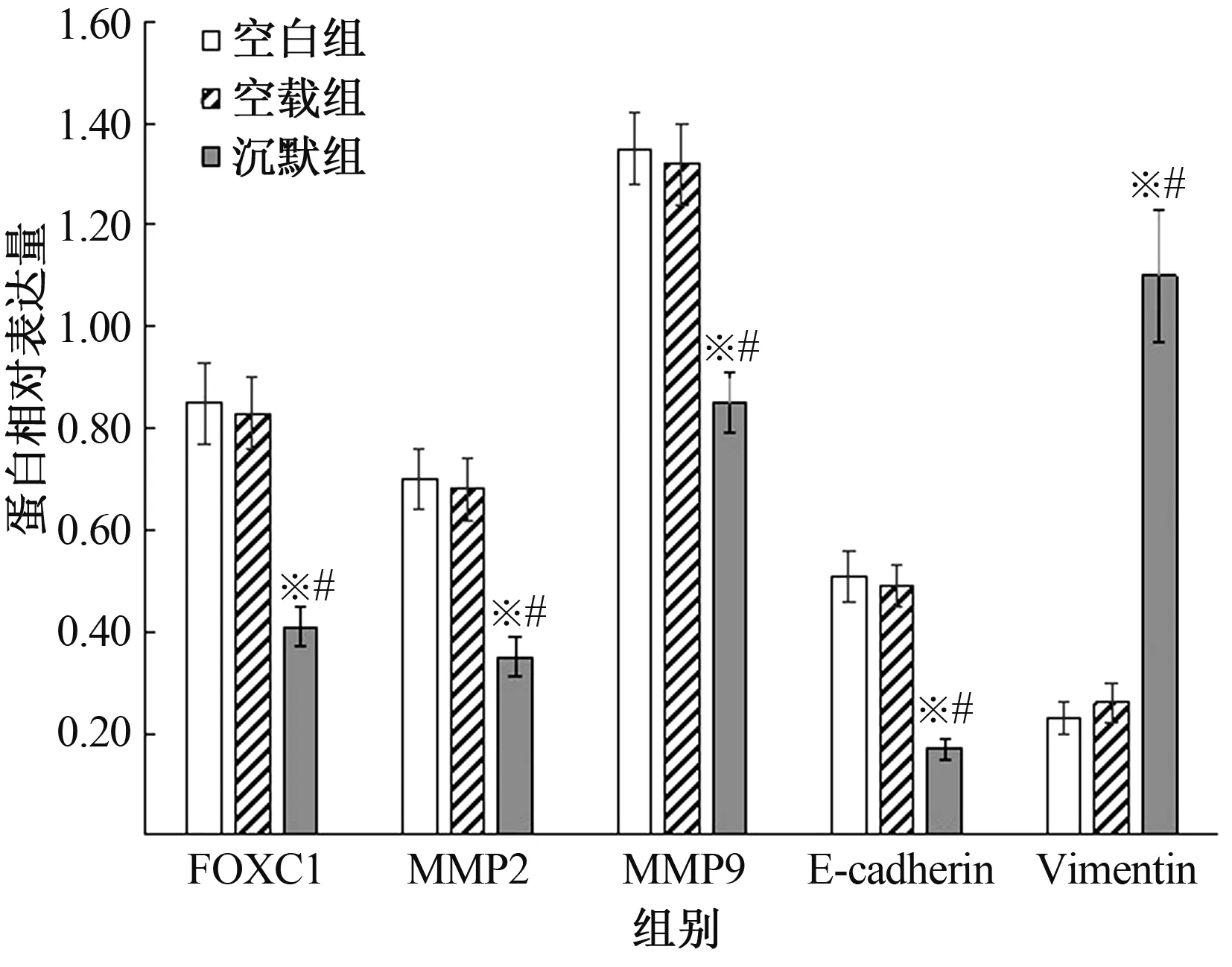
注:与空白组比较,*P<0.05;与空载组比较,#P<0.05。
此外,本研究发现,沉默组FOXC1、MMP2、MMP9、Vimentin mRNA和蛋白相对表达量均低于空白组和空载组,E-cadherin mRNA和蛋白相对表达量高于空白组和空载组,提示lncRNA FOXCUT可能通过调控FOXC1及其下游MMP2、MMP9、Vimentin、E-cadherin mRNA和蛋白表达发挥作用。MMP2、MMP9属于基质金属蛋白酶家族重要成员,已有报道MMP2、MMP9受FOXC1基因调控,参与调控结直肠癌细胞迁移过程[17]。另有研究发现,FOXC1可通过调控下游上皮-间质细胞转化(EMT)相关基因的表达,从而在肿瘤细胞增殖及迁移过程中发挥重要作用[18]。Vimentin属于间质细胞标志物,对维持细胞骨架完整有重要作用,Vimentin水平升高有助于促进细胞迁移;E-cadherin属于细胞黏附分子,对维持细胞间黏附性有重要作用,E-cadherin表达缺失是EMT的重要特征[19]。本研究应用RNAi干扰FOXCUT基因表达后,下游FOXC1表达被抑制,且FOXC1下游基质金属蛋白酶MMP2、MMP9及间质细胞标志物Vimentin基因及蛋白表达均下调,而E-cadherin表达上调,因此推测lncRNA FOXCUT可能通过调控FOXC1及下游相关基因发挥抑制结直肠癌细胞增殖及迁移能力的作用。
综上所述,沉默lncRNA FOXCUT基因可抑制结直肠癌细胞增殖、迁移能力,可能通过调控FOXC1及其下游MMP2、MMP9、Vimentin、E-cadherin mRNA和蛋白表达发挥作用,为临床通过干扰lncRNA FOXCUT基因治疗结直肠癌提供理论支持。在进一步的研究中,需设计实验验证lncRNA FOXCUT与FOXC1基因间的靶向关系,为临床开展结直肠癌基因靶向治疗提供更多支持。
