蒲公英总黄酮对乌拉坦诱导小鼠肺癌肿瘤相关巨噬细胞及肺部微环境的影响
2020-07-31李琴琴李梅王明李小青
李琴琴 李梅 王明 李小青
目前,临床上治疗肺癌的方式虽然取得较大进步,但是临床使用中仍然存在较大限制,肺癌的总体治疗效果仍然难以令人满意,患者生存期短,生存质量难以得到保障[1]。肿瘤微环境是影响肿瘤发生发展的重要因素,肿瘤微环境中的基质细胞与免疫抑制细胞及它们表达或分泌的相关蛋白与细胞因子,可通过多种方式促进肿瘤的生长及转移。研究表明[2],肿瘤微环境对肿瘤的作用是复杂的,不仅可以使癌细胞产生免疫逃逸,还能够促进癌细胞的转移和侵袭,同时肿瘤微环境还可诱导癌细胞对传统的抗癌疗法产生耐药。蒲公英黄酮类提取物具有抗菌、抗病毒、抗氧化、抗血栓、降血脂、降血糖和改善血液循环等药理作用[3]。研究证明,蒲公英能够增强机体的免疫能力,改善肿瘤患者的预后,具有抗肿瘤作用[4],动物实验证明,蒲公英总黄酮能调节小鼠体液免疫功能,改善小鼠组织及血液循环系统内部微环境[5]。化疗作为治疗肺癌常规手段之一,虽可显著抑制肿瘤细胞增殖,但对患者机体产生严重侵害,恶化其生存质量,临床上研究者已经开始寻找其他非化疗替代手段。本研究采用乌拉坦诱导小鼠肺癌疾病模型,以常规化疗药物干预为参照,观察蒲公英总黄酮对肺癌肿瘤微环境的影响及作用特点。
资料与方法
一、实验动物
C57BL/6小鼠,雄性,45只,SPF级,4~6周龄,体重(20±2)g,无特定病原体(specific-pathogen free,SPF)级别,购自中山大学实验动物中心(许可证号:SCXK(沪)2016-0003),于XXX实验动物中心SPF级别动物饲养房饲养(实验单位使用许可证编号:SYXK(琼)2015-0075)。
二、主要试剂与仪器
乌拉坦(纯度99%,CAS货号:51-79-6)购自江苏倍达医药科技有限公司。蒲公英总黄酮(纯度85%以上,9.4g/袋,批号:1411347,使用选择蒸馏水配成浓度为5 mg/mL的药液)由上海中医药大学药学院提供。顺铂注射液(20 mg/瓶,批号:1WA2A1403021B)购自齐鲁制药有限公司。Hyclone DMEM 糖培养液,抗小鼠CD206多克隆抗体、SABC免疫组化染色试剂盒、DAB显色试剂盒均购自武汉博士德生物工程有限公司;VEGF、IL-2、TNF-αELISA试剂盒均购自武汉新启迪生物科技有限公司;全蛋白提取试剂盒、BCA蛋白含量检测试剂盒均购自江苏凯基生物股份有限公司;鼠抗Bcl-XL、Bcl-2购自美国 Santa Cruz 公司;兔抗细胞凋亡抑制蛋白 1(Anti-apoptotic protein 1,cIAP1)、兔抗 Survivin均购自英国 Abcam公司;鼠抗β-actin购自美国 Sigma 公司。HRP结合的羊抗兔购自美国 Santa Cruz公司;HRP 结合的兔抗鼠购自丹麦Dako公司。酶标仪(iMark 680,美国);电泳仪(PowerPacBasic,Bio-Rad,美国);漩涡混合仪(宁波新芝生物科技股份有限公司);磁力搅拌器(上海蒲江分析仪器厂);化学发光成像分析系统(5200 Multi,Tanon,日本);超速低温离心机(Micrifuge 20 R Centrifuge,Beckman Coulter,美国);培养箱(Direct Heat CO2Incubator 37℃,5.0%CO2,Themo,美国);超净细胞工作台(苏净集团安泰公司);光学倒置显微镜(Olympus,日本);HH-42快速恒温数显水浴箱(常州国华电器有限公司);电子天平(JJ 3000,G&G,美国);电子游标卡尺(桂林广陆数字测控股份有限公司)。
三、 造模方法及分组给药
45只小鼠采取随机数字表法分成模型对照组、蒲公英总黄酮组、化疗组,每组15只。其中模型对照组、蒲公英总黄酮组、化疗组建立肺癌小鼠模型。建模方法[6]:小鼠腹腔注射乌拉坦800mg/kg,2次/周,连续注射5周。分组结束后第2 d开始给予药物治疗。模型对照组给予同等剂量生理盐水0.4 mL灌胃,蒲公英总黄酮组给予100 mg/kg的蒲公英总黄酮液灌胃,给药体积为 0. 4 mL/d(含生药0.6g),每日1次,连续18 d。用药第1、3、5 d,模型组及蒲公英总黄酮组予以生理盐水1 mL腹腔注射,化疗组选择含常规化疗药物顺铂生理盐水溶液1 mL(含顺铂0.1 mg)腹腔注射。第19 d,称重后脱颈椎处死各组小鼠,摘肺脏、脾脏和眼球,取眼球血。
四、肿瘤组织形态学观察
记录给药前和给药19 d后,小鼠的体重变化,并在给药第19 d,处死小鼠记录其脾脏重量,计算小鼠脾脏指数,脾脏指数(mg/g)=脾脏重量/体重×100%。取肺组织约3g,用4%甲醛固定、梯度酒精脱水、二甲苯透明、石蜡包埋,上全自动切片机连续切片,片厚约4μm,常规HE染色,(×200)光镜下观察并摄片。
五、测定小鼠肺部炎性细胞水平
在小鼠存活状态下,各组选取5只小鼠经气管行PBS 灌注,收集支气管肺泡灌洗液。采用血细胞计数仪检测各组小鼠WBC总数,离心涂片后,观察各组小鼠每视野下100个白细胞的中性粒细胞及淋巴细胞情况。
六、ELISA法检测肺癌小鼠外周血内VEGF、IL-6和TNF-α水平
每组选取5只小鼠进行眼眶采血,3200 rpm,离心10 min,离心半径5.6 cm,取上清液,采用ELISA法检测模型组、蒲公英总黄酮组、化疗组小鼠瘤体中VEGF、IL-6、TNF-αELISA水平变化,实验步骤按照试剂盒说明书操作。
七、免疫组化染色观察小鼠肿瘤相关巨噬细胞CD206形态学变化
各组随机选取5只小鼠,取肺部肿瘤组织,质量分数为4%多聚甲醛固定,常规石蜡包埋、切片,免疫组化染色后,200倍光镜下观察各组小鼠肿瘤相关巨噬细胞CD206阳性结果,阳性结果标准:巨噬细胞胞质内棕黄色或黄褐色颗粒CD206阳性巨噬细胞。
八、Western blot法检测各组小鼠瘤体中抗凋亡及增殖相关因子的水平
取血后脱颈椎处死小鼠,分别剥取模型组、各治疗组小鼠瘤体组织,-80℃冷存备用。采用Trizoll法提取各组小鼠瘤组织的总蛋白,BCA法检测蛋白的浓度,SDS-PAGE电泳,转膜,封闭后,分别加入相应的一抗、二抗,ECL发光液进行显影,X线胶片曝光,采用Image-Pro Plus软件进行图像目的条带的灰度值分析,以β-actin为内参,计算Bcl-XL、Bcl-2、cIAP1、Survivin蛋白的相对表达量。
九、统计学方法

结 果
一、HE染色结果
HE染色结果显示,乌拉坦诱导肺癌小鼠肺部浸满排列密集的肿瘤细胞,见图1B,化疗组肺癌小鼠肺组织可见腺癌腺圈,但肿瘤细胞相对较少,见图1A,蒲公英总黄酮组内存在肿瘤浸润细胞略多于化疗组小鼠肺组织,见图1C(见图1)。

图1 小鼠肺组织HE染色(×200) A:化疗组 B:模型对照组 C:蒲公英总黄酮组
二、各组小鼠实体瘤生长情况比较
治疗后,蒲公英总黄酮组和化疗组小鼠的体重和脾脏指数高于模型组(t=7.441,P<0.01;t=4.008,P=0.0004),蒲公英总黄酮组和化疗组小鼠的体重和脾脏指数比较差异无统计学意义(P>0.05)(见表1)。

表1 各组小鼠实体瘤生长情况比较
三、各组小鼠肿瘤组织巨噬细胞CD206比较
模型对照组小鼠肿瘤组织中可见大量清晰褐色巨噬细胞CD206,细胞核深染,核体积增大,且轮廓清晰。蒲公英总黄酮组及化疗组肿瘤细胞黄色和褐色巨噬细胞CD206比例减小,可见部分肿瘤细胞坏死、凋亡,核皱缩,核深染的比例减少,核仁小,染色质凝聚等现象(见表2,图2)。

表2 各组各组小鼠肿瘤组织CD206阳性细胞比例

图2 小鼠肿瘤组织免疫组化染色(×200)A:化疗组 B:模型对照组 C:蒲公英总黄酮组; 注:红色箭头指示褐色阳性细胞
四、各组小鼠炎性细胞水平
蒲公英总黄酮组及化疗组各WBC总数、中性粒细胞及淋巴细胞水平低于模型对照组(P<0.05),蒲公英总黄酮组及化疗组各WBC总数、中性粒细胞及淋巴细胞水平比较差异无统计学意义(P>0.05)(见表3)。
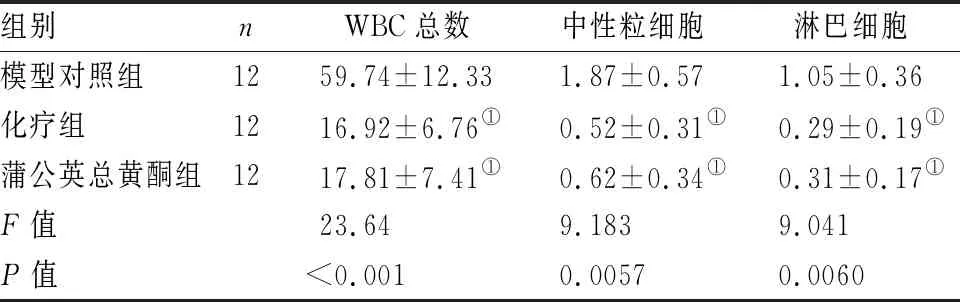
表3 各组小鼠炎性细胞水平比较(×104/mL)
五、各组小鼠细胞外周血细胞因子水平比较
蒲公英总黄酮组及化疗组小鼠外周血中的VEGF、IL-6、TNF-α水平显著低于模型组(P<0.01)。且蒲公英总黄酮组VEGF、IL-6、TNF-α水平显著低于化疗组(P=0.0081)(见表4)。
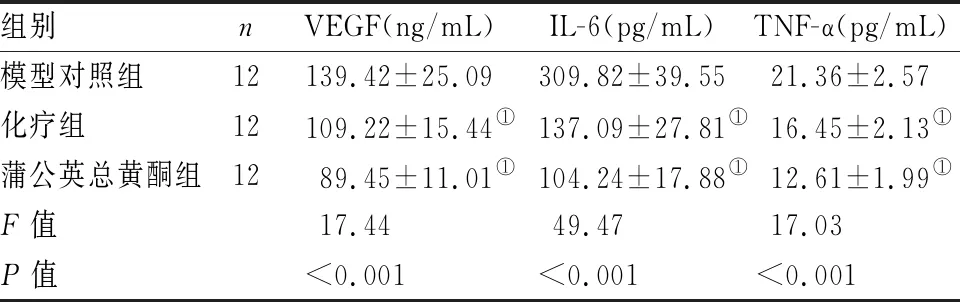
表4 各组小鼠细胞因子水平比较
六、两组抗凋亡及增殖相关因子表达情况比较
蒲公英总黄酮组及化疗组小鼠Bcl-XL、Bcl-2、cIAP1、Survivin蛋白的表达低于模型对照组(P<0.01)。蒲公英总黄酮组小鼠Bcl-XL、Bcl-2、cIAP1、Survivin蛋白的表达与化疗组差异无统计学意义(P<0.01)(见图3、表5)。
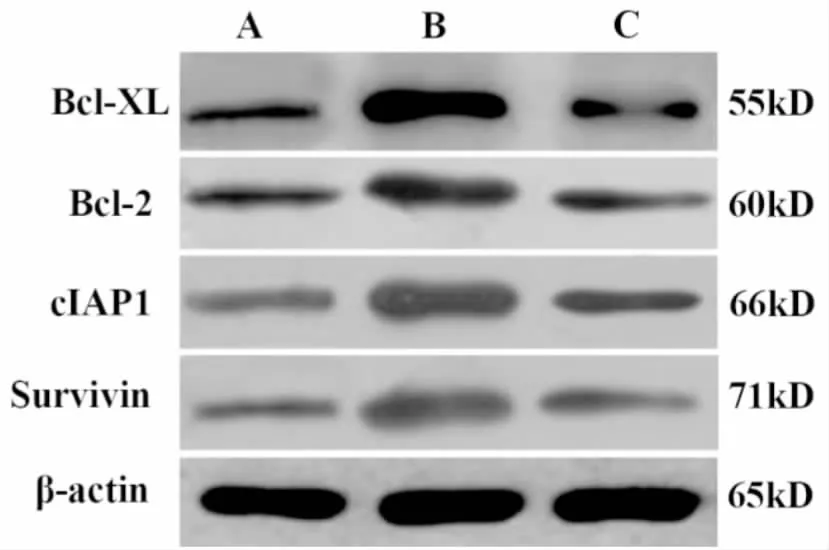
图3 小鼠肿瘤组织抗凋亡及增殖蛋白表达Western blot检测A:化疗组 B:模型对照组 C:蒲公英总黄酮组

表5 小鼠肿瘤组织抗凋亡及增殖蛋白表达
讨 论
乌拉坦学名氨基甲酸乙酯,可用于动物麻醉,主要存在于烟草、烟雾中,是一种化学致癌物质,可用于诱导肺癌的发生。研究表明[7],乌拉坦一般毒性作用较轻且无剂量蓄积作用,注射后对小鼠摄食、生长发育和体质量的增长都无明显影响,其诱导的小鼠肺癌病理学特征与人肺腺癌极其相似。本研究通过对小鼠行乌拉坦800mg/kg腹腔注射,每周两次,连续5周以建立小鼠肺腺癌模型,结果显示,建模后,小鼠肺部浸满排列密集的肿瘤细胞,呈现典型的肺腺癌特征。因此,本研究进一步确认乌拉坦可建立较理想的小鼠肺癌疾病模型。
肿瘤微环境在肺癌的发生和转移中有重要的作用,研究肿瘤微环境对理解肺癌的发生机制以及肺癌防治药物的研发,都具有十分重要的意义。蒲公英总黄酮能够改变肿瘤细胞膜通透性,破坏其细胞膜完整性,导致肿瘤细胞质内金属离子、蛋白质和糖类物质渗出阻碍肿瘤细胞代谢紊乱,进而影响细胞微环境而杀死肿瘤细胞[8-12]。本研究结果发现,蒲公英总黄酮组小鼠肺部肿瘤细胞浸润数量比模型组明显减少,表明蒲公英总黄酮可以有效抑制肿瘤细胞的增殖,作用机制可能是通过NF-κB和STAT3信号通路干预肿瘤相关巨噬细胞(TAM)而实现的。而我们的实验结果显示,蒲公英总黄酮可以直接抑制Bcl-XL、Bcl-2、cIAP1、Survivin蛋白的表达,通过促进肿瘤细胞凋亡从而抑制肿瘤细胞的生长。
近年来靶向肿瘤微环境,尤其是肿瘤组织中的巨噬细胞-肿瘤相关巨噬细胞(TAMs)成为治疗肿瘤的新途径。在肿瘤微环境中,至少有两种不同激活状态的巨噬细胞亚群:经典活化的巨噬细胞(M1)和替代性活化的巨噬细胞(M2)。研究表明,M2 型巨噬细胞(表面分子标记物CD206)通过分泌炎症因子/趋化因子、血管内皮生长因子(VEGF)等细胞活性物质,促进炎症、刺激血管生成、促进肿瘤细胞的转移和传播、减弱抗肿瘤免疫作用促进肿瘤的进展[13]。本研究结果显示,蒲公英总黄酮可以显著抑制M2型巨噬细胞(CD206)的数量,减少小鼠体内炎性细胞的数量,降低促炎症细胞因子的表达。
对于恶性肿瘤的侵袭和转移,现代医学目前还不能很好的解决这个问题。VEGF在大部分实体瘤内高表达,能够激发肿瘤内新生脉管的生成,从而促进肿瘤的浸润和转移。研究发现蒲公英提取物能通过改善胶质瘤VEGF/VEGFR阳性细胞百分比微环境,抑制胶质瘤肿瘤血管生成[14]。本研究发现,蒲公英总黄酮显著降低小鼠瘤体组织中VEGF的表达,且低于顺铂化疗组(P=0.0081),表明蒲公英总黄酮有助于抑制肿瘤的浸润和转移。此外,值得注意的是,蒲公英总黄酮组小鼠的体重和脾脏指数高于模型组,表明使用蒲公英总黄酮可增强机体的免疫功能和内在防御能力,体现了中医中药“扶正固本”的精髓和优势。
综上所述,蒲公英总黄酮方能明显改善肺癌小鼠生存质量及抑制肿瘤生长,其内在作用机制可能是通过调节肺癌微环境,体现扶正祛邪的作用。一方面,通过增强机体的免疫功能达到扶正作用。另一方面,通过抑制Bcl-XL等蛋白的表达,促进肿瘤细胞凋亡,以及抑制M2型巨噬细胞,减轻炎症反应,达到祛邪作用。本研究可为蒲公英总黄酮方的进一步临床推广应用提供重要参考。
