外源MeJA对低温胁迫下冬小麦冷响应基因表达的影响
2020-07-31樊晓培邢津溥魏铁锁李欣洋徐庆华
樊晓培,邢津溥,魏铁锁,李欣洋,苍 晶,徐庆华,张 达
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
低温限制着植物的地理分布、生长发育。冷驯化有助于提高植物的冷冻耐受性,CBF(C-repeat binding factor)可响应冷信号,是高等植物冷驯化的一个重要途径。ICE1(inducer of CBF expression, CBF表达诱导因子1)是诱导CBF表达的MYC(Myelocytomatosis)类转录激活因子,在低温时可以特异性地结合到CBF启动子的MYC识别序列,激活CBF的转录,然后结合到其下游靶基因启动子的DRE(dehydration response element)序列上,诱导下游冷响应基因(Cor)的表达,从而提高植株的抗冻性[1]。
茉莉酸(JA)作为一种信号分子,参与拟南芥的根系生长、花青素积累、毛状体起始、雄性育性、叶片衰老以及对生物和非生物胁迫等反应[2]。研究表明,JA正调节拟南芥ICE-CBF途径,以增强其抗冻性;JA提高抗寒性的机制与低温诱导的冷驯化有关[3]。正常条件下,JA信号阻遏因子JAZ(Jasmonate ZIM-DOMAIN)蛋白通过阻遏ICE1的转录,抑制下游冷应答基因的表达;冷胁迫增加了拟南芥内源JA含量,JA以活性形式JA-Ile(茉莉酸-异亮氨酸)与COI1(coronatine insensitive 1)受体结合,JAZ蛋白被降解,从而解除对MYC2、ICE1的阻遏,激活冷应答通路CBF/DREB1基因表达;外源JA提高了拟南芥CBF/DREB1通路冷响应基因的表达量,增强了其抗寒性;相反,阻断JA生物合成或信号转导途径,则会导致植物对冷冻敏感[3]。研究也表明,MeJA处理提高了低温胁迫下枇杷(EriobotryajaponicaLindl.)脯氨酸、可溶性糖含量及抗氧化酶活性,这些保护物和保护酶能够减少自由基对细胞膜的损害,保证细胞膜的完整性,从而提高植物的抗寒性[4]。
东农冬麦1号(Dn1)是强抗寒冬小麦品种,外源MeJA可以提高Dn1在低温胁迫下的抗寒相关指标及JA信号转导途径关键基因TaCOI1、TaMYC2的表达量,提高其抗寒性[5]。JA对Dn1抗寒性的调节,是否与ICE介导的CBF途径有关?JA是否引起CBF下游冷响应基因表达量的变化?本课题组前期对Dn1的蛋白组学研究发现,低温胁迫下,4个冷响应基因Wcor14、Wcor15、Wcor18、Wcor413编码的蛋白表达水平发生了显著变化[6]。本研究拟探讨外源MeJA处理对低温胁迫下Dn1上述四个冷响应基因和TaICE41的表达量的影响,结合TaICE41生物信息学分析及预测,进一步探究激素JA调控Dn1强抗寒性的分子机制,为激素调控植物的抗寒性提供参考依据。
1 材料与方法
1.1 供试材料与设计
强抗寒性冬小麦品种东农冬麦1号(Dn1),在黑龙江地区返青率高达85 %,由东北农业大学小麦室提供。2017年9月8日,将Dn1种子播种于东北农业大学校内实验田内(行长4 m;行距 0.2 m;播种深度5 cm)。常规水肥管理。2017年9月24日,用1 mmol·L-1MeJA喷洒三叶期幼苗叶片,以喷洒等量含相同浓度乙醇的蒸馏水作为对照。以课题组前期确定的四个温度节点为取样时间点,待连续10 d每日最低温度达到5 ℃(2017年10月7日)、0 ℃(2017年10月24日)、-10 ℃(2017年11月21日)和-25 ℃(2018年1月14日)时,于上午(9:00-11:00)取叶片和分蘖节,用去离子水清洗后,剪成1 cm小段,用液氮速冻后置于-80 ℃冰箱备用。
1.2 试验方法
1.2.1 RNA提取和实时荧光定量PCR分析
采用Trizol法提取Dn1分蘖节及叶片总RNA;采用一步反转录法合成cDNA第一条链,方法参照试剂盒(北京全式金AT311)说明书进行。使用Primer Premier 6.0 软件设计TaICE41(GenBank ID:EU562183)、Wcor14(GenBank ID:FJ605270)、Wcor15(GenBank ID:KP266692)、Wcor18(GenBank ID:AB097412)、Wcor413(GenBank ID:AAB18207.1)的qRT-PCR特异引物,以小麦TaActin为内参基因,引物序列见表1。按照TransStart Top Green qRT-PCR SuperMix说明(北京全式金AQ131)反应体系进行qRT-PCR反应,反应系统为Mx3000p Real-Time PCR Systerm(美国,Strata gene)。反应程序为94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火30 s,40个循环;94 ℃变性15 s,60 ℃退火60 s,94 ℃变性15 s。采取2-△△Ct法计算待测基因的相对表达量。3次生物学重复,数据统计学分析采用SPSS 22软件。

表1 qRT-PCR引物序列
1.2.2TaICE41生物信息学分析及预测
TaICE41氨基酸和核酸序列由NCBI搜索获得。利用Ensembl Plants Home对TaICE41染色体位置进行确定;利用http://web.expasy.org/protparam/在线程序对TaICE41蛋白的PI、MW、氨基酸组成、消光系数、稳定系数等理化性质进行分析;通过ProtComp 9.0(http://www.softberry.com/berry.phtml?topic=protcompan& group=programs&subgroup=proloc)在线程序对TaICE41蛋白进行亚细胞定位预测;运用SOPMA SECONDARY STRUCTURE PREDICTION METHOD(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/)在线程序预测TaICE41蛋白的二、三级结构;利用MEGA 6软件N-J法构建小麦与其他6个物种的ICE蛋白系统进化树并分析,利用MEME-Submission form(http://meme-suite.org/tools/meme)在线程序对小麦及其他6个物种的ICE motif基序进行分析。
2 结果与分析
2.1 外源MeJA对Dn1分蘖节及叶片冷响应基因表达量的影响
2.1.1 对TaICE41表达量的影响
如图1所示,随着温度的降低,Dn1分蘖节和叶片中TaICE41的相对表达量均呈先升后降的变化趋势,分别在-10 ℃和0 ℃达到峰值。外源MeJA处理显著提高了Dn1分蘖节在-10 ℃、-25 ℃下TaICE41的表达量(P<0.05),处理组分别约为对照组的3.3倍、3.4倍(图1A);显著提高了Dn1在0 ℃、-10 ℃和-25 ℃下叶片中TaICE41的表达量(图1B)。表明TaICE41的表达受低温胁迫影响,TaICE41参与了Dn1的抗寒响应。
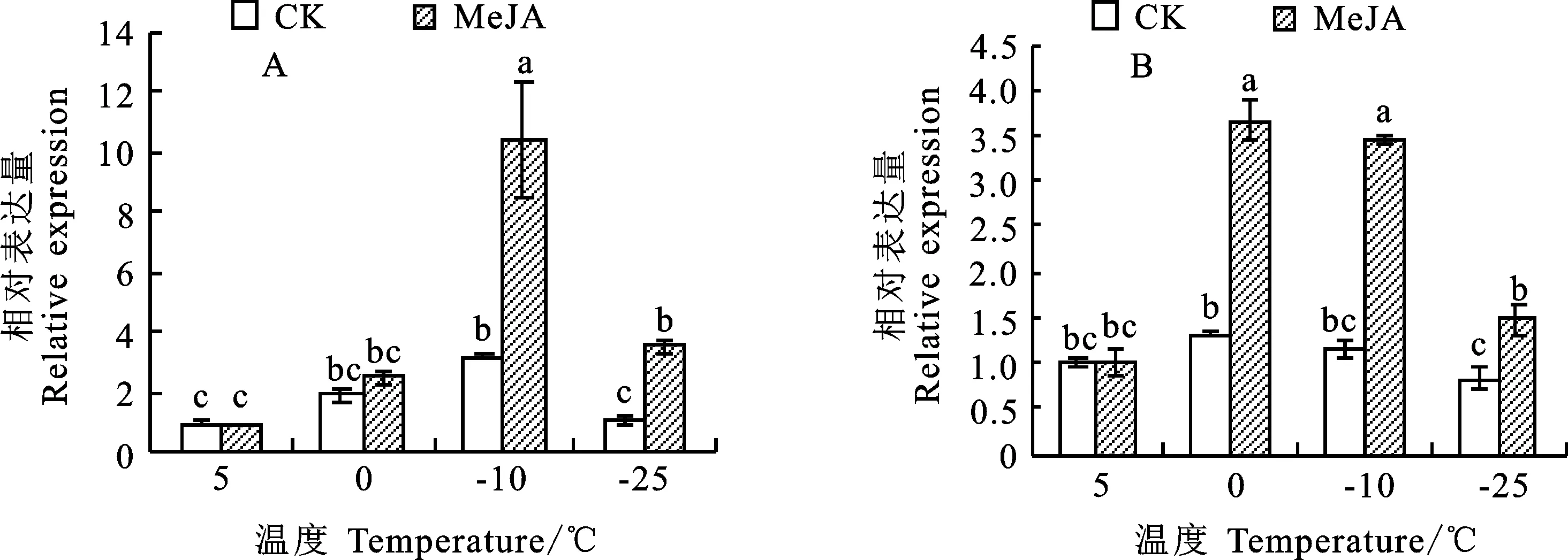
图柱上不同字母表示差异在0.05水平显著。
2.1.2 对分蘖节中Wcor14、Wcor15、Wcor18、Wcor413相对表达量的影响
如图2所示,随着温度的降低,Dn1分蘖节中Wcor14、Wcor15、Wcor18和Wcor413的相对表达量在处理组和对照组中均呈先升后降的变化趋势,分别在-10 ℃、0 ℃达到峰值。在-10 ℃、-25 ℃胁迫时,外源MeJA处理较对照显著增加了Dn1分蘖节中Wcor14、Wcor15、Wcor18和Wcor413(-25 ℃除外)的相对表达量(P< 0.05)。
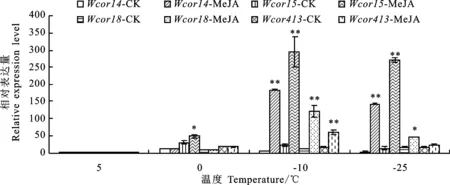
*和**表示对照与MeJA处理间差异在0.05和0.01水平显著。下同。
2.1.3 对叶片中Wcor14、Wcor15、Wcor18、Wcor413相对表达量的影响
如图3所示,随着温度的降低,Dn1叶片中Wcor14、Wcor15的相对表达量在处理组和对照组中均呈升-降-升的变化趋势,最大值出现在 0 ℃;Wcor18呈持续上升、Wcor413呈先升后降的变化趋势,分别在-25 ℃、-10 ℃达到最大值。外源MeJA处理显著提高了Dn1在0 ℃、-10 ℃、-25 ℃下叶片中Wcor14、Wcor15的相对表达量;提高了0 ℃、-10 ℃、-25 ℃下Wcor18的相对表达量,但差异不显著;提高了 0 ℃、-10 ℃下Wcor413的相对表达量。
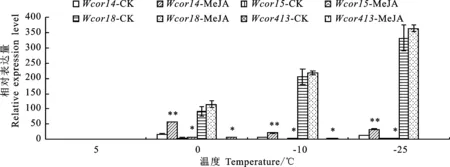
*:P<0.05;**:P<0.01
2.2 TaICE41的生物信息学分析及预测
2.2.1TaICE41基因结构及编码蛋白理化性质
检测到TaICE41基因全长为1 627 bp,编码383个氨基酸,位于小麦基因组3A染色体684290168~684290834(TraesCS3A02G442200)上。其保守结构域位于第191~253个氨基酸处,全长63个氨基酸。TaICE41属于小麦CBF转录激活因子成员之一,蛋白分类属于HLH超家族和类ACT_UUR-ACR超家族成员。ExPASyProtParam tool在线分析显示,该蛋白的分子质量为39.6 kDa,理论等电点(PI)值为5.04,属弱酸性;不稳定指数为63.35,脂肪指数为 71.98,亲水性平均值为-0.178,为不稳定亲水性蛋白。
2.2.2 TaICE41蛋白亚细胞定位预测
采用ProtComp 9.0在线程序对TaICE41编码的蛋白进行亚细胞定位预测,该蛋白为分泌型蛋白质,定位于细胞核上(如图4)。
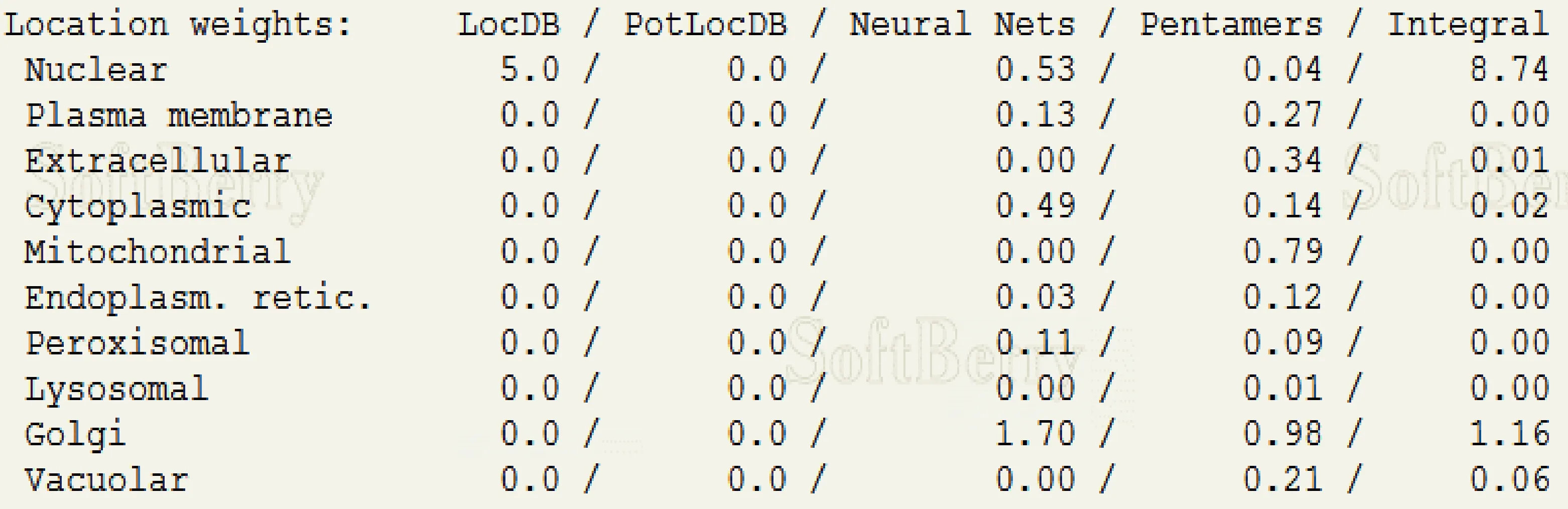
图4 TaICE41蛋白亚细胞定位预测
2.2.3 TaICE41蛋白二、三级结构预测
TaICE41蛋白二级结构预测结果(图5左)显示,无规则卷曲(Coils)占47%,α-螺旋(Helix)占42.30%,延伸链占7.05%,β-转角(Turns)占3.66%,表明该蛋白为无规则卷曲型。
为深入了解TaICE41的蛋白特性,通过同源建模SWISS-MODEL分析系统在线预测TaICE41三维模型如图5右,发现构建模板蛋白为5gnj.1.B,TaICE41与模板的氨基酸序列同源性为57.69%,低聚糖状态为同源二聚体,GMQE(Global Model Quality Estimation)值为0.09,QMEAN值为1.06。

图5 TaICE41蛋白二(左)、三(右)级结构预测
2.2.4 ICE蛋白系统进化树及Motif分析
利用MEGA6软件的N-J法对Dn1(Triticumaestivum)、节节麦(Aegilopstauschii)、伞穗山羊草(Aegilopsumbellulata)、二穗短柄草(Brachypodiumdistachyon)、水稻(Oryzasativa)、大豆(Glycinemax)、拟南芥(Arabidopsisthaliana)7个物种的ICE蛋白序列进行系统发育分析。结果(图6)表明,Dn1的ICE41蛋白与节节麦和伞穗山羊草的ICE1蛋白相似性为94%;与二穗短柄草相似性为88%。用MEME在线程序对7种植物的motif进行分析(图7)发现,小麦与节节麦和伞穗山羊草的ICE1蛋白有10个相同的motif基序,而与大豆、水稻、拟南芥有7个相同的motif基序,进一步验证了蛋白进化树分析结果。

图6 不同物种ICE蛋白系统进化树分析

图7 不同物种ICE蛋白motif分析
3 讨 论
在水稻、拟南芥、西红柿、黄瓜、烟草、巴西橡胶、香蕉和麻风树等植物中,ICE可提高其抗寒性[7]。Hu等[3]发现,低温提高了拟南芥JA合成基因的表达,JA通过正调节ICE-CBF途径增强其抗冻性。Hong等[8]发现,低温处理橡胶树 12 h可提高其内源JA生物合成关键基因OPR、AOS、AOC和JA信号通路重要基因JAZs和MYCs的表达。JA正调节巴西橡胶树的冷响应,HbICE1正调节其耐寒性[8]。冷驯化能够提高TaICE41基因在拟南芥中的表达,其结构域与MYC2a和MYC4g互作,可激活CBF转录,提高植株的抗冻性[9]。本研究发现,与5 ℃相比,0 ℃、-10 ℃、-25 ℃低温均不同程度地提高了Dn1分蘖节和叶片中TaICE41的表达量;JA处理显著提高了上述低温胁迫下分蘖节与叶片中TaICE41的表达量,表明Dn1的TaICE41表达量受低温胁迫影响,TaICE41参与了Dn1的抗寒响应。这与前人对拟南芥[3]、橡胶树[8]ICE1正调控耐寒性的研究结果一致。拟南芥ICE1基因编码494个氨基酸的蛋白质,分子量为53.5 kD,AtICE1蛋白含螺旋-环-螺旋(bHLH)保守结构域[10]。小麦TaICE41和TaICE87蛋白与AtICE1蛋白分别有50%和47%的同源性,TaICE41和TaICE87一致性为46%[9]。本研究表明,冬小麦Dn1的TaICE41位于3A染色体上,定位于细胞核内,属于小麦CBF转录激活因子成员之一,蛋白分类属于HLH超家族成员。Dn1的TaICE41蛋白与节节麦和伞穗山羊草的ICE1蛋白在系统进化树上属于同类,相似性为94%,motif基序有10个相同,支持聚类分析结果。
低温胁迫诱导了编码COR蛋白的基因表达,这与植物抗寒性正相关。拟南芥Cor的顺式作用元件CRT(C-repeat)/DRE的CCGAC核心基序在启动子功能中起关键作用[11]。AtCor蛋白起到稳定细胞膜结构、激活ROS清除系统、产生抗冷冻蛋白和代谢物的作用,进而提高植物对冷冻胁迫的耐受性[12-13]。Wcor14和Wcor15类似于拟南芥COR15a,编码叶绿体COR蛋白,为ABA非依赖型COR[14]。4 ℃冷驯化3~6 h后,小麦叶片Wcor14基因的相对表达量迅速积累,在第三天达到最大值,随后下降并维持在一个稳定的水平,表明Wcor14受低温诱导[15]。对小麦进行4 ℃处理,发现处理15 min后冬小麦和春小麦幼苗叶片Wcor15基因的表达量提高,随后表达量持续增加, 并在2 d内维持较高的水平;若幼苗进一步暴露在更低的温度,则导致其表达水平降低[16]。wcor18蛋白属于高度保守的磷脂酰乙醇胺结合蛋白家族,该家族成员与控制单、双子叶植物的开花时间有关[17]。对4 ℃处理的冬小麦叶片进行蛋白双向电泳与质谱鉴定发现,低温诱导了wcor18蛋白的表达,参与冷诱导的蛋白同时也参与春化起始的过程[18]。-5 ℃处理显著增加了冬小麦叶片Wcor413蛋白的表达水平[19]。
本研究发现,低温胁迫下Dn1分蘖节和叶片中CBF下游冷响应基因Wcor14、Wcor15、Wcor18、Wcor413的表达量均不同程度地提高,表明这些基因受低温诱导,这与对拟南芥[3]和橡胶树[8]、小麦[15-16,18-19]的研究结果相一致。
前人对冬小麦冷响应基因受低温胁迫诱导表达的研究,多为室内培养箱[15,18-19]或水培[16]培养,检测部位多为叶片[15-16,18-19],处理温度为 4 ℃[15-16,18]、最低温度为-5 ℃[19],多为低温胁迫后的快速响应。而自然界的生长环境相对复杂,植物在自然生长条件下受到低温、光照、水分、土壤条件等多种因素的影响,且抗寒性是在持续低温适应过程中逐渐形成。有报道指出,-5 ℃处理下,冬小麦叶片中的很多基因在第1天内迅速诱导表达,至第3天达到最大,如Wcor413基因的相对表达量第3天是第1天的8倍,WCOR14a基因的相对表达量第3天是第1天的2倍;也有一些基因,仅在低温胁迫后1 d内诱导表达[19]。Rinaldueei等[18]指出,4 ℃处理后,冬小麦叶片Wcor18蛋白的表达量随时间延长而增加,第63天达到最大,Wcor18基因的相对表达量结果与之一致。本研究发现,随着温度的降低,分蘖节中5个被测冷响应基因的表达量均在-10 ℃达到最大值,说明-10 ℃是Dn1越冬的重要温度节点,-25 ℃作为生存的极限温度可引起植物体内很多代谢停止,故表现出基因表达量降低,这与前人的研究结果相一致[18-19]。叶片中除Wcor18外,其他4个冷响应基因表达量均在 0 ℃最大,这是因为叶片在极低温度下被积雪覆盖或被寒风抽干,代谢减弱,表达量降低。分蘖节与叶片相比,除Wcor18外,TaICE41、Wcor14、Wcor15、Wcor413均表现出分蘖节>叶片,这与分蘖节作为Dn1安全越冬的主要部位有关。本研究基于大田自然降温条件,更能反映植物的自然生长状态,故研究结果对解决高寒地区农业生产实践具有更直接的参考价值。我们前期构建了低温胁迫下(5 ℃、0 ℃、-10 ℃、-25 ℃)Dn1分蘖节蛋白组库,组学分析发现,与5 ℃相比,-10 ℃下的冷响应蛋白Wcor14、Wcor15、Wcor18、Wcor413的表达量显著上调[6]。本研究中,冷响应基因表达水平的变化与蛋白组的变化相一致。结合外源MeJA处理提高了低温胁迫下Dn1叶片及分蘖节中TaMYC2的表达量[5],表明JA可能参与低温胁迫下Dn1的ICE-CBF途径。综合本课题组前期SA[20]、ABA[21]对Dn1效应的研究结果,推测ABA、JA、SA与ICE-CBF信号途径在Dn1强抗寒的分子机制中存在协同作用。
ICE蛋白的活性受HOS1泛素E3连接酶的负调控,HOS1靶向ICE蛋白酶体降解[22-24];JA信号阻遏蛋白JAZ1/4抑制ICE1转录活性[3]。因此,ICE1不仅是冷信号的核心组件,也是一个整合多种信号调节植物的耐寒性的关键点。那么,Dn1的TaICE41蛋白是否与MYC2、JAZ蛋白互作?JA如何介导Dn1的ICE-CBF抗寒途径?这有待于进一步研究。
