黄淮南部麦区小麦赤霉病抗性鉴定及基因型分析
2020-07-31李正玲王会伟李金秀李金榜常东伟
张 煜,李正玲,王 震,张 彬,王会伟,李金秀,李金榜,胡 琳,常东伟
(1.河南省农业科学院小麦研究所/河南省小麦生物学重点实验室/河南省麦类种质资源创新与改良重点实验室,河南郑州 450002;2.南阳市农业科学院,河南南阳 473083;3.江苏瑞华农业科技有限公司,江苏宿迁 210014)
赤霉病(Fusarium head blight,FHB)是中国常见的小麦病害之一,其发生不仅对小麦产量造成严重威胁,还会因真菌毒素污染籽粒而危害人畜健康,影响小麦的商用价值。随着气候及耕作方式的变化,小麦赤霉病在黄淮南部麦区已逐渐由偶发性病害转变为常发性病害,严重影响了该区域小麦生产水平的进一步提高和粮食安全。选育和推广抗赤霉病小麦品种是控制小麦赤霉病危害的安全有效措施之一,而缺少农艺性状优良、抗性过硬且抗性基因组成明确的抗病材料是当前黄淮南部麦区小麦抗赤霉病品种选育的主要限制因素。因此,筛选、鉴定优异抗性资源材料,探明抗病材料的抗性基因组成,对黄淮南部麦区小麦抗赤霉病品种选育有重要意义。
近几年有关黄淮南部麦区小麦赤霉病抗性鉴定的研究逐渐增多。周淼平等[1]采用单小花滴注接种法对黄淮麦区育成的564份小麦品种(系)进行鉴定,获得了18份赤霉病抗性水平达中感以上的品种(系)。马金娟等[2]对2016-2017年在陕西省区试的137份小麦品种的赤霉病抗性进行鉴定,发现高抗和中抗小麦品种分别占品种总数的0.7%和33.6%。苏双飞等[3]从145份适合于淮河流域种植的小麦品种(系)中鉴定出2份中抗赤霉病品种(系)。这些鉴定结果为赤霉病抗性育种提供了新的材料。继续扩大筛选鉴定范围,开展具有黄淮生态类型的抗赤霉病材料的筛选和抗性基因的分子鉴定有重要意义。
小麦赤霉病抗性是由多个微效基因控制的数量遗传性状,目前已定位的QTL超过250个,分布于小麦所有染色体,但其大多数是微效基因[4]。目前,已正式命名的抗赤霉病基因有7个,分别为Fhb1、Fhb2、Fhb3、Fhb4、Fhb5、Fhb6和Fhb7。其中,Fhb1、Fhb2、Fhb4和Fhb5源自小麦,且Fhb1和Fhb2属于抗扩展类型的抗性基因[5-7],Fhb4和Fhb5属于抗侵染类型的抗性基因[8-9]。Fhb1是目前被应用最多的赤霉病抗性基因,朱展望等[10]从国内229份小麦品种(系)中筛选出26份含有Fhb1的抗赤霉病单倍型;张宏军等[11]通过Fhb1基因功能标记结合回交转育的方法提高了黄淮麦区小麦品种的赤霉病抗性。除此之外,郑首航等[12]开发了2个与Fhb5紧密连锁的分子标记(WGRB0805和WGRB0950),并利用这2个分子标记辅助选择将Fhb5导入2个不同遗传背景的小麦品种中,获得了2个高抗赤霉病的育种中间材料。Fhb3、Fhb6和Fhb7均属于抗扩展类型的赤霉病抗性基因,分别来自大赖草[13-14]、披碱草[14]和长穗偃麦草[15-16],利用这些小麦近缘属种已创制出赤霉病抗性优异的种质材料[17-19]。
本研究通过对收集的黄淮南部麦区小麦品种(系)和抗性种质材料进行赤霉病抗性鉴定,并利用抗赤霉病基因分子标记对部分抗性材料进行检测,明确其抗性基因组成,以期为今后黄淮南部麦区抗赤霉病品种选育提供种质信息。
1 材料与方法
1.1 材料与试验设计
2016-2017年,将收集的762个黄淮南部麦区小麦品种(系)种植于河南省南阳市农业科学院试验基地,采用土表接种法进行赤霉病抗性鉴定。2017-2018年,将经土表接种法鉴定为中抗赤霉病的品种(系)和收集的6个可用于抗赤霉病育种的种质材料(其中 2个为多抗性基因聚合的种质材料K03562和K03566,4个为小麦-长穗偃麦草易位系山农079-5、079-8、543648和544014)种植于河南现代农业研究开发基地,采用单小花滴注接种法对供试材料进行赤霉病抗性鉴定。以苏麦3号、郑麦9023和郑麦0943分别为高抗、中抗和中感对照指示品种。供试小麦赤霉病病菌含有3个黄淮麦区赤霉病强致病力菌株(Fg16-2、Fg16-5和Fg16-8)和1个长江中下游麦区赤霉病强致病力菌株(Fa301)的混合菌株,其中,黄淮麦区赤霉病强致病力菌株由本课题组分离鉴定,长江中下游麦区赤霉病强致病力菌株由江苏省农业科学院陈怀谷研究员提供。试验田土壤为沙壤土,中高肥力水平,前茬作物为玉米。2016-2017年每个材料种2行,行长1.4 m,行距0.3 m,株距0.1 m;2017-2018年每个材料种4行,行长1 m,行距0.23 m,株距0.07 m。试验田的田间管理措施同当地高产田。
1.2 赤霉病抗性鉴定
参考张 彬等[20]的方法,用赤霉病混合菌种对供试品种分别进行人工土表接种和单小花滴注接种鉴定。具体操作为:人工土表接种是在小麦抽穗前1个月分2次将制备的玉米病粒均匀撒于小麦行间,每次接种量为30 kg·hm-2,接种后弥雾保湿1周;单花滴注接种是利用绿豆水培养基制备孢子悬浮液,稀释浓度至105个孢子·mL-1,在小麦扬花初期将20 μL孢子悬浮液注入麦穗中部的一个小花内,并对接种穗进行标记,每份材料至少接种15穗,接种后弥雾保湿1周。
参考国家农业行业标准《小麦抗病虫性评价技术规范:小麦抗赤霉病评价技术规范》(NY/T 1443.4-2007)[21],在小麦乳熟期调查供试材料的发病程度。对于土表接种的材料,分别调查病穗率和严重度,并计算病情指数(DI);对于单小花滴注接种的材料,调查各病穗的病情严重度,并计算平均严重度S(各接种病穗病情严重度的算术平均值)。考虑到行业标准中对照品种的株高和生育期与黄淮南部麦区小麦品种差异较大,本研究选择苏麦3号、郑麦9023和郑麦0943分别为高抗、中抗和中感对照品种,供试材料的抗性评价以对照品种为基准,划分为免疫(I)、高抗(HR)、中抗(MR)、中感(MS)、高感(HS)品种(表1)。

表1 小麦赤霉病抗性划分标准
(1)病穗率=感病穗数/总调查穗数×100%
(2)病情指数(DI)=∑(各级病穗数×相应病级数)/(调查总穗数×最高病级数)
(3)平均严重度(S)=∑(各病级穗数×相应病级数)/总调查总穗数
1.3 分子标记检测
于各供试材料的苗期,采集长2 cm的叶片装入2 mL离心管,在液氮中研磨至粉末,采用CTAB法提取DNA,用NanoDrop 2000微量分光光度计测定DNA浓度和纯度。采用 与Fhb1、Fhb2、Fhb4、Fhb5和Fhb7连锁的标记(表2)对赤霉病抗性鉴定为中抗及部分中感的小麦品种(系)进行检测,其中,Fhb1基因以苏麦3号为对照,Fhb2、Fhb4和Fhb5基因以望水白为对照,Fhb7基因以长穗偃麦草Fhb7基因导入系为对照。检测Fhb1和Fhb7的PCR扩增体系为10 μL,包含 0.5 μL DNA模板,5 μL 2×Taq MasterMix,10 pmoL·μL-1正、反向引物各0.2 μL,4.1 μL ddH2O。PCR程序为94 ℃预变性5 min;94 ℃变性1 min,59 ℃退火40 s,72 ℃延伸1 min,38个循环;最后72 ℃延伸5 min;1%琼脂糖电泳检测。检测Fhb2、Fhb4和Fhb5的PCR扩增反应体系为12 μL,其中包含2 μL DNA模板,1.2 μL 10×buffer(Mg2+),0.2 μL dNTPs(10 pmoL·μL-1),0.1 μL 正向引物(10 pmoL·μL-1),0.38 μL反向引物(10 pmoL·μL-1),0.28 μL M13引物(10 pmoL·μL-1),0.06 μLTaq酶(5 U·μL-1),7.78 μL ddH2O。采用降落PCR扩增程序,然后进入PCR扩增程序,即95 ℃预变性5 min;96 ℃变性1 min,68 ℃退火3 min,每个循环降低2 ℃,72 ℃延伸1 min,共10个降落循环;之后96 ℃变性20 s,50 ℃退火20 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸5 min。利用ABI3730分析系统(Applied Biosystems,Foster City,CA)分析PCR扩增产物。

表2 抗赤霉病基因检测标记信息
2 结果与分析
2.1 黄淮南部麦区小麦品种(系)赤霉病抗性鉴定结果
采用土表接种法对762个黄淮南部麦区小麦品种(系)的赤霉病抗性进行鉴定,综合2016-2017年和2017-2018年的鉴定结果,共鉴定到中抗赤霉病的小麦品种(系)有15个,占品种(系)总数的1.97%(表3),中感赤霉病的小麦品种(系)有133个,占品种(系)总数的17.45%,未鉴定到高抗赤霉病的小麦品种(系)。分析各小麦品种(系)育成单位所在省份和参试区域发现,15个表现为中抗赤霉病的小麦品种(系)中,有10个品种(系)来自安徽省北部,3个品种(系)来自陕西省关中地区,1个品种(系)来自江苏省北部,1个品种(系)来自河南省,说明在黄淮南部麦区新育成品种(系)中,安徽省小麦品种(系)对赤霉病的抗性更为突出。

表3 土表接种鉴定为中抗赤霉病的小麦品种(系)
采用单小花滴注法对15个经土表接种鉴定为中抗赤霉病的小麦品种(系)以及2个多抗性基因聚合的种质材料(K03562、K03566)和4个小麦-长穗偃麦草易位系(山农079-5、山农079-8、山农543648、山农544014)的赤霉病抗性进行鉴定,结果(表4)显示,15个经土表接种鉴定为中抗赤霉病的小麦品种(系)中有9个表现为中抗赤霉病,分别为康F、西农511、陕垦10号、安农1581、财源2号、华齐麦5号、轮选33、庐麦2号和WK1602;小麦-长穗偃麦草易位系中的山农079-8也表现为中抗赤霉病。经土表接种鉴定的15个中抗赤霉病小麦品种(系)中有5个表现为中感赤霉病,分别为绿雨188、大地22、紫麦19、秦农578和瑞麦6号;2个多抗性基因聚合的种质材料以及小麦-长穗偃麦草易位系中的山农544014、山农543648和山农079-5均表现为中感赤霉病。
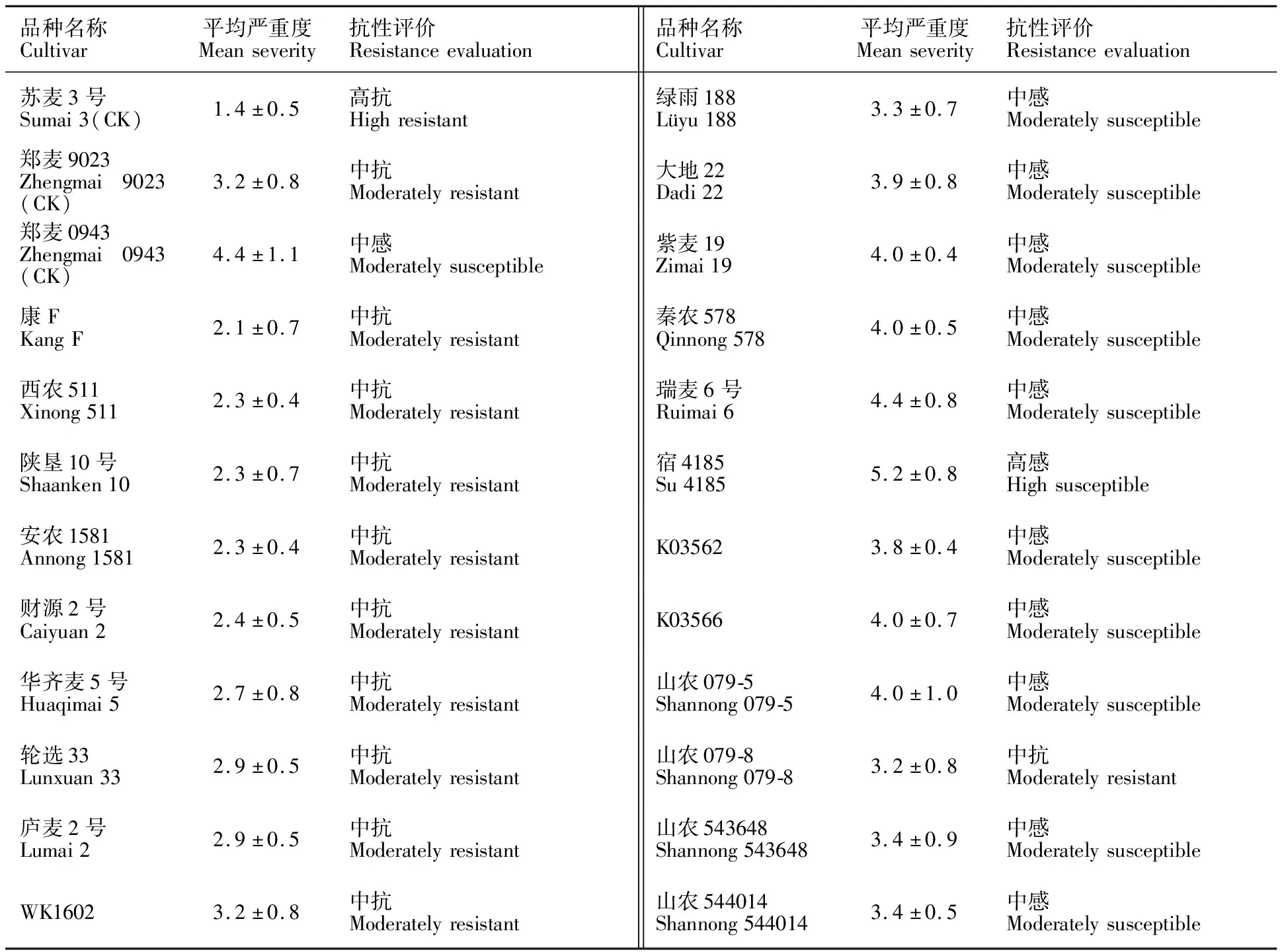
表4 单小花滴注法鉴定结果
2.2 抗赤霉病基因分子标记检测结果
采用与抗赤霉病基因Fhb1、Fhb2、Fhb4、Fhb5和Fhb7相关的分子标记对15个经土表接种鉴定为中抗赤霉病的小麦品种(系)、部分(120个)中感赤霉病的小麦品种(系)、2个多抗性基因聚合的种质材料(K03562、K03566)和4个小麦-长穗偃麦草易位系(山农079-5、山农079-8、山农543648、山农544014)进行检测,结果(表5)显示,经土表接种鉴定为中抗赤霉病的15个小麦品种(系)中,有5个品种(系)含有Fhb1基因,未检测到含有Fhb2、Fhb4、Fhb5和Fhb7基因的品种(系)。部分(120个)中感赤霉病的小麦品种(系)中,有6个品种(系)含有Fhb1基因,也未检测到含有Fhb2、Fhb4、Fhb5和Fhb7基因的品种(系)。多抗性基因聚合材料K03562含有Fhb1、Fhb2和Fhb4基因,K03566含有Fhb1、Fhb2和Fhb5基因。小麦-长穗偃麦草易位系中的山农079-8和山农544014含有Fhb1和Fhb7基因,山农079-5和山农543648只含有Fhb7基因。

表5 抗赤霉病基因分子标记检测结果
3 讨 论
小麦赤霉病在中国黄淮南部麦区的危害逐年加重,除气候和耕作方式变化影响外,抗病品种匮乏也是其重要原因之一,本研究采用土表接种法从762份黄淮南部麦区小麦品种(系)中仅鉴定到15个中抗赤霉病品种(系),且未鉴定到高抗品种(系),该结果表明黄淮南部麦区小麦品种赤霉病抗性普遍较差,抗性品种比例较低,同时还反映出安徽省北部区域小麦品种的赤霉病抗性优于黄淮南部麦区其他地区的小麦品种。
小麦赤霉病抗性是由多基因控制的数量遗传性状,抗性鉴定结果易受环境影响,不利于育种后代的选择[23]。在黄淮南部麦区开展抗赤霉病小麦育种,一方面要建立适宜黄淮南部麦区的抗性鉴定技术和抗性育种圃,为后代材料的选择施加稳定的选择压,另一方面要有农艺性状优良的抗性亲本,本研究鉴定到的抗性品种(系)可作为今后黄淮南部麦区赤霉病抗性育种的重要亲本加以利用。抗侵染、抗扩展和抗毒素积累是小麦对赤霉病的3种抗性形式[24],本研究采用土表接种法和单小花滴注接种法对供试品种(系)的赤霉病抗性进行鉴定,土表接种鉴定反映的是品种(系)抗侵染和抗扩展的综合能力,适用于群体材料的初步筛选和鉴定,而单小花滴注接种鉴定反映的是品种(系)的抗扩展能力,适宜较少数量材料的精准鉴定[25-26]。在抗赤霉病育种后代材料接种鉴定时,低世代材料适合采用土表接种法,高世代材料适合采用单小花滴注接种鉴定。此外,在今后抗赤霉病育种实践中,也应该加强抗毒素积累特性材料的鉴定和选择。
分子标记辅助选择技术具有不受外界环境影响,便于对表型鉴定困难、遗传力低、隐性等性状进行选择,可加速材料创制和品种选育进程,已在小麦多个性状改良上得到成功应用[27-29],但在抗赤霉病小麦品种选育上鲜有成功应用,这主要是缘于小麦赤霉病抗性基因挖掘进展缓慢、抗性材料中的抗性基因组成不明确等问题。本研究采用与Fhb1、Fhb2、Fhb4、Fhb5和Fhb7相关的分子标记对黄淮南部麦区135个经土表接种鉴定为中抗或中感赤霉病的小麦品种(系)进行检测,发现有11个品种(系)含有Fhb1,但仍有124个品种(系)未检测到目标基因。在9个经单小花滴注接种鉴定为中抗赤霉病的黄淮南部麦区小麦品种(系)中,有4个品种(系)被检测到含有Fhb1,其他5个品种(系)未检测到抗性基因,而同时含有3个抗性基因的种质材料K03562和K03566经单小花滴注接种鉴定,发现仅为中感赤霉病。出现这种现象的原因可能有2个:一是同一材料对不同镰刀菌生理小种的抗性表现可能不同,本研究所用菌种是以黄淮南部麦区强致病力菌种为主的混合菌种;二是遗传背景和生态环境可能对抗性基因表达有一定影响,相同抗性基因在不同遗传背景或环境条件下的表达不同。该结果同时也反映出15个中抗品种(系)中还含有其他未知的抗性基因,值得深入研究和挖掘。
本研究显示,苏麦3号含有Fhb1和Fhb2,不含有Fhb5(位于染色体5AS),而在之前的报道中,苏麦3号在5AS上有多个抗性位点[30-31],这可能是由于本次鉴定Fhb5是利用与望水白Fhb5基因相关的分子标记,因此,推测苏麦3号在5AS上的抗性位点与望水白不相同。
目前,虽有很多与赤霉病抗性有关的QTL被定位[32-33],但绝大多数QTL位点效应较小,易受环境和遗传背景影响,鉴定这些QTL在黄淮麦区生态环境和遗传背景下的有效性是其应用于本麦区抗赤霉病分子标记辅助选择育种的前提。目前来自苏麦3号的Fhb1是公认的效应较大且在不同环境和不同遗传背景中较为稳定的抗性基因。本研究通过抗性鉴定结合分子标记检测,筛选出庐麦2号、康F、安农1581等5个中抗赤霉病且含有Fhb1的抗性材料,这为今后黄淮南部麦区抗赤霉病分子标记辅助选择育种提供了材料。同时本研究还发现西农511、陕垦10号等抗性基因尚不明确的抗性材料,这也为今后开展更广泛的研究提供了新的材料选择。
致谢:感谢美国堪萨斯州立大学柏贵华教授、南京农业大学马正强教授和山东农业大学孔令让教授为本研究提供抗赤霉病基因检测标记及对本研究的技术指导。
