炎症性脱髓鞘性多发性神经病急性期临床评价
2020-07-30林秋红周艳英
林秋红 蔡 伦 周艳英
广西中医药大学第一附属医院,广西 南宁 530023
急性炎症性脱髓鞘性多发性神经病(acute inflammatory demyelinating polyneuropathy,AIDP)与慢性炎症性脱髓鞘性多发性神经病急性起病(acute-onset chronic inflammatory demyelinating polyneuropathy,A-CIDP)都是免疫介导的多发性周围性神经病。AIDP患者约97%在4周内达到高峰[1-2],随后进入恢复期,8周后均未恶化。但有8%~16%的AIDP患者在血浆交换或免疫球蛋白最初改善或稳定后不久即出现3次或3次以上恶化,称为治疗相关的波动(treatment-related fluctuations,TRF)[3-4]。而且约5%最初诊断为AIDP的患者最终却诊断为急性起病的慢性炎性脱髓鞘神经病变[5-6]。另一方面,典型的CIDP呈一个隐匿、渐进的过程,持续8周以上[7-8]。其中16%CIDP患者会经历一个急性的起病过程,8周内症状即达到高峰,随后又进入慢性病程。依据病程特点将其称之为A-CIDP[9-10]。这类A-CIDP容易被误诊为AIDP。在疾病早期,区分这两个疾病是重要的。在疾病早期阶段(前4周)两者临床表现和电生理相似[1,7]。但两者的预后和治疗原则存在很大差异,AIDP治疗可单独使用血浆置换或丙种球蛋白,使用糖皮质激素治疗无明确疗效。AIDP患者神经功能在数周至数月内基本恢复,大多数患者有良好的康复倾向[11]。而A-CIDP患者在大多数情况下需要长期使用糖皮质激素治疗[12]或者糖皮质激素联合应用免疫球蛋白、血浆置换治疗。激素使用需维持近6个月,且多数患者常在停止治疗后半年内复发[13],完全恢复仅为4%。及时对两者进行鉴别诊断有利于制定正确的治疗方案和判断预后。本项目回顾性分析AIDP或A-CIDP患者的病例特点,探索两者之间的差异。
1 资料与方法
1.1临床资料广西中医药大学第一附属医院脑病科2012-01—2017-12诊断为AIDP及A-CIDP的18岁以上患者(发病的前8周)共44例。诊断标准分别采用2010年中华医学会神经病学分会神经肌肉病学组制定的中国吉兰-巴雷综合征、中国慢性炎症性多发性神经根神经病的诊断标准。最低随访6个月。评估人口统计学特征、既往病史、在症状出现前1个月的感染性疾病或疫苗接种史。临床表现分为运动或感觉障碍,MRC总分数(Medical Research Council-Sum Scores,MRC-Sum Score)[14]用于评估运动障碍,同时分析脑神经受累情况。所有患者都进行了腰椎穿刺和脑脊液分析,白细胞计数<10×106个/L时认为无脑脊液细胞增多,脑脊液蛋白>0.45g/L时为脑脊液蛋白升高。
1.2电生理检查发病2~4周后对30例AIDP患者和14例A-CIDP患者进行电生理检查。运动神经传导检查尺神经、正中神经、腓总神经和胫神经。顺向感觉神经传导检查正中、尺和腓浅神经。针极肌电图检查胫前肌、腓肠肌。12例A-CIDP患者进行了第二次电生理检查(平均67 d,95%CI56~187 d)。其中2例患者拒绝回院复查肌电图。因AIDP患者神经功能在数周至数月内基本恢复,故未行第二次电生理检查。
2 结果
2.1临床特征及脑脊液结果如表1所示,对44例患者的研究(AIDP 30例,A-CIDP 14例),AIDP和A-CIDP均多见于男性(AIDP 53% vs A-CIDP 72%,P=0.33),发病年龄呈现无显著差异(45岁vs 54.5岁)。2组患者临床前期感染诱因比例无明显差别,1例AIDP患者发病前1个月内接种过疫苗。2组患者大部分都有感觉异常及腱反射减弱或消失。脑脊液白细胞和蛋白质水平无明显差异,而AIDP较少有糖尿病史差异具有统计学意义(3% vs 28%,P=0.03),脑神经功能障碍较多见(56% vs 14%,P=0.01),从发病进展到最高峰的时间较短(8.2 d vs 18.2 d,P=0.04),MRC-总分均值较低(40 vs 50,P=0.01),病情均较重,不能独立行走,部分需要机械通气(7% vs 0%,P=1.0)。

表1 AIDP和A-CIDP患者的临床特征和脑脊液比较 [n(%)]
2.2电生理检查结果如表2所示,AIDP组与A-CIDP组相比,大多数电生理变量差异无统计学意义。AIDP患者mNCV减慢的百分比较低,差异有统计学意义(33% vs 71%,P=0.03);AIDP患者轴索损伤(失神经电位)超过半数(53%),而A-CIDP患者少见,但差异无统计学意义(53% vs 14%,P=0.21)。A-CIDP患者运动末端潜伏期延长、传导阻滞、F波潜伏期延长等脱髓鞘特征的百分比较高,但差异无统计学意义;在第二次肌电图中,A-CIDP组脱髓鞘特征较前更为明显百分比为83%。
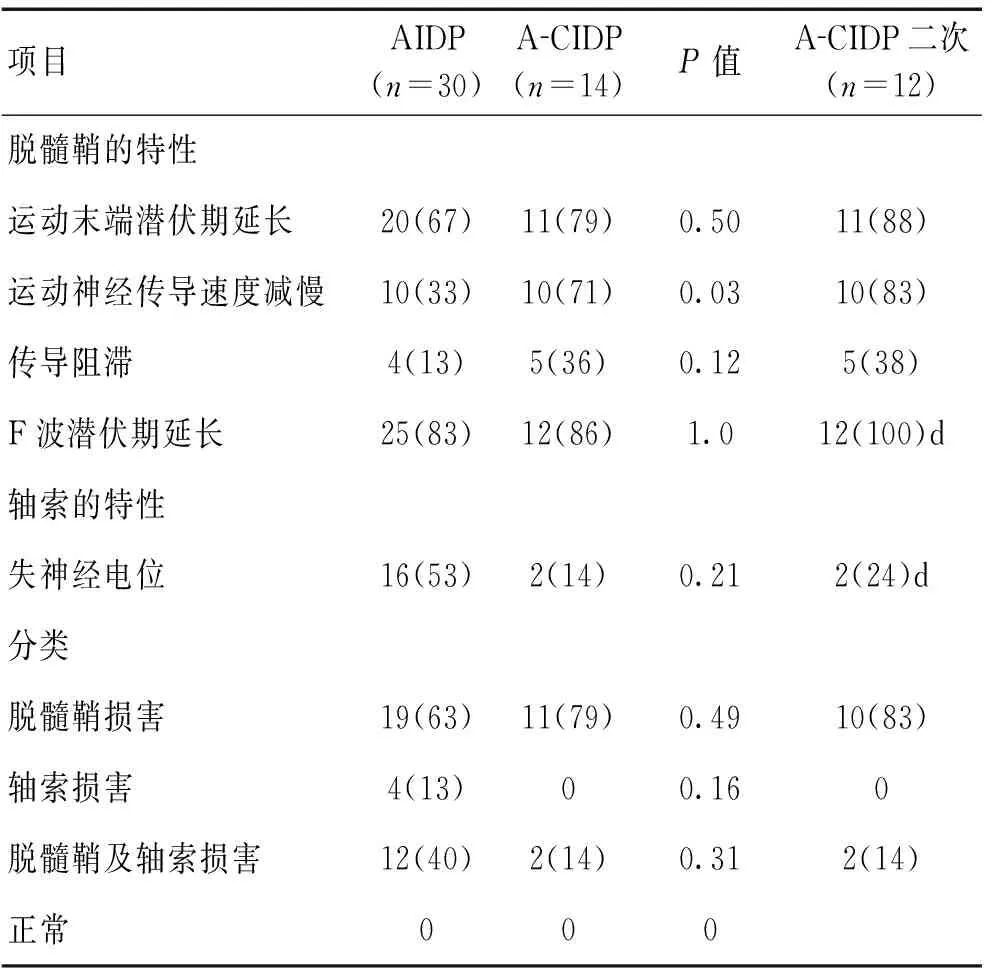
表2 AIDP患者和A-CIDP患者的电生理表现 [n(%)]
3 讨论
本研究显示AIDP和A-CIDP在疾病的早期阶段临床特征、脑脊液检查及电生理检查部分结果相似且无显著差异,如2组患者均多见于男性,发病年龄无显著差异;2组临床前期感染诱因比例无明显差别;2组大部分都有感觉异常及腱反射减弱或消失,脑脊液蛋白-细胞学分离和蛋白质水平无明显差异,且大部分电生理变量差异无统计学意义。但还是发现AIDP和A-CIDP在疾病的早期阶段临床特征有不同之处,如糖尿病史在A-CIDP患者中更为常见,但有学者认为目前糖尿病与A-CIDP之间的关联仍存在争议[15-16]。A-CIDP组脑神经功能障碍明显比AIDP减少,本研究中A-CIDP脑神经损害比例14%,其他相关研究中脑神经损害的比例分别是13%和20%[9,15,17]。AIDP组从发病进展到高峰时间与A-CIDP相比明显缩短,AIDP很少经历复发,且MRC总分也较低,残疾严重程度评分也较高,较少的患者能独立行走,部分患者需要机械通气。而A-CIDP患者无1例需要机械通气。该结果与之前的研究结果相似[2]。
在之前的神经电生理研究中认为疾病早期不能有效地区分A-CIDP和AIDP[8-9],只有在AIDP后期出现明显的持续的脱髓鞘改变时才能区分。但研究中AIDP组mNCV 减慢的百分比较低,差异有统计学意义(P<0.05)。同时发现,虽然2组间轴索损伤(失神经电位)差异无统计学意义,然而失神经电位在A-CIDP组中很少见,而超过半数的AIDP患者在急性期表现为轴索损伤,这有助于早期及时区分二者。在A-CIDP组的第二次肌电图中A-CIDP组脱髓鞘特征较前更为明显比例增加至83%,这与之前研究显示长期脱髓鞘在A-CIDP患者中是恒定的一致[18]。
通过对AIDP和A-CIDP患者临床特征和电生理特征的分析,从几个方面对两者进行区分。当患者从发病进展到病情最高峰为8 d左右,表现为脑神经功能障碍,MRC总分较低,尤其当病情达高峰时不能独立行走,需要机械通气,且在发病8周后无再次恶化,运动神经传导减慢比例较低且有轴索损伤(失神经电位),则应考虑诊断AIDP的诊断,反之则考虑A-CIDP。并各自予相应维持治疗。虽然从表现形式和诊断检查的角度来看,可能没有必要区分AIDP和A-CIDP,然而,识别复发或进一步进展的可能性相关的危险因素可能对预后和治疗有用。
