p53和EGFR在大肠腺瘤及大肠癌组织中的表达及临床意义
2020-07-30陈康部
陈康部
近年消化道恶性肿瘤患者逐渐增多,大肠癌是较为严重的消化道恶性肿瘤。大肠癌的发展较为漫长,它是由正常的肠上皮组织逐渐演变为腺瘤最后变为恶性癌,因此,在肠上皮组织癌变之前,大肠腺瘤可以作为癌变的标志之一[1,2]。为尽量减少大肠癌的发生,通常在大肠腺瘤期进行内镜下腺瘤摘除手术,术后再次复发演变成大肠癌的机率极低。大肠腺瘤的种类分两种,一种为直径小于5mm 的腺瘤,癌变机率较小,临床上可以切除或者不切除将其保留[3,4];另一种是直径大于5mm 的腺瘤,这种腺瘤需要及时处理留取标本进行病理检查,其癌变的机率较大。因此,通过腺瘤的形态改变可以判断出腺瘤的癌变情况,通过形态特征和基因结构表达来判断是否含有有风险的腺瘤结构,并且给予早期预防和控制,进而控制大肠癌的进一步发展,对预防大肠癌有非常重要的作用[5,6]。目前,通过各种医学途径均可证明大肠癌是通过多种基因信号的异常积累所导致,p53 和EGFR 的表达也成为大肠腺瘤恶性演变为大肠癌的重要表达因子。本研究选取我院2017年1月~2018年12月收治的大肠癌、大肠腺瘤以及正常结肠粘膜患者各50 例,通过分析三组患者中p53 和EGFR 的表达及其与临床特征的关系,研究其对大肠癌发展的重要影响,进而对日后大肠癌的预后起到重要作用。
1 材料与方法
1.1 一般资料选取我院2017年1月~2018年12月收治的大肠癌、大肠腺瘤以及正常结肠粘膜患者各50 例。大肠癌患者中女24 例,男26 例,年龄32~91 岁,平均(45.78±10.23)岁;大肠腺瘤患者中女15例,男35例,年龄21~79岁,平均(46.12±9.34)岁;正常结肠粘膜患者中女16 例,男34 例,年龄23~63 岁,平均(45.86±9.65)岁。三组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准所有组织经病理检查证实且均含有癌性与癌旁组织;患者术前均未经过任何抗癌治疗且均行HE 染色明确病理类型。
1.3 方法正常大肠组织由肠镜下活检取出,大肠腺瘤经肠镜下整体电切后取出,大肠癌诊断均经肠镜组织活检或手术组织病理学检查确诊。三组标本均在手术中切除新鲜组织后经10%中性福尔马林固定,常规石蜡包埋,4µm 连续切片,采用免疫组化Envision 法对组织中EGFR、p53 进行检测。
1.4 诊断标准根据阳性及阴性对照显色情况,确定无假阳性及假阴性前提下,EGFR 染色定位于细胞胞膜和(或)胞浆,呈棕色;p53 染色定位于细胞胞核,以胞核内有棕黄色颗粒为阳性细胞,凡胞浆有棕黄色着色的不计入阳性细胞内,而作为阴性处 理[7]。低倍镜下选取阳性细胞最密集区,高倍镜下计数肿瘤细胞。EGFR 阴性为无阳性结果表达或非特异着色,>10%区域阳性表达且胞膜显色不连续为+,>10%区域阳性表达且胞膜显色连续,未形成完整细胞膜形态为++,>10%区域阳性表达且胞膜显色连续,形成完整细胞膜形态为+++。p53 阴性为阳性癌细胞计数<10%,10%~25%为+,25%~50%为++,>50%为+++。所有+以上的切片均由两位资深的病理医师进行双盲观察[8]。
1.5 统计学方法采用SPSS 13.0 软件对所得数据进行统计分析,计量资料用±s表示,比较采用t检验,组间比较采用非参数秩和检验;计数资料以率(%)表示,比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 三组标本中p53 和EGFR 的表达情况p53和EGFR 在细胞质和细胞膜内均有表达,p53 在大肠癌、大肠腺瘤以及正常结肠粘膜的表达阳性率分别为74.00%、62.00%、0,差异具有统计学意义(P<0.05);EGFR 在大肠癌、大肠腺瘤以及正常结肠粘膜的表达阳性率分别为76.00%、64.00%、0,差异具有统计学意义(P<0.05)。见表1。

表1 三组标本中p53 和EGFR 的表达情况[n(%)]
2.2 大肠癌中p53 和EGFR 表达与临床表现特征的关系p53 与分化程度:低分化及中-低分化p53的表达阳性率明显高于中分化(P<0.05);而低分化与中-低分化p53 的表达阳性率相当,差异无统计学意义(P>0.05)。p53 与浸润深度:T2、T3 和T4 的p53 的表达阳性率明显高于T1(P<0.05)。EGFR与分化程度:低分化及中-低分化的表达阳性率明显高于中分化(P<0.05),而低分化与中-低分化的表达阳性率相当,差异无统计学意义(P>0.05)。EGFR 与浸润深度:T2、T3 和T4 的EGFR 的表达阳性率明显高于T1(P<0.05)。p53 和EGFR 表达在年龄和有无淋巴结转移中的差异具有统计学意义(P<0.05)。见表2。
2.3 大肠癌中p53 和EGFR 表达与Dukes 分期的相关性随着Dukes 分期的逐渐升高,p53 和EGFR 表达的阳性率也逐渐升高,p53 和EGFR 在患者体内的表达与大肠癌的癌变程度均呈正相关,相关系数分别为rp53=0.520,rEGFR=0.518,P<0.05。见表3。
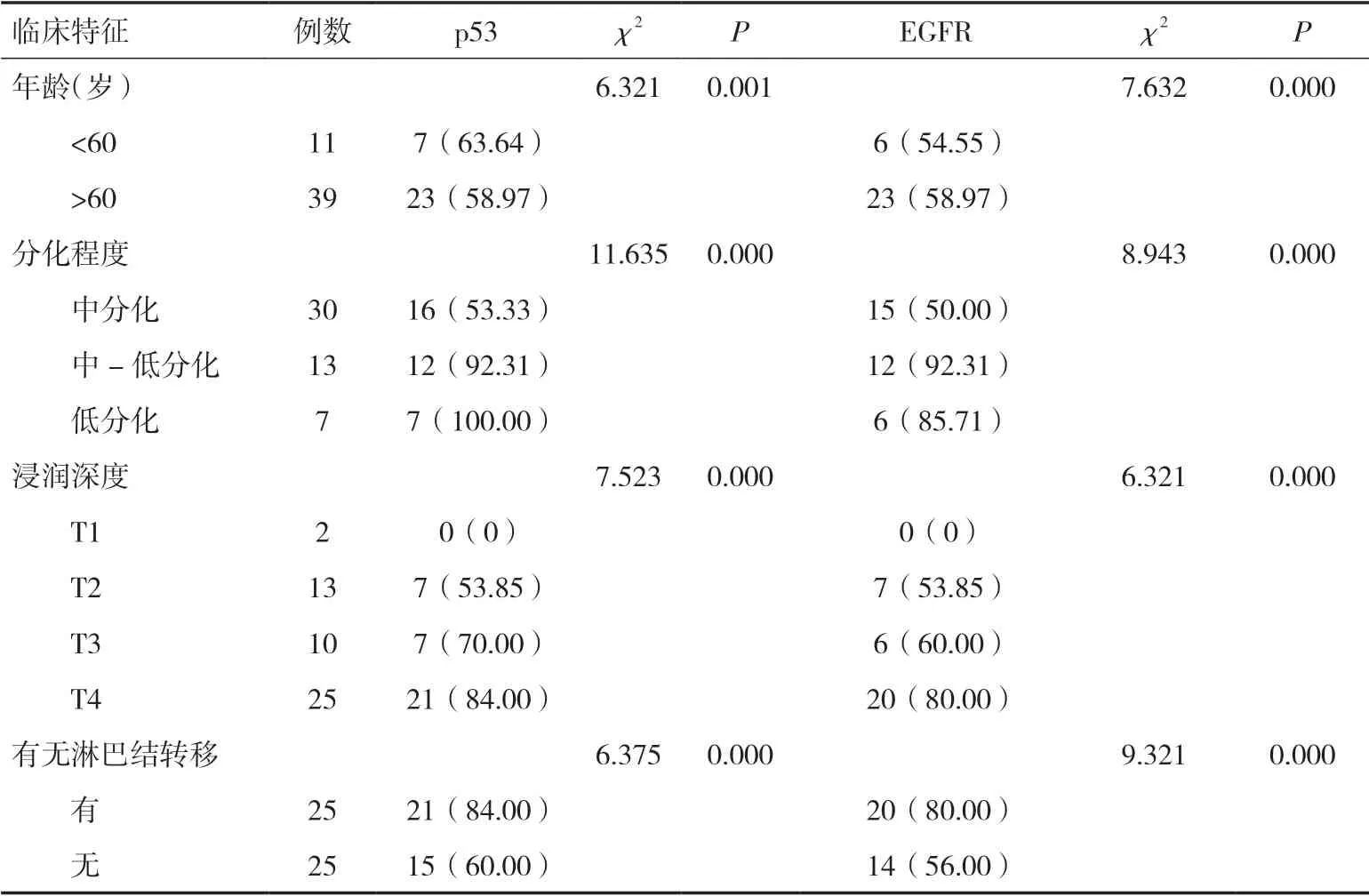
表2 大肠癌中p53 和EGFR 表达与临床特征的关系[n(%)]

表3 大肠癌中p53 和EGFR 表达与Dukes 分期的相关性
3 讨论
大肠癌作为一种较为严重的消化道恶性肿瘤,其发展过程也较为复杂,一些正常的大肠黏膜可以转化为良性的大肠腺瘤,而有些大肠黏膜会因为一些恶性基因的积累导致转变为大肠癌[9,10]。大肠癌在50~70 岁人群中发病率较高,而且我国每年的大肠癌发病率都在逐渐升高,一些患者不注重恶性肿瘤的发展最终导致死亡[11]。由于生活水平的不断提高,不良饮食习惯也给患者带来了不良影响,使大肠癌发病率逐年上升[12]。p53 是一种可以参与细胞增殖分裂并能抑制肿瘤发展的基因,它通过负调节作用控制体内的癌细胞发展。而突变后的p53 失去了对细胞增殖分化的控制功能,导致突变的p53 和野生p53 不断结合积累,引起不良基因的积累,进一步导致肿瘤的发生[13]。研究表明,在大肠癌患者体内,癌变越严重体内突变的p53 含量越多,表达阳性率也越高[14]。原癌基因c-erbB-1 的表达产物为表皮生长因子受体(EGFR),正常细胞中EGFR 含量是正常的,而癌变细胞中EGFR 含量会表达过多过强。研究表明[15,16],p53 和EGFR 的表达与浸润深度和分化程度有一定的关系,而和有无淋巴转移及年龄也有较大关系。根据Dukes 的分期可以表明,D 期p53 和DGFR 的表达最高,阳性率也随着期数的下降而降低,p53 和EGFR 的表达与大肠癌的癌变程度呈正相关。
本研究表明,p53 和EGFR 在细胞质和细胞膜内均有表达,p53 在大肠癌、大肠腺瘤以及正常结肠粘膜的表达阳性率分别为74.00%、62.00%、0,EGFR在大肠癌、大肠腺瘤以及正常结肠粘膜的表达阳性率分别为76.00%、64.00%、0。p53 在不同分化程度组织中,低分化及中-低分化的表达阳性率明显高于中分化,而低分化与中-低分化的表达阳性率相当。p53 在不同浸润深度中,T2、T3 和T4 的表达阳性率明显高于T1。EGFR 在不同分化程度中,低分化及中-低分化的表达阳性率明显高于中分化,而低分化与中-低分化的表达阳性率相当。p53 和EGFR 表达在年龄和有无淋巴结转移中也有差异。大肠癌中p53 和EGFR 表达与Dukes 分期的相关性可见,随着Dukes 分期的升高,p53 和EGFR 表达阳性率也逐渐升高,p53 和EGFR 在患者体内的表达与大肠癌的癌变程度呈正相关。因此,分化程度越高的肿瘤患者体内,p53 和EGFR 的表达阳性率也越高,与癌变程度呈正相关,说明p53 和EGFR 可以作为筛查大肠癌的重要标准。
综上所述,p53 和EGFR 的表达对肿瘤的浸润深度、转移程度、分化程度都有直接的影响。因此p53 和EGFR 的表达可以作为大肠腺瘤及大肠癌组织中的早期诊断指标,通过监测p53 和EGFR 在体内表达可以判断患者的大肠组织是否有癌变的可能性,对肿瘤预后程度的判断提供较可靠的依据,值得临床推广。
