禾谷镰刀菌 Tri8基因敲除及产毒类型分析
2020-07-30李添梦胡小平杜光源范三红
李添梦,胡小平,杜光源,范三红
(1.西北农林科技大学生命科学学院,陕西杨凌 712100;2.西北农林科技大学理学院,陕西杨凌 712100;3.西北农林科技大学植物保护学院,陕西杨凌 712100)
赤霉病(Fusarium head blight)是影响小麦产量和品质的主要病害[1],该病害由禾谷镰刀菌复合种(Fusariumgraminearumspecies complex,FGSC)引起,不同地域复合种的组成有所不同。引起我国小麦赤霉病的主要病原菌为禾谷镰刀菌和亚洲镰刀菌,其中小麦玉米轮作区以禾谷镰刀菌为主,小麦水稻轮作区以亚洲镰刀菌为主[2-3]。赤霉病病原菌主要侵染小麦穗部,会引起籽粒发育不良,病原菌合成的毒素在籽粒中的累积,还会对人畜健康和食品安全造成严重威胁[4-6]。
禾谷镰刀菌可以合成单端孢霉烯族的真菌毒素,常见的类型有4种:脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、3-乙酰脱氧雪腐镰刀菌烯醇(3-AcDON)、15-乙酰脱氧雪腐镰刀菌烯醇(15-AcDON)和雪腐镰刀菌烯醇(nivalend,NIV)[7-8],其中DON是带病小麦籽粒中毒素的主要存在形式。DON毒素可以干扰核糖体肽基转移酶的活性,阻碍核糖体的正常循环,从而抑制胞内蛋白质的合成[9]。大量摄入DON会引起急性中毒[10-11],主要表现有头疼、头晕、呕吐及中枢神经系统紊乱[12]。因而,赤霉菌毒素导致的食品安全问题引起国家管理部门及研究者的高度关注。
镰刀菌中参与毒素合成的基因有12~16个[13],命名为Tri基因,不同菌株参与的基因数目有所不同。这些基因主要集中在两个基因簇中,其中最大的一个基因簇命名为Tri5,包含了Tri3、Tri4、Tri5、Tri6、Tri7、Tri8、Tri9、Tri10、Tri11、Tri12、Tri13和Tri14共12个Tri基因;另一个基因簇中包含了Tri1和Tri16两个基因,Tri15和Tri101游离于上述基因簇之外[14]。DON生物合成的直接前体为法尼基焦磷酸(FPP),在Tri5基因编码产物的催化下,法尼基首先环化形成单端孢霉二烯(TDN)[15];在Tri4编码的P450家族单加氧酶催化下进行3次羟化反应和1次环加氧反应,形成异构单端孢霉三醇[16-17];该化合物可自发脱水环化形成异构木霉菌醇;在Tri101、Tri11和Tri3编码产物催化下进行1次羟基化和2次乙酰化形成丽赤壳菌素(CAL);CAL在Tri1编码的P450羟化酶催化下,在7,8两个位置引入2个羟基[18],最终形成DON前体3,15-diAcDON;Tri8编码分泌型酯酶,可催化3,15-diAcDON 3位或15位乙酰基的水解,从而形成3-AcDON或15-AcDON[19],不同的镰刀菌编码的Tri8基因有所不同,有些可催化3位乙酰基的水解,而其他则催化15位乙酰基的水解[20];3-AcDON或15-AcDON可自发,或在病菌或植物酯酶的催化下水解剩余的乙酰基,最终形成DON。
研究表明,亚洲镰刀菌(F.asiaticum)主要产生3-AcDON和NIV类型毒素,而禾谷镰刀菌(F.graminearum)主要产生15-AcDON[21]。其中NIV类型菌株产生的NIV毒素含量极低。本研究利用基因敲除技术获得Tri8基因缺失的禾谷镰刀菌株系,并对其产生毒素的类型进行了定性分析,以期为DON合成前体3,15-diAcDON的制备及Tri8蛋白体外活性分析奠定基础。
1 材料与方法
1.1 供试材料
禾谷镰刀菌野生型菌株PH-1和农杆菌菌株EHA105由本实验室保存,载体pOSCAR和pA-HYG-OSCAR由本实验室保存,PrimerSTAR DNA polymerase、PstI、BamHI、HindIII和XhoI购自Takara公司(大连),DNA快速提取试剂盒(DSBIN1151)购自广州东盛生物科技有限公司,DNA凝胶回收试剂盒购自天根生化科技(北京)有限公司,无缝克隆试剂盒CloneExpressTM为南京诺唯赞生物科技公司。混合毒素标准品购自北纳创联生物科技有限公司(北京)。
1.2 方 法
1.2.1 基因敲除载体构建
利用CTAB法提取野生型禾谷镰刀菌菌株PH-1基因组DNA,以其为模板,利用引物Tri8-wf-uF/uR和Tri8-wf-dF/dR(表1)分别扩增Tri8基因上下游片段Tri8-up和Tri8-down,其长度分别为1 078 bp和1 213 bp。PCR反应体系为:100 ng· μL-1的DNA模板0.5 μL、10 μmol·L-1的正反向引物各0.5 μL、2×Buffer 12.5 μL、2.5 mmol·L-1的dNTP 0.5 μL、1 U· μL-1的KOD酶0.5 μL、灭菌蒸馏水补足至25 μL。PCR 反应程序为:95 ℃预变性5 min;98 ℃变性10 s,65 ℃退火20 s,72 ℃延伸1.5 min,共35个循环;72 ℃延伸7 min。利用PstI、BamHI酶切载体pA-HYG-OSCAR,并通过胶回收获得1 425 bp的抗性基因片段HYG。

表1 引物序列
通过重叠PCR对上述三个片段进行连接(顺序为Tri8-up、HYG、Tri8-down)。PCR反应体系为:100 ng· μL-1的Tri8-up、Tri8-down和HYG基因片段各0.5 μL、2×Buffer 12.5 μL、2.5 mmol·L-1dNTP 0.5 μL、1 U· μL-1KOD酶0.5 μL、灭菌蒸馏水补足至25 μL。前期PCR反应体系为:95 ℃预变性5 min;98 ℃变性10 s,45 ℃退火20 s,72 ℃延伸3.2 min,5个循环;72 ℃延伸7 min。以上反应体系不加入引物,反应结束后加入引物Tri8-wf-uF、Tri8-wf-dR各 0.5 μL,后期PCR反应体系为;95 ℃变性5 min,98 ℃变性10 s,60 ℃退火20 s,72 ℃延伸3.2 min,35个循环;72 ℃延伸7 min。利用HindIII、XhoI对pOSCAR载体进行双酶切,切胶回收并利用无缝克隆将其与通过重叠PCR获得的Tri8-up-HYG-Tri8-down片段进行连接,转化筛选最终获得Tri8基因敲除载体pOSCAR-△Tri8。
1.2.2 农杆菌介导的转化
利用农杆菌(EHA105)介导的转化法将基因敲除载体pOSCAR-△Tir8转至PH-1野生菌株,具体过程参考Zahi等[22]的报道。在阳性基因敲除菌株筛选过程中,首先利用引物HYG-F/R扩增HYG基因,初步判断Tri8基因敲除是否成功,之后利用引物Tri8-F/R扩增Tri8基因,进一步确定Tri8基因是否成功敲除。
1.2.3 基因敲除菌株与原始菌株的产毒类性 分析
将对照菌株和Tri8基因敲除菌株接种于PDA培养基,置于25 ℃恒温箱活化3~5 d,挑取菌块接种至CMC培养基中,25 ℃ 200 r·min-1培养3 d。培养液用滤布过滤获得孢子液。将孢子液加入大米培养基中,25 ℃黑暗条件下培养 30 d,取出培养基液氮速冻后研磨至粉末状,加入400 mL甲醇,200 r·min-125 ℃过夜抽提。将培养物用三层滤纸过滤,滤液40 ℃旋转蒸馏,浓缩至50 mL,-20 ℃保存。

2 结果与分析
2.1 基因敲除载体pOSCAR-△ Tri8的构建
Tri8基因敲除载体构建流程如图2所示。依据禾谷镰刀菌基因组序列设计Tri8基因上下游扩增引物,并以基因组为模版扩增获得上下游片段Tri8-up(1 078 bp)和Tri8-down(1 213 bp)。PstI、BamHI双酶切pA-HYG-OSCAR质粒,通过胶回收获得潮霉素抗性基因编码片段HYG(1 425 bp)。然后利用重叠PCR技术将三者连接获得敲除片段Tri8-up:HYG:Tri8-down。HindIII、XhoI双酶切pOSCAR载体,切胶回收获得包含T-DNA左右边界的载体,然后通过无缝克隆技术将其与敲除片断连接,最终获得敲除载体pOSCAR-△Tri8。利用PCR方法对敲除载体进行初步筛选,然后将阳性重组子送至杨凌天润奥科生物科技有限公司进行测序验证。测序结果显示,构建的敲除载体pOSCAR-△Tri8的序列与设计完全一致。
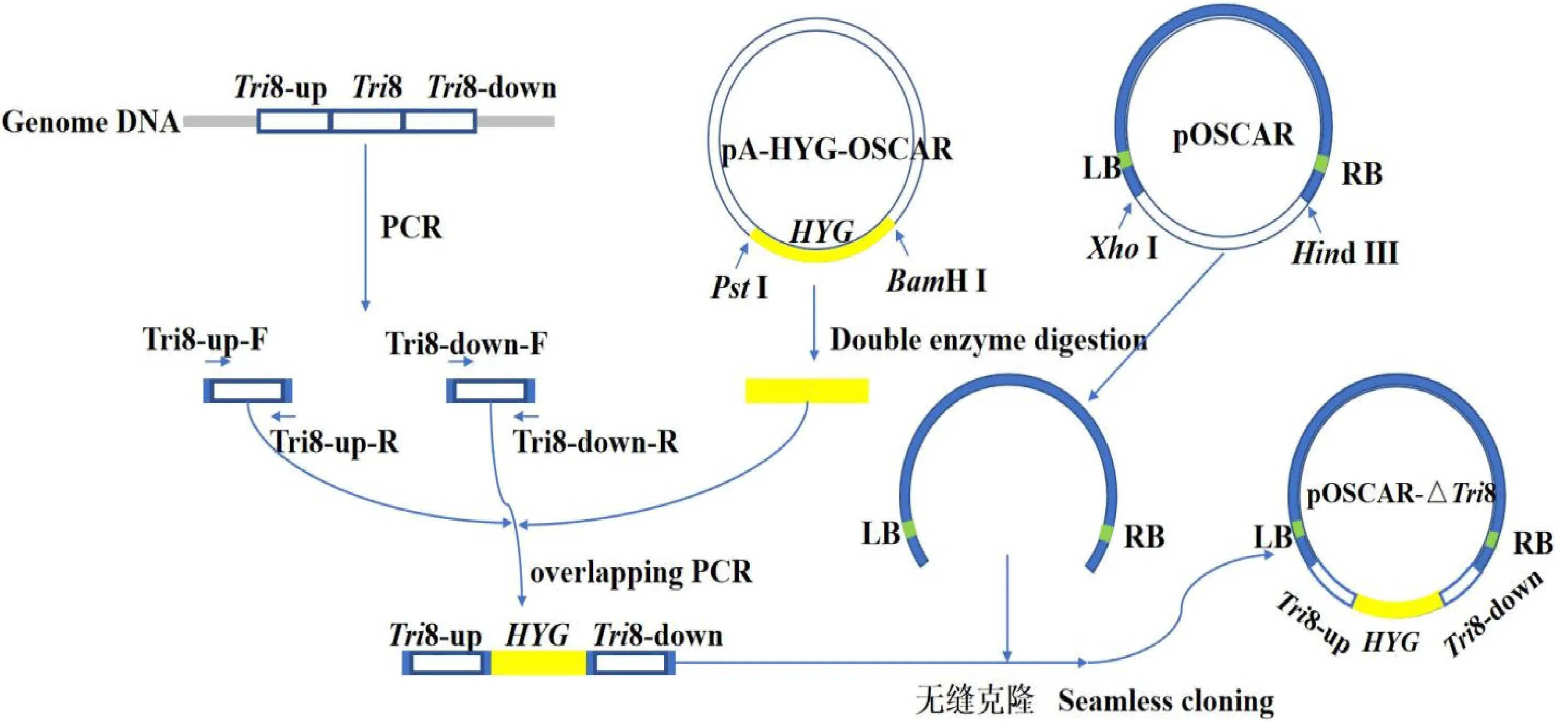
图1 基因敲除载体pOSCAR-△ Tri8构建流程
2.2 基因敲除株系的筛选与鉴定结果
本研究利用农杆菌介导的遗传转化方法将敲除片段导入禾谷镰刀菌PH-1中,利用同源重组机制将原有的Tri8置换为潮霉素抗性基因HYG。首先利用电激法将敲除载体pOSCAR-△Tri8导入农杆菌EHA105中,将其与镰刀菌PH-1的孢子进行孵育,然后置于含有潮霉素的PDA平板进行筛选。提取阳性菌斑DNA,分别利用潮霉素抗性基因特异引物HYG-F/R和Tri8基因特异引物Tri8-F/R进行PCR扩增验证,能扩增出HYG对应片段而不能扩增出Tri8对应片段的株系则为Tri8基因敲除株系PH-1-△Tri8。选取20个菌株提取基因组DNA进行PCR检测,结果显示大部分样品均扩增出896 bp的潮霉素抗性基因特异条带(图2A)。但候选敲除菌株样品6和18菌株菌丝较少,未成功提取其基因组DNA,故未成功扩增出896 bp的潮霉素抗性基因特异条带。结果表明,除了野生菌株PH-1外,其他候选敲除菌株样品中均未扩增出Tri8基因对应的1 388 bp特异条带(图2B),说明候选敲除菌株中(除样品6和18)的Tri8基因已被HYG基因替换。

A:HYG基因扩增结果; B: Tri8基因扩增结果; M:1 kb DNA Ladder; 1:野生型菌株PH-1; 2~21:候选敲除菌株。
2.3 基因敲除株系的产毒类型检测结果
按照材料与方法1.2.3所示流程对野生型菌株PH-1和Tri8基因敲除株系进行产毒培养,利用高分辨离子淌度液质联用仪对粗提液的组分进行定性分析。发现野生型菌株中出峰时间为 4.97~5.00 min 的DON为最主要成分,同时存在少量的3-AcDON或15-AcDON,其出峰时间为5.98~6.00 min(图3A);Tri8敲除株系中3-AcDON或15-AcDON含量最高,含有少量DON,在出峰时间6.48~6.51 min处出现第三个主峰,依据相对分子质量判断此峰为3,15-diAcDON。与野生型菌株相比,Tri8基因敲除株系不同菌株的DON相关组分含量变化一致,均出现一定程度DON前体3,15-diAcDON的累积。
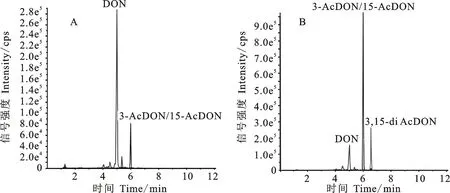
A:野生型菌株PH-1; B: Tri8基因敲除菌株。
3 讨 论
由于赤霉菌毒素会对人畜健康造成严重威胁,因而赤霉菌毒素生物合成、分泌及调控机制一直是赤霉病研究的热点[24]。Tri8编码一种分泌型酯酶,可将禾谷镰刀菌合成并转运至胞外的毒素前体3,15-diAcDON上的乙酰基水解移除,形成只包含一个乙酰基的衍生物15-AcDON或3-AcDON[19],后者可自发或在其他病原菌或宿主酯酶作用下移除另一个乙酰基,最终形成DON。刘杨杨等[21]研究表明,PH-1菌株产毒类型主要为15-AcDON,即其Tri8编码酯酶可催化双乙酰前体3位乙酰基的水解。本实验结果显示,野生型菌株PH-1的毒素组分主要为DON,少量为 3/15-AcDON,而非理论上的以15-AcDON为主。表明在我们所给的实验条件下[25],大部分15-AcDON可进一步自发或在其他酯酶催化下水解剩余的15位的乙酰基形成DON。实验结果同时显示,Tri8基因敲除株系产生的毒素以3/15-AcDON为主,并存在少量DON和3,15-diAcDON,而非理论上以3,15-diAcDON前体为主。考虑到野生型对照中大部分15-AcDON会因为自发或在其他病原菌或宿主酯酶作用下移除另一个乙酰基转化为DON,因而突变体中大部分3,15-diAcDON被转化为3/15-AcDON也在情理之中。无论如何上述结果都能说明,Tri8基因敲除会导致双乙酰毒素前体的累积。
Tri8酯酶催化3,15-diAcDON乙酰基水解,是DON毒素合成和活化的重要步骤,要阐明该酶的催化机制首选需要制备出该酶足够的底物3,15-diAcDON。本研究创制Tri8基因缺失突变体的初衷就是为了让3,15-diAcDON在培养基中积累,然后抽提、分离制备获得3,15-diAcDON。从已有的结果来看,Tri8基因的敲除的确可以导致3,15-diAcDON的累积,但大部分又自发转化为3/15-AcDON。在后续研究中应进一步优化培养条件,减少3,15-diAcDON的自发转化,实现3,15-diAcDON的大量累积,为后续Tri8基因结构和功能研究奠定基础。
4 结 论
本研究利用重叠PCR和无缝克隆技术构建了禾谷镰刀菌Tri8基因敲除载体pOSCAR-△Tri8,并利用农杆菌介导的转化筛选鉴定出Tri8
