以肾上腺皮质癌为首要表现的多发性内分泌腺瘤病1型一例
2020-07-30纪群全会标陈开宁陈存仁王斐方团育
纪群 全会标 陈开宁 陈存仁 王斐 方团育
患者,女,64岁,因“发现血糖升高10年,双足破溃半个月”于2018年7月3日入我科。患者10年前因体检发现血糖升高诊断为“2型糖尿病”,未治疗,3年前曾短期使用胰岛素降糖,后自行停用,未监测血糖,半个月前出现双足第一足趾溃烂,伴流脓。既往史:高血压病病史1年,未服用降压药物,曾因腰椎间盘突出行手术治疗,否认糖皮质激素使用史及胰腺炎病史;15岁月经初潮,周期规律,45岁绝经,绝经后无异常阴道出血,曾因“宫外孕”行右侧输卵管切除术,后未再生育;否认糖尿病家族史。为求进一步治疗来我院,门诊以“糖尿病足”收入我科。入院体格检查:体温36.3 ℃,脉搏87次/分,呼吸20次/分,血压146/89 mmHg,神志清楚,营养中等,满月脸、多血质,皮肤菲薄,无向心性肥胖、水牛背、皮肤紫纹、肢端肥大。毛发浓密,唇部可见髭毛,乳房可见短毛,心、肺、腹及神经系统体格检查无明显异常,双下肢无水肿,双足第一足趾破溃、流脓。辅助检查:肾上腺相关检查:血钾2.78 mmol/L(3.50~5.30 mmo/L,括号内为正常参考值范围,以下相同),血钠144.5 mmol/L(137.0~147.0 mmol/L);早晨8时、下午4时及午夜12时的促肾上腺皮质激素(ACTH)水平分别为1.0 pg/ml、1.0 pg/ml、1.0 pg/ml(7.2~63.3 pg/ml),早晨8时、下午4时及午夜12时的皮质醇(CORT)水平分别为658 nmol/L、602 nmol/L、646 nmol/L(79~535 nmol/L)。性激素:睾酮(T)6.80 nmol/L(0.34~1.28 nmol/L),促黄体激素(LH)0.11 U/L(0.56~14.00 U/L),卵泡刺激素(FSH)0.37 U/L(1.38~5.47 U/L)。24小时尿香草苦杏仁酸(VMA)阴性,血肾上腺素、去甲肾上腺素、多巴胺水平正常,肾素-血管紧张素-醛固酮系统:肾素活性、血管紧张素、醛固酮水平正常,血浆醛固酮浓度/血浆肾素浓度比值正常,卧立位试验结果正常。肿瘤标志物:甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原(CA)125、神经元特异性烯醇化酶(NSE)、CA19-9、CA242、CA15-3结果均为阴性。肾上腺CT(平扫+增强)检查结果:左侧肾上腺区占位,大小为7.0 cm×5.1 cm,考虑肿瘤性病变,肾上腺皮质腺癌?病灶下极似见一粗大引流静脉汇入左肾静脉,伴左肾静脉癌栓形成。腹腔及腹主动脉旁多个淋巴结可见(图1)。甲状旁腺相关检查结果:甲状旁腺激素(PTH)163.0 pg/ml(15.0~68.3 pg/ml),血磷0.45 mmol/L(0.85~1.51 mmol/L),白蛋白校正后血钙2.99 mmol/L(2.1~2.5 mmol/L);肝功能检查结果:总蛋白54.9 g/L(65.0~85.0 g/L),白蛋白26.4 g/L(40.0~55.0 g/L);尿磷17.9 mmol/24 h(13.0~42.0 mmol/24 h),尿钙4.54 mmol/24 h(2.50~7.50 mmol/24 h),25-羟维生素D 23.1 ng/ml(>30.0 ng/ml)。甲状旁腺静态显像(ECT)检查结果:延迟3小时显像右侧甲状旁腺局限性浓聚影像。胰腺及胰岛功能检查结果:血淀粉酶、脂肪酶均正常,糖化血红蛋白14.2%,胰岛功能:0 min C肽0.25 nmol/L(0.37~1.47 nmol/L),120 min C肽0.74 nmol/L;糖尿病免疫三项检查结果:胰岛素抗体(IAA)、胰岛细胞抗体(ICA)、谷氨酸脱羧酶抗体(GADA)均为阴性。胰腺CT检查结果:胰腺萎缩,动脉期实质内见多发小结节状明显强化灶,最大者直径约0.5 cm,部分静脉期及延迟期仍呈可见强化,余呈等密度(图2)。其他相关检查结果:血常规结果:WBC计数14.32×109/L、中性粒细胞百分比90.0%。甲状腺功能正常。垂体MRI检查未见异常。经多发性内分泌腺瘤病1型(MEN1)基因全外显子检测,发现一个杂合致病突变c.594G>A(p.W198*),见图3。初步诊断:MEN1。给予患者甘精胰岛素12 U+赖脯胰岛素(早10 U、中8 U、晚8 U)皮下注射联合二甲双胍0.5 g每日3次口服降糖、哌拉西林舒巴坦3.0 g每12小时1次静脉滴注抗感染、硝苯地平控释片30 mg每日1次口服降压治疗,给于足部清创换药和负压吸引。建议手术切除肾上腺肿瘤,但患者及家属因个人原因拒绝。3个月后患者死亡。
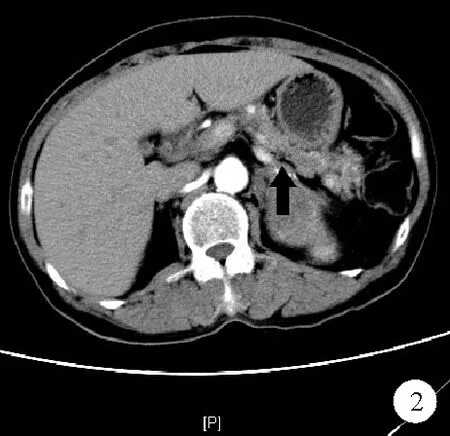
图2 患者胰腺增强CT检查结果:动脉期实质内见多发小结节状明显强化灶,胰腺萎缩,如箭头所示

图3 患者MEN1基因测序图:c.594G>A(p.W198*)
讨 论
MEN1是一种同时或先后发生两种或两种以上的内分泌腺体肿瘤,是一种以增生为特征的常染色体显性遗传病,典型表现为甲状旁腺功能亢进(90%)、胰腺神经内分泌肿瘤(60%)、垂体前叶瘤(40%)、肾上腺皮质肿瘤(40%)[1]等。MEN1患者的肾上腺病变大多为无功能的增生或腺瘤,肾上腺皮质癌较少见,总发病率为MEN1中的2.6%~6.0%[2]。本例患者为中年女性,有多血质面容、多毛体征及高血压、低血钾、肾上腺占位,故不能排除肾上腺肿瘤可能;因血钙和PTH水平较高,右甲状旁腺局限性浓聚影像,甲状旁腺功能亢进诊断明确,综上,临床拟诊断为MEN1;进一步完善肾上腺功能及影像学检查,考虑肾上腺占位为分泌皮质醇及雄激素的肾上腺皮质癌,完善MEN1基因检测明确诊断为以肾上腺皮质癌为首发表现的MEN1,临床上较为少见。
MEN1肾上腺皮质癌预后较差,患者的5年总生存率仅为20%~59%。本例患者虽无明确的病理组织学证据,但CT检查对诊断肾上腺皮质癌的敏感性高达98%,肾上腺皮质肿块直径>5 cm可考虑为恶性[3]。本例患者的肾上腺肿块大小约为7.0 cm×5.1 cm,左肾静脉可见癌栓,伴腹腔及腹主动脉旁淋巴结转移,且3个月后死亡,均提示肿瘤为恶性。因该患者父母已故,无子女,故仅对其2位一级亲属姐妹进行基因检测,未发现该位点突变。后反复追问其家族史,2位姐妹与患者为同母异父,故推测患者的致病基因来自于其父亲。胰腺神经内分泌肿瘤为MEN1的常见组成成分,该患者有糖尿病史和胰腺多发结节灶,故需注意是否合并胰腺神经内分泌肿瘤,经胰腺内分泌及外分泌功能检查后排除肿瘤可能,胰腺CT检查结果见多发小结节强化灶,考虑肾上腺皮质癌转移的可能性较大。
叶蕾等[4]曾对肾上腺皮质癌为主要表现的MEN1的家系报道,他们通过对121例MEN1患者的随访发现,33.9%有肾上腺病变,其中65.1%为无功能腺瘤,25.6%为高皮质醇血症腺瘤,2.3%为醛固酮瘤;肾上腺皮质癌仅占肾上腺病变的4.7%[5],在121例MEN1患者中发生率仅为1.5%。国外一项研究也发现,38例MEN1患者中仅1例发生肾上腺皮质癌,且MEN1患者的无功能肾上腺病变有发展为肾上腺皮质癌的潜在风险[6]。MEN1肾上腺皮质癌的临床表现包括高皮质醇血症、女性化、男性化及无功能肿瘤;而以皮质醇增多合并男性化的患者国内报道较少。既往文献报道在1 187例MEN1患者中发现18例MEN1肾上腺皮质癌患者[3],其中无功能性占38.8%(7/18),高皮质醇血症占22.2%(4/18),男性化占22.2%(4/18),女性化占11.1%(2/18),男性化合并高皮质醇血症的仅占5.6%(1/18)。而本例患者肾上腺皮质癌累及整个肾上腺皮质,表现为皮质醇增多症合并男性化,为少见病例。
MEN1是一种抑癌基因,位于染色体11q13,编码menin蛋白,大多数突变位于10个外显子中,也有少数内含子突变位点[7],导致MEN1基因失活[2]。大部分突变为移码突变,少数为无义和错义突变[8],目前已知的menin功能域有5个:3个JunD作用区、1个Smad3作用区和1个NF-κB作用区,这些功能域在转录及细胞生长调节中发挥效应。该患者为c.594G>A突变,发生在突变较少的Smad3区,为无义突变,该突变可导致蛋白质翻译的提前终止,从而导致肿瘤发生。有关文献报道发生肾上腺皮质癌的MEN1基因突变包括c.400_401insC、p.Ser443Tyr和p.E45V,而该患者基因突变在千人基因组及ESP6500等人群数据库中均未见收录,根据美国遗传学会(ACMG)对变异序列分类的指南,该突变为致病突变,在发生肾上腺皮质癌的MEN1基因突变中可能为一个新突变。
综上,肾上腺皮质癌为MEN1中少见的肿瘤组分,患者预后较差,MENl患者的无功能肾上腺病变有发展为肾上腺皮质癌的潜在风险,故对于存在肾上腺占位的MEN1需定期随诊。MEN1基因检测为确诊MEN1的主要理论依据,也为患者一级亲属的早期诊断和临床干预提供了可靠的依据。c.594G>A突变可能为肾上腺皮质腺癌的MEN1基因突变中一个新突变。
