改性蛭石吸附-包埋法固定化脂肪酶的研究
2020-07-29黄静梁密
黄静,梁密
1(辽宁工程技术大学 理学院,辽宁 阜新,123000)2(辽宁工程技术大学 材料学院,辽宁 阜新,123000)
脂肪酶又名三酰基甘油水解酶(EC 3.1.1.3),在植物、动物以及微生物中较普遍存在[1-2]。其广泛应用于造纸工业、有机合成工业、污剂工业、食品工业及生物表面活性剂工业中,尤其脂肪酶在进行生物柴油的合成工业中一直备受关注,是目前研究的热点催化剂之一[3-6]。而脂肪酶成本高且易失活是制约其应用的主要障碍[7],脂肪酶根据其应用形式可分为游离酶与固定化酶。固定化酶是指通过物理或者化学的方法将酶结合在固定相载体上,使本来分散于流动液相与底物均相混合的游离酶成为与底物异相接触的固定相,从而使酶的催化反应被限制在固定相上进行[8]。游离酶在应用中存在稳定性较差、产物分离纯化困难、不能反复利用等缺点[9-10];而固定化酶对热的稳定性提高、对蛋白酶的抵抗性增强、具有较强的耐酸耐碱性、有较高抵制变性剂及抑制剂的性能、能够实现酶与产物的分离、可反复使用、降低成本,便于自动化生产[11-13]。在脂肪酶的固定化方面,众多学者对固定化载体及固定化方法开展了深入的研究[14-16]。杨本宏等[17]研究了海藻酸钠作为载体,采用包埋的方法固定化德氏根霉脂肪酶的最佳条件。王爱玲等[18]以海藻酸钠与明胶复合物为载体,用包埋法固定化黑曲霉脂肪酶,研究了海藻酸钠、明胶浓度诸因素对固定化的影响,对固定化酶和游离酶的稳定性进行了研究。
蛭石具有天然、丰富的孔径结构、比表面积较大、吸附性较好,机械刚性和热稳定性很好,能够有效防止微生物的降解作用,环保且价格低廉,符合作为固定化酶载体的基本条件[19-20];若对蛭石进行适当的改性,还能提高其吸附能力等[21]。目前广泛应用的酶的固定化方法有交联法、共价法、包埋法和吸附法。共价法和交联法的反应条件通常很剧烈,对酶造成的影响较大;包埋法和吸附法的反应条件较温和,对酶造成的影响较小。但是由于吸附法固定化脂肪酶的载体与酶的作用力很弱,容易脱落,其稳定性较差,而包埋法是将酶限制在一定空间内,可以提高其稳定性。因此课题拟以改性蛭石为载体,采用吸附-包埋结合法对脂肪酶进行固定化,探究脂肪酶的固定化机理及固定化脂肪酶的性能,为脂肪酶固定化载体、方法、机理的研究提供科学依据。
1 材料与方法
1.1 材料与试剂
黑曲霉脂肪酶(20 000 U/g)、4-硝基苯磷酸二钠盐(disodium 4-nitrophenyl phosphate,p-NPP),Sigma公司;蛭石,石家庄雨馨建筑材料有限公司;HCl、NaH2PO4、Na2HPO4明胶、海藻酸钠、CaCl2均为分析纯。
1.2 仪器与设备
HH-8恒温水浴锅,上海科析试验仪器厂;GZX-9140MBE数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;JSM-7800F扫描电子显微镜,日本岛津制作所;THZ-82气浴恒温振荡器,常州朗越仪器制造有限公司。
1.3 实验方法
1.3.1 蛭石的改性
1.3.1.1 蛭石的酸改性
分别将5 g 325目蛭石和1 000目蛭石与100 mL质量分数为8%的HCl混合,80 ℃水浴下搅拌2 h,水洗至中性,60 ℃下烘干,备用。
1.3.1.2 改性蛭石的表征
分别取少量325目和1 000目改性前后蛭石喷金处理后,在JSM-7 800F扫描电子显微镜下观察其表面形貌。
1.3.2 改性蛭石固定化脂肪酶条件的优化
1.3.2.1 吸附法固定化脂肪酶条件的优化
取1 g脂肪酶溶于30 mL H3PO4缓冲液中。将一定量干燥载体加入到脂肪酶缓冲溶液中,一定温度下振荡固定化一定时间后,过滤,用磷酸盐缓冲溶液(pH=7.0)洗涤至上清液中检测不到脂肪酶。在单因素预试验基础上选择载体含量、固定化温度及固定化时间3个因素,每个因素3个水平,采用L9(34)正交表进行正交试验。固定化酶按照游离酶的方法进行酶活力测定,并根据公式(1)计算酶活力回收率:
(1)
1.3.2.2 吸附-包埋法固定化脂肪酶条件的优化
在上述吸附好的酶反应体系中加入15 mL一定质量浓度的海藻酸钠和15 mL一定质量浓度的明胶,使其充分混合均匀,立刻将其用注射器注射到一定浓度的CaCl2中,形成最终的固定化酶。在单因素预试验基础上选择海藻酸钠质量浓度、明胶质量浓度及CaCl2浓度3个因素,每个因素3个水平,采用L9(34)正交表进行正交试验。固定化酶按照游离酶的方法进行酶活力测定,并根据公式(1)计算酶活力回收率。
1.3.3 脂肪酶活力测定
配制0~70 μmol/L浓度梯度的4-硝基苯酚溶液,测定OD405,绘制标准曲线。取4支试管(空白管及3支平行样品管),将150 μL适当稀释的酶液(游离酶或固定化酶)加入到2.70 mL Tris-HCl缓冲液中(50 mmol/L,pH 7.5),其中空白管需要在沸水中煮5 min灭活酶,然后将4支试管置于恒温振荡器上(45 ℃,180 r/min)预热5 min,再加入150 μL底物乳液(5 mmol/L p-NPP),混匀后在恒温振荡器上反应5 min(45 ℃,180 r/min),随即迅速置于沸水中煮5 min终止反应,冷水浴降温后测OD405[22]。
酶活力单位(U)定义:在以上条件下,1 min催化底物水解产生1 μmol 4-硝基苯酚所需的酶量为1个酶活力单位。
1.3.4 固定化脂肪酶的表征
分别取少量最优固定化条件下的吸附法固定化脂肪酶和吸附-包埋法固定化脂肪酶进行喷金处理后,在JSM-7 800F扫描电子显微镜下观察其表面形貌。
1.3.5 脂肪酶催化性能的研究
1.3.5.1 游离酶与固定化酶的热稳定性的研究
将一定量的游离脂肪酶和固定化脂肪酶分别放在30、40、50、60、70 ℃的环境下4 h,取出测量其酶活力。
1.3.5.2 游离酶与固定化酶的储存稳定性的研究
取一定量的游离脂肪酶和固定化脂肪酶放在4 ℃的冰箱里,每隔7 d取出测量1次酶活力。以残留酶活为测定指标,根据公式(2)计算残留酶活:

(2)
1.3.5.3 游离酶与固定化酶的重复使用稳定性的研究
固定化酶与游离酶反应完成后,用pH=7的H3PO4缓冲液将其清洗至反应物无残留,进行1、2、3、4、5次循环,每次分别对脂肪酶的活力进行测定,以残留酶活为测定指标,根据公式(2)计算残留酶活。
1.3.6 固定化脂肪酶动力学参数的测定
选取最佳固定化条件下的吸附-包埋法固定化脂肪酶,确定其浓度,将底物配置成不同浓度[S]的溶液,在40 ℃下反应,测定反应的初始速度[V],用Origin 8.0软件进行非线性拟合,得到该固定化脂肪酶对底物的最大反应速率Vmax和Km值等动力学参数。
2 结果与分析
2.1 载体的表征
图1为325目和1 000目改性前后蛭石在2 000倍电镜下的表面形态。由2 000倍电镜图可知,1 000目改性后蛭石出现了较多沟壑状孔隙,比表面积较大,颗粒质感疏松,较大的比表面积提供了与酶分子充分大的接触面,使其更有利于吸附固定化脂肪酶。

a-325目改性前蛭石;b-325目改性后蛭石;c-1 000目改性前蛭石;d-1 000目改性后蛭石图1 325目蛭石和1 000目蛭石改性前后的电镜图(×2 000)Fig.1 The SEM photograph of before and after modification of 325 mesh vermiculite and 1 000 mesh vermiculite
2.2 固定化脂肪酶的条件优化
2.2.1 吸附法固定化脂肪酶的条件优化
表1为正交试验结果,由表1可知,各因素对固定化酶回收率影响大小的先后次序为B>C>A,即固定化时间>固定化温度>载体含量;最佳提取条件为A1B2C2,即载体含量含量为1 g,固定化时间3 h,固定化温度为25 ℃,在此条件下回收率可达到83.47%。这说明,此最佳固定化工艺并没有明显降低酶的活性,酶的活性部位不受固定化载体的干扰。

表1 正交试验结果Table 1 The results of orthogonal test
2.2.2 吸附-包埋法固定化脂肪酶的条件优化
表2为正交试验结果,由表2可知,各因素对固定化酶回收率影响大小的先后次序为B>C>A,即海藻酸钠质量浓度>CaCl2浓度>明胶质量浓度;最佳提取条件为A1B2C2,即明胶的质量浓度为5 g/L,海藻酸钠的质量浓度为20 g/L,CaCl2浓度0.04 mol/L,在此条件下回收率可达到82.77%。
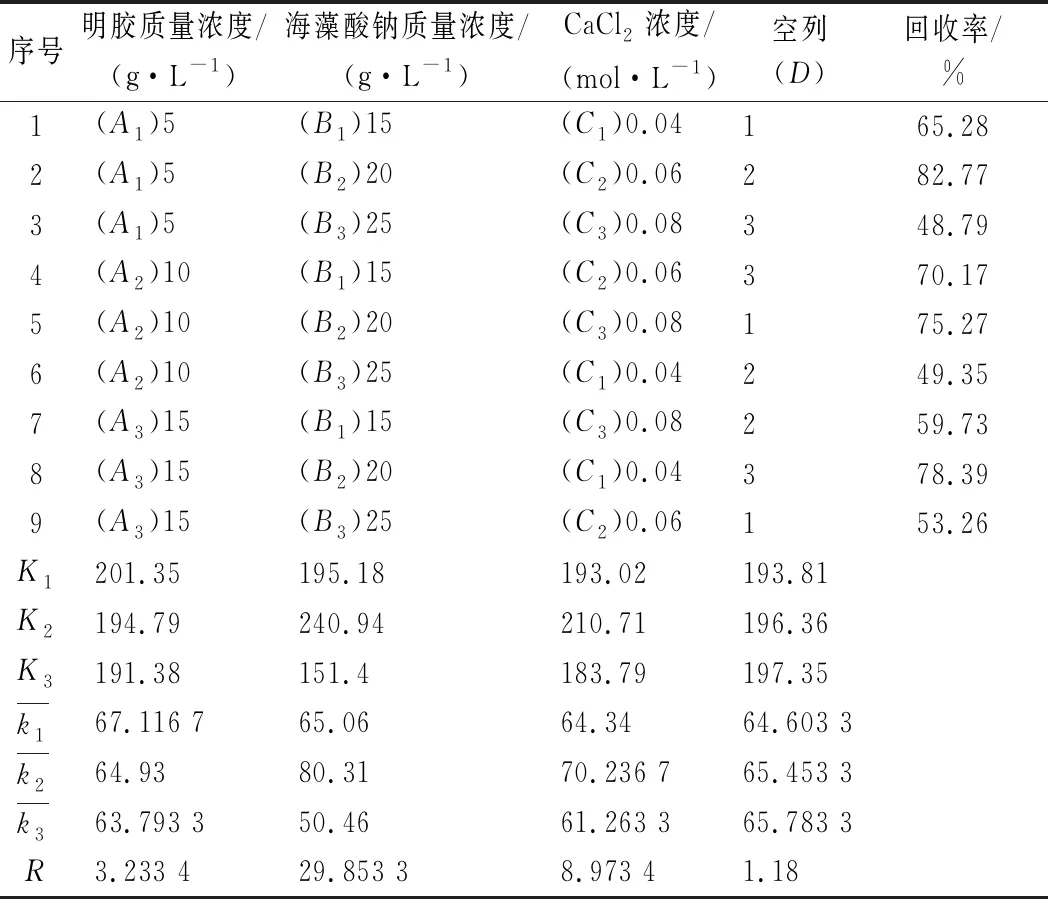
表2 正交试验结果Table 2 The results of orthogonal test
2.3 固定化脂肪酶的表征
图2为吸附法固定化脂肪酶和吸附-包埋法固定化脂肪酶在2 000倍电镜下的表面形态。由2 000倍电镜图可知,脂肪酶吸附在改性蛭石上,吸附包埋法后形成了凝胶包埋的小球。

a-吸附法固定化脂肪酶;b-吸附-包埋法固定化脂肪酶图2 固定化脂肪酶的电镜图(×2 000)Fig.2 The SEM photograph of Immobilized lipase
2.4 脂肪酶的催化性能
2.4.1 游离酶与固定化酶的热稳定性
热稳定性是衡量酶催化性能的一个重要指标,它能使酶在高温下发挥生物催化剂的作用,这可能是某些反应过程所必需的[21]。由图3可知,随着反应温度升高,游离与固定化脂肪酶的相对酶活力均呈现先升高后降低的趋势,当温度达到40 ℃时相对酶活力最大;且固定化脂肪酶的相对酶活力较游离脂肪酶高,这说明固定化脂肪酶热稳定性较好。

图3 温度对脂肪酶活力的影响Fig.3 Effect of temperature on the lipase activity
2.4.2 游离酶与固定化酶的存储稳定性
酶的固定化是提高其存储稳定性的主要手段,固定化条件决定了酶的稳定性,因为它取决于酶与载体基质之间的相互作用[21]。由图4可知,存储7 d后吸附-包埋法固定化脂肪酶的残留酶活为98.38%,存储21 d后为91.05%,存储42 d后为66.71%,存储56 d后为59.59%,这说明固定化脂肪酶具有较高的存储稳定性,这可能是由于固定化使脂肪酶的机械刚性增强,提高了其稳定性。

图4 固定化脂肪酶的储存稳定性Fig.4 The store stability on the immobilized lipase activity
2.4.3 游离酶与固定化酶的重复使用稳定性
酶的重复利用在生物催化过程中起着重要作用。由图5可知,吸附-包埋固定化脂肪酶重复使用7次后,残留酶活为85.33%。

图5 固定化脂肪酶的重复使用稳定性Fig.5 The reustability on the immobilized lipase activity
这与MARTA等[23]研究的壳聚糖-胶原包覆磁性脂肪酶重复使用5次后仍保留80%~90%的酶活力,重复使用7次后可保留80%左右的酶活力的结果比较接近,且较吸附法固定化脂肪酶的重复利用稳定性有较大的提高。这说明此固定化工艺效果较好,酶和载体之间形成了相对较强的相互作用,经过多次使用和洗涤后,其活性构象仍能保持良好的状态,具有良好的可重复利用性。
2.5 固定化脂肪酶动力学参数
Km值的大小通常与酶的性质有关,通过Km值的大小可以得出酶与底物亲和力的强弱。将底物的不同浓度[S]及测得的反应的初始速度[V]代入米氏方程,如公式(3)、公式(4)所示:
(3)
由米氏方程变形得:
(4)
3 结论
研究结果表明,1 000目蛭石改性后比表面积较大、孔径结构较丰富。脂肪酶的最佳固定化工艺为脂肪酶与载体质量比为1∶1,温度为25 ℃,吸附时间为3 h,海藻酸钠的质量浓度为20 g/L,明胶的质量浓度为5 g/L,CaCl2溶液浓度为0.04 mol/L,在此条件下脂肪酶活力回收率可达到82.77%;游离与固定化脂肪酶的最适催化温度均为40 ℃,且固定化酶的热稳定性较好;固定化脂肪酶存储56 d后仍能保留59.59%的酶活力,说明其存储稳定性较好;固定化脂肪酶经过7次重复回收利用后,酶活力仍可保留原来的85.33%,说明其重复使用稳定性较好。
