具有高细胞黏附性及高生物膜形成能力的植物乳杆菌有效抑制小鼠体内空肠弯曲杆菌毒力因子的转录活性
2020-07-29金星贺禹丰周永华陈晓华王刚赵建新张灏陈卫
金星,贺禹丰,周永华,陈晓华,王刚*,赵建新,张灏,陈卫
1(江南大学 食品学院,江苏 无锡,214122)2(国家卫生健康委寄生虫病预防与控制技术重点实验室,江苏 无锡,214064) 3(衡阳师范学院 生命科学与环境学院,湖南 衡阳,421008)
空肠弯曲杆菌(Campylobacterjejuni)为革兰氏阴性菌,是弯曲杆菌属的一种。空肠弯曲杆菌作为一种常见的人畜共患食源性病原菌,它的感染会引发急性的腹痛及腹泻[1]。空肠弯曲杆菌的flaA基因调控着鞭毛蛋白的表达,flaA表达的降低会使得鞭毛缩短并丧失运动能力,导致其黏附和侵入宿主肠道细胞的能力显著下降。cdtB基因调控着空肠弯曲杆菌细胞致死性膨胀毒素的分泌表达,而空肠弯曲杆菌的侵入抗原蛋白由ciaB基因编码表达,其基因表达的下降会阻碍空肠弯曲杆菌进入细胞繁殖的扩散。pldA基因调控着空肠弯曲杆菌磷脂酶活性蛋白,其和空肠弯曲杆菌的侵入和定植密切相关。
到目前为止,对于空肠弯曲杆菌的治疗,还是以抗生素为主,但对抗生素的过度依赖必然会导致具有抗生素抗性的空肠弯曲杆菌种类及数目的增加。乳酸菌,能够在人体肠道内有效定植并在维持肠道功能和宿主健康方面发挥至关重要的作用,同时,能够缓解由幽门螺杆菌、大肠杆菌以及沙门氏菌等病原菌引起的感染的研究也已经被报道[2-4]。植物乳杆菌(Lactobacillusplantarum)属于众多乳酸菌中的一个种属,由于其自身良好的益生特性及生物学特性(包括具有良好的耐受酸、胆盐、渗透压、温度、氧化、饥饿等胁迫的能力),被广泛应用于乳制品及发酵制品中[5-10]。已有研究表明,植物乳杆菌可以有效拮抗空肠弯曲杆菌的感染,如体外抑制空肠弯曲杆菌的生长,下调小鼠感染空肠弯曲杆菌后体内的炎症因子水平,降低肉鸡饲养中空肠弯曲杆菌的污染程度等[11-13]。
本文考察了12株植物乳杆菌的生长速率、产酸能力、对HT-29细胞的黏附能力、自我形成生物膜的能力、表面疏水性以及耐酸耐胆盐的能力等一系列的生物学特性,发现不同菌株之间的差异性,随后将其分别干预小鼠并考察其在宿主体内对空肠弯曲杆菌毒力基因表达的影响,结合生物学特性和毒力基因表达的相关性分析,发现植物乳杆菌能在小鼠体内显著降低空肠弯曲杆菌毒力基因的表达很可能归结于其表面高疏水性所带来的高黏附性及菌株自身较强的生物膜形成能力。
1 材料与方法
1.1 菌株、细胞及小鼠
验所采用的植物乳杆菌(Lactobacillusplantarum)编号及来源详见表1,植物乳杆菌、空肠弯曲杆菌NCTC 11168及人结肠癌细胞株HT-29,均来自于江南大学食品学院生物技术中心菌种库。

表1 实验所用12株植物乳杆菌Table 1 12 Lactobacillus plantarum strains used in the study
实验小鼠采用C57BL/6品系,SPF级,雌性,3周龄,购于上海斯莱克实验动物有限公司,于江苏省血吸虫病防治研究所动物房中分笼饲养。
1.2 实验试剂
MRS培养基,青岛海博生物技术有限公司;脑心浸液肉汤(BHI)、哥伦比亚血平板培养基,Oxoid(英国)公司;无菌绵羊血,杭州新锐生物工程有限公司;胎牛血清,HyClone(美国)公司;青霉素/链霉素溶液以及庆大霉素,上海生物工程有限公司;RPMI-1640培养基,Gibco(美国)公司;Prime Script 1st Strand c DNA Synthesis Kit,TaKaRa(美国)公司;i TaqTMUniversal SYBR®Green Supermix,BIO-RAD(美国)公司。
人工胃液:取浓度1 mol/L稀HCl 16.4 mL,加水稀释至50 mL,调节pH至2.0,然后按照每100 mL溶液为1 g胃蛋白酶的比例,加入胃蛋白酶,充分溶解后再用0.22 μm无菌微孔滤膜过滤除菌。
人工肠液:称取6.8 g KH2PO4,加蒸馏水500 mL进行溶解,调节pH至6.8,加水至1 000 mL,然后按照每100 mL溶液为0.3 g牛胆盐和1 g胰蛋白酶的比例,加入牛胆盐和胰蛋白酶,充分溶解后用0.22 μm无菌微孔滤膜过滤除菌。
1.3 仪器与设备
生物安全柜,Labconco(美国)公司;5415R小型台式高速离心机,eppendorf(德国)公司;starter3100 pH计,ohaus(美国)公司;BD150L三气培养箱,Bingd(德国)公司;凝胶成像仪 Universal hood Ⅱ,美国伯乐(Bio-Rad)公司;酶标仪,Thermo(美国)公司;GRP-9160型隔水式恒温培养箱,上海森信实验仪器有限公司;Leica DM2000显微镜,Leica光学仪器(日本)公司;S ME3002E/02电子天平,上海METTLER TOLEDO仪器有限公司;Bio-Rad ® CFX96TM实时荧光定量PCR仪,Bio-Rad(美国)公司。
1.4 细菌菌悬液及上清液的制备
在液体MRS中按照2%的接种量接种乳酸菌,37 ℃下培养24 h为1代,传代2次,8 000 r/min,6 min,4 ℃条件下离心,收集发酵上清液及菌体。用PBS清洗2次菌体,重悬,调整所需浓度备用;采用 0.22 μm无菌微孔滤膜对上清液进行过膜处理,4 ℃冰箱保存。
1.5 乳酸菌生长速率及产酸能力的测定
生长速率的测定:在液体MRS中按照2%的接种量接种乳酸菌,37 ℃下培养,静置,每隔2 h取样,在600 nm条件下测定其吸光度。
产酸能力的测定:将pH计探头插入处理完成的乳酸菌上清液中,测定其pH值。
1.6 乳酸菌对HT-29细胞的黏附实验
将生长融合至80%的HT-29细胞消化,将盖玻片放置在6孔培养板中,加入2 mL/孔的细胞完全培养悬液(1×105个/mL),37 ℃条件下放入5% CO2培养箱中培养,待细胞贴壁后,弃去培养基,加入1 mL/孔的乳酸菌菌悬液(1×108CFU/mL),补加基础细胞培养液至2 mL,随后孵育2 h。结束后,用磷酸盐缓冲液清洗以除去未黏附的乳酸菌,甲醇固定20 min后进行革兰氏染色,显微镜观察。随机选取20个视野计算每100个细胞所黏附的细菌数目,即为黏附指数。
1.7 乳酸菌自身生物膜形成量的测定
根据姚沛琳[14]的实验方法测定乳酸菌生物膜的形成量。
1.8 乳酸菌表面疏水性的测定
根据KOS等[15]的实验方法测定乳酸菌表面疏水性。
1.9 乳酸菌耐酸耐胆盐能力的测定
根据俞赟霞[16]的实验方法稍作改动测定乳酸菌耐酸耐胆盐的能力。选取乳酸菌数量级为109CFU/mL 的磷酸盐缓冲液进行本实验,离心(5 000 r/min,10 min,4 ℃),加入等体积的模拟人工胃液,水浴(37 ℃)中培养3 h,取样,使用梯度稀释法进行平板菌落计数后,相同条件离心,重悬于等体积的人工肠液,水浴(37 ℃)中继续培养,2 h和4 h分别取样计数。
1.10 动物实验
(1)小鼠分组及处理
5~6只小鼠为1组,300 μL/只为小鼠的灌胃剂量。第1天,对小鼠灌胃弓形虫,弓形虫灌胃剂: 300 μL含20个包囊的弓形虫脑匀浆悬液[17-18];第2、3、4天正常饲养;第5、6天对小鼠分别灌胃空肠弯曲杆菌菌悬液和乳酸菌菌悬液,间隔1 h;第7、8、9、10天正常饲养,小鼠表现出空肠弯曲杆菌感染症状;第11天小鼠处死。
(2)乳酸菌干预后盲肠内容物中空肠弯曲杆菌毒力因子的表达
刮取小鼠盲肠中的内容物,参考MUNDI等[19]的实验方法提取总RNA后,根据PrimeScript 1st Strand cDNA Synthesis Kit 试剂盒说明书操作步骤逆转录合成cDNA。后采用qRT-PCR技术检测模板中的空肠弯曲杆菌鞭毛蛋白flaA基因、编码全毒素cdtB基因、原侵入蛋白ciaB基因以及磷脂酶活性蛋白pldA基因。毒力基因PCR引物如表2所示。

表2 实验所用毒力基因及PCR引物Table 2 Target virulence genes and primers used in the study
qRT-PCR的反应体系为:iTaqTMUniversal SYBR®Green Supermix 10 μL;上游引物(10 μmol/L) 1 μL;下游引物(10 μmol/L) 1 μL;cDNA模板 1 μL;dd H2O 7 μL。
空肠弯曲杆菌毒力基因q RT-PCR反应条件为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s(40个循环)。
得到的数据进行定量计算,重复3次。
1.11 统计与绘图
采用SPSS对数据进行单因素方差分析、相关性分析,绘图采用Origin 8.5、Graphpad Prism 6以及Tbtools完成。所有实验结果表示为Mean±SD。不同小写字母(a~f)表示P<0.05。
2 结果与分析
2.1 植物乳杆菌生长速率的测定
本研究考察了12株植物乳杆菌在液体MRS中按照2%的接种量接种后,在37 ℃条件下静置培养时的生长曲线,结果如图1所示。

图1 乳酸菌在MRS培养基中的生长曲线Fig.1 The growth curves of Lactobacillus plantarum strains in MRS
由图1结果可知,12株植物乳杆菌的生长在MRS培养体系中速度较快,培养12~16 h之后,菌株基本上已经完全进入了稳定期。以上结果表明植物乳杆菌活力旺盛,作为兼性厌氧菌,无论氧气存在与否,都能保持较高的生长活力,这为其在严苛的条件下生长、繁殖提供了源动力。有研究表明,乳酸菌在生长过程中,会受到各种因素的影响,比如说有机酸、氧气及渗透压等,复杂的条件会影响乳酸菌的生长速率及数量级[20]。而本文中的植物乳杆菌活力旺盛且生长速率较快,也反映了其具有良好的耐酸及渗透压的潜力。
2.2 植物乳杆菌产酸能力的测定
本研究利用发酵上清液的pH值表征乳酸菌的产酸能力,考察了12株植物乳杆菌培养过程中代谢产生有机酸的能力,实验结果如表3所示。
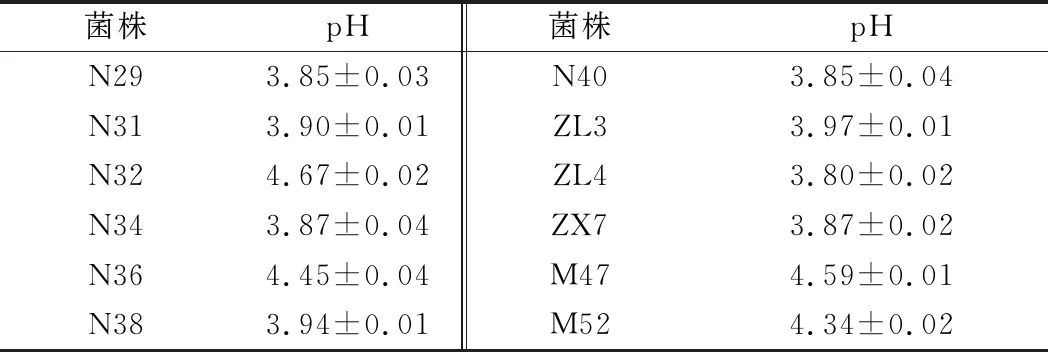
表3 植物乳杆菌发酵上清液pH值Table 3 The resoults of pH for Lactobacillusplantarum cell free supernatant
由表3结果可知,12株植物乳杆菌的培养完成后发酵上清液的pH值在4.67~3.80。虽然不同菌株间存在差异,但是偏低的pH值反映了植物乳杆菌在培养过程中代谢产生了有机酸,pH值的不同可能是由于有机酸的种类及数量不同所造成的。乳酸菌代谢产生的有机酸已被证明可以抑制食源性致病菌的生长,特别是乳酸,作为乳酸菌生长产生的主要代谢产物,显著降低了乳酸菌培养后体系的pH值,并能够显著抑制幽门螺旋杆菌(Helicobacterpylori)尿素酶的活性,从而降低幽门螺旋杆菌的活力并抑制其生长[21]。植物乳杆菌发酵产生的有机酸为其具备一定的抗菌能力提供了条件。
2.3 植物乳杆菌对HT-29细胞的黏附效果
黏附,作为乳酸菌与宿主细胞作用的先决条件,是乳酸菌在机体内展现对宿主有益作用的基础,同样,良好的黏附性也为乳酸菌在体内生长和定植提供必要的动力。本研究考察了12株植物乳杆菌对HT-29细胞的黏附能力,实验结果如图2所示。
由图2结果可知,虽然同为植物乳杆菌,但是对HT-29细胞的黏附能力却体现出非常明显的种内差异,N36、N40以及ZL4有着优越的黏附效果,其黏附指数均值均达到12以上,而ZX7却几乎不具备任何的黏附能力。而本研究中具有良好黏附效果的植物乳杆菌很有可能在抵御病原微生物方面也表现出相应的优势。WANG等[22]发现LactobacillusplantarumN8在体外实验中对HT-29细胞的黏附指数为10左右,体现出较强的黏附效果,正因如此,该菌株对空肠弯曲杆菌的生长具有抑制作用,这说明植物乳杆菌对细胞的良好黏附作用可以缓解病原菌对宿主的侵袭,我们的实验结果与之相类似,也暗示着N36、N40、 ZL4等具有优良黏附作用的菌株具有抑制空肠弯曲杆菌的生长、缓解其对宿主感染的潜力。
2.4 植物乳杆菌自身生物膜形成的能力
在潮湿温暖的环境中,某些乳酸菌会形成生物膜,生物膜的形成使得乳酸菌拥有诸如良好的稳定性及抗逆性的特质。本研究考察了12株植物乳杆菌自身生物膜形成的能力,实验结果如图3所示。

图3 十二株植物乳杆菌自身生物膜形成能力Fig.3 Biofilm formation of 12 Lactobacillusplantarum strains
图3结果表明,在595 nm处的吸光度代表了菌株自身生物膜的形成量,N29、N34、N36、ZL4和M47都具有较强的自身成膜能力,而N38、ZL3以及ZX7却几乎不具备生物膜的形成能力,由此可见植物乳杆菌自我成膜能力也体现出明显的种内差异。与本实验结果相似的是,王刚等[23]的研究发现, OD595达到3以上的乳酸菌,认定为具有良好的生物膜形成能力,能够有效降低空肠弯曲杆菌在小鼠体内的定植量,缓解空肠弯曲杆菌在哺乳动物体内的感染。
2.5 植物乳杆菌表面疏水性的分析
12株植物乳杆菌表面的疏水性也得到了测定,实验结果如表4所示。

表4 植物乳杆菌的表面疏水性Table 4 The surface hydrophobicity of Lactobacillusplantarum strains
由表4结果可知,12株植物乳杆菌表面疏水性在27.36%~68.14%,N36、N40、ZL4展现出较高的表面疏水性。赵煜[24]的研究指出,植物乳杆菌N9具有较高的疏水性,为(51.97±2.37) %,并且N9同样具有着较强的对细胞的黏附能力,同时有研究报道指出双歧杆菌拥有黏附上皮细胞的能力很大程度上取决于其具备良好的表面疏水性[25]。结合黏附实验的相关数据,我们发现N36、N40、ZL4同时具备较高的表明疏水性和对HT-29细胞黏附能力,这也反映了该2项指标具有很高的相关性。乳酸菌表面的蛋白或类蛋白物质,会使其具有较高的疏水性,此类物质易发生非特异性的相互作用,使得菌体更易于黏附细胞并对细胞形成保护作用[26]。
2.6 植物乳杆菌的耐酸耐胆盐能力
本实验采用12株植物乳杆菌依次通过人工胃液及肠液并在其中停留一段时间的方法,考察其耐酸耐胆盐的能力,结果如图4所示。

图4 十二株植物乳杆菌耐酸耐胆盐能力Fig.4 Resistance of 12 Lactobacillus plantarum strains to gastric acid and bile salts
由图4结果可知, 多数植物乳杆菌在经历了人工胃液及人工肠液的培养之后,活菌数仍可以达到约8 lgCFU/mL,与初始的9 lgCFU/mL浓度相比,下降了约一个数量级。N31、ZL3体现出较差的耐受效果,培养后活菌数下降至低于6 lgCFU/mL。很多学者发现,一些具有良好的耐酸耐胆盐特性的植物乳杆菌,在调节慢性代谢性疾病或者是拮抗胃肠道病原菌感染方面,都有着突出的表现[27-28]。
2.7 植物乳杆菌在体内影响空肠弯曲杆菌毒力因子的表达
本文中,由于空肠弯曲杆菌NCTC 11168偏弱的致病性使其无法在肠道中大量定植并发挥毒力作用,弓形虫感染模型被引入用于破坏健康小鼠的免疫力[29]。研究测定了12株植物乳杆菌干预小鼠后盲肠内容物中空肠弯曲杆菌毒力因子flaA、cdtB、ciaB和pldA的表达,结果如图5所示。
由图5结果可知,不同植物乳杆菌在小鼠体内抑制空肠弯曲杆菌毒力因子表达的效果不一,多数菌株对flaA在体内的表达均产生了一定的影响,但是在ciaB的表达水平上,能产生抑制作用的菌株却比较少,这说明不同菌株在小鼠体内影响空肠弯曲杆菌的感染机制可能存在显著的个体差异。综合图5的实验结果,N36和ZL4在体内展现出更强的对空肠弯曲杆菌毒力因子的抑制效果。也有文献报道罗伊氏乳杆菌(Lactobacillusreuteri)X13预防小鼠感染空肠弯曲杆菌后,盲肠段部分毒力基因的表达得到了显著的下调,部分毒力基因下调近1倍左右[30],该研究成果也验证了本文中部分植物乳杆菌在小鼠体内抑制空肠弯曲杆菌毒力因子表达的合理性。

a-flaA基因表达;b- cdtB基因表达;c-ciaB基因表达;d-pldA基因表达图5 十二株植物乳杆菌在小鼠体内对空肠弯曲杆菌毒力基因表达的影响Fig.5 Effects of 12 Lactobacillus plantarum on virulence genes expression in C. jejuni in mice
2.8 植物乳杆菌生物学特性和其干预后空肠弯曲杆菌毒力基因在体内表达的相关性分析
为了探究菌株自身的生物学特性和其在体内缓解空肠弯曲杆菌感染是否存在联系,本文对12株植物乳杆菌生物学特性和其干预后空肠弯曲杆菌毒力基因的表达进行了相关性的分析,结果如图6所示。

a-不同生物学特性与毒力基因热图分析;b-不同生物学特性与毒力基因的相关性分析图6 植物乳杆菌生物学特性和其干预后空肠弯曲杆菌毒力基因在体内表达的相关性分析Fig.6 Correlation analysis between biological characteristics of Lactobacillus plantarum and expression of virulence genes Campylobacter jejuni virulence genes after intervention in mice
植物乳杆菌的不同生物学特性与flaA、cdtB、ciaB和pldA制作了热图,另外,气泡图被用来展现菌株的生物学特性和各毒力因子之间的相互关系。由图6结果可知,总体来说,各毒力因子和黏附能力、生物膜形成能力以及表面疏水性的相关性较高,而菌株较高的表面疏水性又使得其获得了良好的对上皮细胞的黏附效果,这意味着就植物乳杆菌而言,菌体表面高疏水性所带来的高黏附性及菌株自身较强的生物膜形成能力使得其能在小鼠体内显著降低空肠弯曲杆菌毒力基因的表达,从而缓解空肠弯曲杆菌在体内的感染。空肠弯曲杆菌的部分致病机制来自于其鞭毛蛋白,而某些毒力因子(例如flaA)调控其合成与转录,而且鞭毛蛋白也影响着空肠弯曲杆菌的黏附与定植,乳酸菌对肠上皮细胞的高黏附性会抑制flaA及flaB的分泌表达,从而降低空肠弯曲杆菌的运动性及病原毒力蛋白的运转功能[31-32]。侵入抗原蛋白和磷脂酶活性蛋白也与空肠弯曲杆菌侵入细胞破坏宿主细胞肠道屏障密切相关,乳酸菌良好的成膜能力使其更易在宿主肠道中富集并定植,乳酸菌优先于病原占位位点后,调控ciaB和pldA的分泌表达,修护肠道黏膜屏障,极大程度地阻碍病原菌与肠黏膜之间的黏附与侵袭[33]。某些嗜酸乳杆菌(Lactobacillusacidophilus)由于其独特的生理学特性使得其在调控侵袭性大肠杆菌及幽门螺旋杆菌的毒力基因表达上体现出良好的效果[34-35]。
3 结论
本文考察了12株植物乳杆菌的生长速率、产酸能力、对HT-29细胞的黏附能力、自我形成生物膜的能力、表面疏水性以及耐酸耐胆盐的能力等一系列的生物学特性,发现不同菌株之间的差异性,随后将其分别干预小鼠并考察其在宿主体内对空肠弯曲杆菌毒力基因表达的影响,发现N36和ZL4可以显著降低空肠弯曲杆菌毒力基因的表达,结合生物学特性和毒力基因表达的相关性分析,发现植物乳杆菌能在小鼠体内显著降低空肠弯曲杆菌毒力基因的表达很可能归结于其高表面疏水性所带来的高黏附性及菌株自身较强的生物膜形成能力,这为构建可以在体内缓解空肠弯曲杆菌感染的植物乳杆菌的体外筛选方法提供了新的思路。
