葵花籽蛋白对慢性不可预知温和应激小鼠的抗抑郁作用
2020-07-29卢肖蒙
卢肖蒙,齐 策,郑 洁,孙 美,唐 雪,金 龙*,孙 进,*
1江南大学食品学院,无锡214122;2国家坚果加工技术研发专业中心,合肥 230601;3青岛大学营养与健康研究院,青岛 266071
抑郁症具有情绪低落、快感缺失、兴趣或愉悦感缺失、习得性无助、睡眠及认知功能障碍等特点[1]。在当今生活快节奏和高强度的压力下,抑郁症发病率正逐年上升,我国人群的抑郁症发病率为4.2%[2],到2020年其将成为仅次于心脏病的第二大疾患,已经成为广受关注的公共卫生问题。
抑郁症病因的单胺假说认为,中枢神经系统中单胺类神经递质浓度水平下降会引起抑郁症[3]。单胺类神经递质主要包括5-羟色胺(5-hydroxytryptamine,5-HT)、多巴胺(dopamine,DA)或去甲肾上腺素(norepinephrine,NE),它们在大脑的合成速度受大脑中前体物质浓度的影响,通过饮食摄入某些神经递质的前体可增加其在大脑中的水平。色氨酸(tryptophan,Trp)、苯丙氨酸(phenylalanine,Phe)/酪氨酸(tyrosine,Tyr)分别是5-HT和DA的前体,它们的摄入量与抑郁的发生密切相关,通过膳食补充富含Trp和苯丙氨酸的饮食是预防抑郁发生的有效营养干预措施[4],近年来,开发富含Trp的食品资源是该领域的研究的热点,已经发现或应用的主要是牛乳源蛋白或肽,包括乳清蛋白、α-乳清蛋白、β-lactolin和γ-[Glu]n-Trp(乳清蛋白水解物),它们的神经调节活性主要与5-HT系统有关。研究发现富含Trp的乳清蛋白饮食显示对抑郁小鼠明显的抗焦虑作用,改善小鼠的抑郁行为[5]。以蛋白百分含量计,葵花籽蛋白Trp含量高达1.75 g/100 g蛋白,且我国的葵花籽资源丰富,其大量副产物(如葵花籽粕)有待开发利用。因此在本研究中,我们与乳清蛋白作比较,探究葵花籽蛋白能否发挥类似乳清蛋白的抗抑郁作用。
生活压力引起的抑郁可通过慢性不可预知温和应激(CUMS)动物模型来研究。CUMS造成抑郁的机制之一是其引起海马氧化应激[6]。研究表明,除作为神经递质发挥作用外,5-HT也是一种强抗氧化剂,通过补充富Trp蛋白,提高大脑5-HT的产生可能也抑制氧化应激,还有待验证。
然而目前国内外尚未有关葵花籽蛋白抗抑郁作用的研究报道。本研究采用CUMS小鼠抑郁模型,研究葵花籽蛋白预防抑郁症的作用。本研究可为开发基于葵花籽蛋白的食品,为其在预防抑郁发生的营养干预措施的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 动物
雄性C57BL/6J小鼠40只,6周龄,体质量17~20 g,SPF级(常州卡文斯实验动物有限公司,许可证号:SCXK(苏)2016-0010,动物合格证号:201907736)。饲养于江南大学实验动物中心,自由进食进水,相对温度23±2 ℃,相对湿度60%±5%,12小时昼夜交替。所有实验操作符合实验动物伦理学要求(伦理审批号:JN.No20181230c0480710[281])。
1.1.2 试剂
葵花籽蛋白(洽洽食品股份有限公司,Trp:2.35 g/100 g蛋白,Phe+Tyr:14.15 g/100 g蛋白),乳清蛋白(河南旗诺食品配料有限公司,Trp:1.22 g/100g蛋白,Phe+Tyr:6.65 g/100 g蛋白);大豆蛋白(江苏富盛德生物工程有限公司);丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)试剂盒(南京建成生物研究所);皮质酮(corticosterone,CORT)、5-HT、DA、NE和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)试剂盒(江苏酶免实业有限公司)。
1.1.3 仪器与设备
动物行为学实验装置(上海欣软信息科技有限公司);MultiskanMK3酶标仪(美国Molecular Devices公司);R686VLT超低温冷冻冰箱(美国INVETRO公司);5804R台式高速冷冻离心机(德国Eppendorf公司)。
1.2 方法
1.2.1 动物分组
将小鼠随机分为正常组(CON,蛋白来源大豆蛋白)、模型组(MOD,蛋白来源大豆蛋白)、葵花籽蛋白组(SFSP)、乳清蛋白组(WPC),10只/组。各组小鼠先饲喂不同蛋白源饲料(表1)4周,从第5周开始,除正常组外,其余各组小鼠单笼饲养且连续进行抑郁模型造模3周。
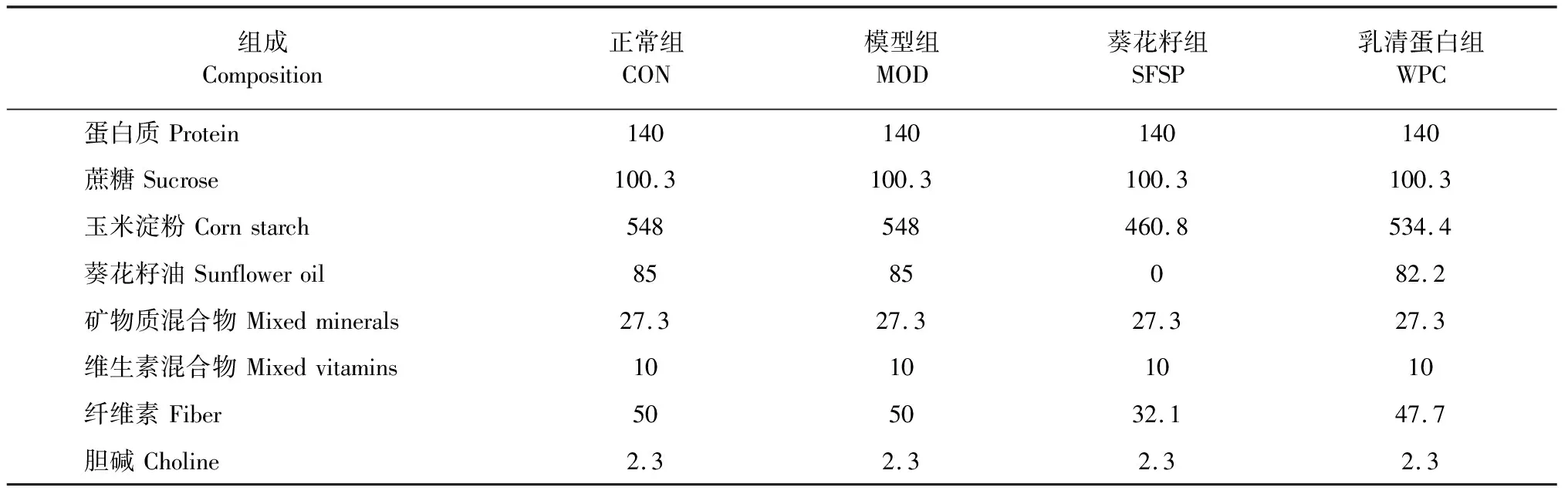
表1 动物饲料组成
1.2.2 慢性不可预知温和应激模型(CUMS)
运用多种刺激方式以每天2次的频率交替应激小鼠21天,应激[7]包括笼具45°倾斜2 h、夹尾3 min、于无垫料的笼具中4 h、同笼3 h(5只)、置于大鼠垫料3 h、空笼具加水0.8 cm淹没4 h,以及禁水、禁食12 h。
1.3 检测指标
1.3.1 糖水偏好实验
糖水偏好实验(sucrose preference test,SPT)参考文献[8],分为训练期和测试期。训练期:给予小鼠一瓶1%蔗糖水和一瓶纯水48 h,中间交换水瓶位置,让小鼠适应饮用糖水。测试期:小鼠禁水禁食12 h后进行12 h的糖水偏好测试,测试前后分别称量每个水瓶的重量,并计算糖水偏爱指数(糖水偏爱指数 = 糖水消耗量/总液体消耗量 × 100%),造模结束后第2天进行糖水偏好实验。
1.3.2 悬尾实验
悬尾实验(tail suspension test,TST)参考文献[9],用胶带把小鼠尾巴(距尾尖1 cm)粘贴在固定装置上,使小鼠倒置,头部距水平面大约20 cm,此外小鼠间用挡板隔开阻碍其视线,保证小鼠悬空,无可接触地方,每只小鼠实验时间为6 min,观察并记录后4 min内的累计不动时间,将小鼠除呼吸外所有肢体均不动的时间认定为不动时间。
1.3.3 强迫游泳实验
强迫游泳(forced swimming test,FST)参考文献[10],将小鼠放于高25 cm,直径15 cm的烧杯中,烧杯中的水深保持12 cm,温度控制在25 ℃左右,将小鼠放置于水中6 min,观察记录小鼠在后4 min内的累计不动时间。将小鼠在水中停止游动挣扎,或呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面,身体没有全身运动的状态认定为不动时间。
1.3.4 旷场实验
旷场实验(open field test,OFT)在一个黑暗的房间里,放置一个无顶的实验箱(40 cm×40 cm×30 cm),在箱子上方安装有摄像头,并连接电脑上的ANY-maze视频追踪系统,自动跟踪和记录小鼠在实验中的活动情况并获得行为数据。实验箱的底部在电脑上被分为16个小正方形格子(10 cm×10 cm),中央区域的四个正方形格子被定义为中央区域。将小鼠放入装置的中央区域并允许其自由探索30 min。每次实验结束后将小鼠的粪尿残留物清理干净,并用 75%乙醇擦拭从而清除残留气味,避免残留的气味影响实验结果。
1.3.5 高架十字迷宫实验
高架十字迷宫实验(elevated plus maze,EPM)将小鼠放置在长50 cm,宽5 cm的开放臂和封闭臂交叉组成的实验装置中,中央是无封闭的5 cm×5 cm的平台,封闭臂和底部平台均为白色,整个装置距离地面45 cm,让小鼠在装置中自由探索5 min,与摄像头相连的电脑系统自动记录小鼠的活动状态。
1.3.6 样品采集
行为学实验结束后,眼球取血并脱颈处死小鼠,收集血液并迅速分离皮层和海马组织。将血液在4 ℃,4 000 rpm离心10 min,收集上层血浆分装到离心管,-80 ℃保存。海马和皮层按1∶10(W/V)用生理盐水制备成组织匀浆液,离心-80 ℃保存。
1.3.7 氧化还原稳态相关指标的测定
皮层SOD、GSH-Px和CAT活性以及MDA水平的测定严格按照检测试剂盒的说明进行,活性氧自由基(ROS)测定采用化学发光法测定[11]。
1.3.8 CORT和单胺类神经递质的测定
血清CORT和海马5-HT、DA、NE和BDNF的测定按照Elisa试剂盒说明书操作。
1.4 数据统计分析
使用IBM SPSS Statistics 20.0进行数据分析。结果表示为平均值±标准差。通过单因素方差分析(ANOVA)对结果进行分析,用Duncan检验进行组间比较。当P<0.05时,差异被认为是显著的。通过双变量相关性分析对结果进行双侧显著性检验,用HemI 1.0 制作热图。
2 结果
2.1 SFSP对抑郁模型小鼠体重的影响
如图1,第4周时,SFSP组体重显著高于其余3组(P<0.05),而CON、MOD和WPC组体重无显著差异,可能与以SFSP配制的饲料适口性更好有关。研究发现葵花籽蛋白在促进生长、体重增长和饮食效率比方面表现更有效率[12],与本实验结果一致;CUMS模型施加后,第5周,除CON组外,其余各组体重出现下降趋势,为小鼠初次遭受应激的结果,其它应激引起小鼠体重下降也曾被观察到[13]。第6周,MOD、SFSP和WPC组小鼠体重呈现明显升高的短暂时期,可能与小鼠对应激的暂时适应有关,这也与我们观察到的采食量明显增加的变化一致。与MOD相比,CON,SFSP和MOD组体重显著增加(P<0.05)。
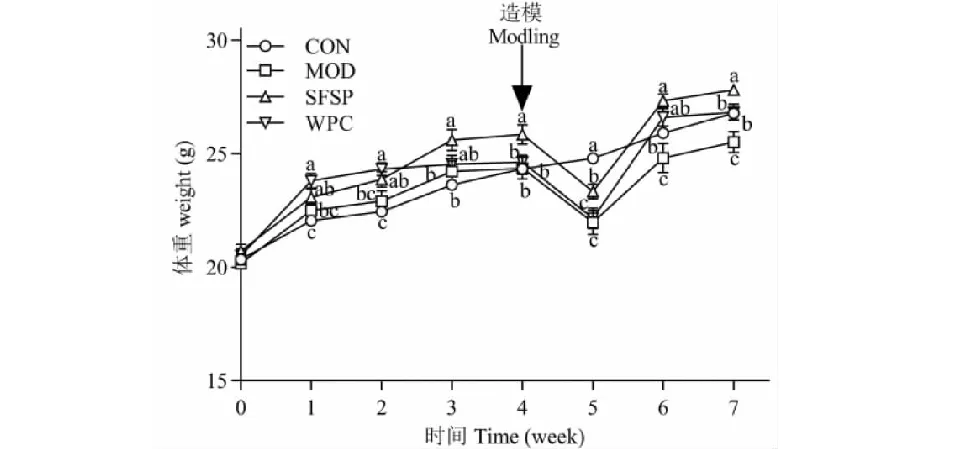
图1 葵花籽蛋白对体重的影响
2.2 SFSP对抑郁模型小鼠糖水偏好的影响
如表2,与CON相比,MOD组小鼠对糖水的偏好显著性降低(P<0.05),表明抑郁小鼠对奖赏的反应性降低,即快感缺失;与MOD组比,SFSP组和WPC组小鼠对糖水的偏好明显提高(P<0.05)。

表2 SFSP对抑郁模型小鼠糖水偏好的影响(n= 10)
2.3 SFSP对抑郁模型小鼠TST和FST实验不动时间的影响
如表3,在TST和FST实验中,与CON组相比,MOD组小鼠不动时间显著增加(P<0.05),表明抑郁小鼠的行为绝望状态加重;SFSP组和WPC组小鼠与MOD组相比不动时间显著减少(P<0.05)。

表3 SFSP对TST和FST实验不动时间的影响(n= 10)
2.4 SFSP对抑郁模型小鼠自主活动性的影响
如表4,各组小鼠总路程无显著性差异,但其余各组小鼠总的运动路程大于MOD组;与CON相比,MOD组小鼠进入中央区域的时间、路程和次数显著减少(P<0.05),表明抑郁小鼠对新环境的好奇程自主活动性降低;与MOD相比,SFSP组小鼠进入中央区域的时间、路程和次数显著增加(P<0.05),WPC组小鼠进入中央区域的时间和路程显著增加(P<0.05),进入中央区域次数无显著性差异。
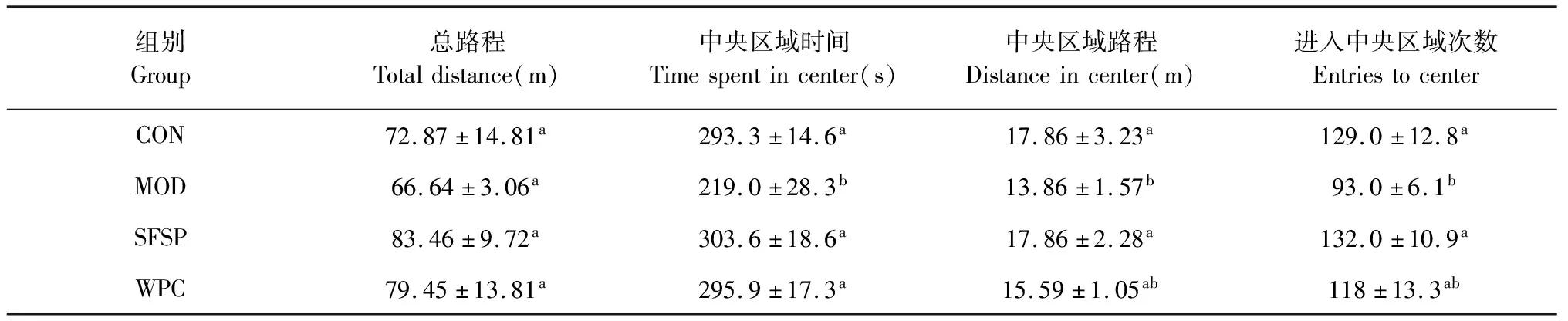
表4 SFSP对OFT实验自主活动性的影响(n= 10)
2.5 SFSP对抑郁模型小鼠焦虑情绪的影响
如表5,与CON组相比,MOD组小鼠进入开臂的次数、停留时间和进入时间百分比显著减少(P<0.05),进入总次数与其无显著性差异,验证了抑郁小鼠的焦虑状态加剧;与MOD组相比,SFSP组和WPC组小鼠进入总次数、开臂的次数、停留时间和进入时间百分比均显著增加(P<0.05)。

表5 SFSP对高架十字迷宫实验自主活动性的影响(n= 10)
2.6 SFSP对抑郁模型小鼠皮层氧化还原稳态的影响
如表6,与CON组相比,MOD组小鼠皮层内GSH-Px、SOD和CAT活性显著降低(P<0.05),而MDA和ROS水平显著升高(P<0.05),说明氧化应激引起了抑郁小鼠体内抗氧化系统耗竭;与MOD组相比,SFSP组和WPC组小鼠皮层内GSH-Px、SOD、CAT活性显著提升(P<0.05),MDA和ROS水平显著降低(P<0.05),且SFSP组小鼠GSH-Px和SOD活性比WPC组提升更显著(P<0.05)。

表6 SFSP对皮层氧化应激的影响(n= 10)
2.7 SFSP对抑郁模型小鼠血清CORT和海马神经递质含量的影响
如表7,与CON组相比,抑郁小鼠血浆中CORT含量显著升高(P<0.05);SFSP组和WPC组小鼠血浆中CORT含量比MOD组显著降低(P<0.05)。

表7 SFSP对抑郁模型小鼠皮质酮和神经递质的影响(n= 10)
与CON组相比,抑郁小鼠海马中5-HT、DA、NE和BDNF含量显著降低(P<0.05);与MOD组相比,SFSP组和WPC组小鼠海马中5-HT、DA、NE和BDNF含量显著升高(P<0.05),且SFSP组海马内BDNF含量显著高于WPC组(P<0.05)。
2.8 SFSP对抑郁模型小鼠血清氨基酸含量的影响
如表8,与CON组相比,抑郁小鼠血浆中Trp、Phe、Tyr和支链氨基酸(亮氨酸、异亮氨酸和缬氨酸)浓度以及色氨酸与中性氨基酸(large neutral amino acids,LNAA)比值显著降低(P<0.05);与MOD组相比,SFSP组和WPC组小鼠血浆内Trp、Phe、Tyr和支链氨基酸浓度及Trp/LNAA 比值显著提升(P<0.05)。

表8 SFSP对抑郁模型小鼠皮质酮和神经递质的影响(n= 10)
2.9 行为学指标与生化指标相关性分析
图2显示,根据不同指标的相关系数聚类分析,行为学和生化指标分别都被分为4类。生化指标分类中G1以神经递质为主、G2主要应激介质、G3主要为血清中性氨基酸,而G4为神经递质前体氨基酸及其总量与中性氨基酸的比值。在行为学指标中,糖水偏好指数与其它指标明显分离,与单胺、抗氧化指标和芳香族氨基酸都存在显著相关,说明该指标是反映抑郁行为的最敏感指标。此外,悬尾实验和强迫游泳实验结果属于II群与G1-G3关系密切。悬尾实验结果也与G4相关性密切。因此,这三种行为学指标最适合于评价单胺前体的利用效率及神经调节作用。

图2 行为学指标与生化指标相关性热图
3 讨论
CUMS模型近年来已经成为研究啮齿动物抑郁病理机制的经典模型之一。动物暴露于CUMS一段时间后,其抑郁行为的发展接近于人类抑郁症临床症状,如对奖赏的反应性降低(快感缺乏),身体活动和行为发生改变(习得性无助),毛发修饰和性行为改变[14]。目前,行为学是判定抑郁模型的主要标准,以判断CUMS模型是否造模成功及干预是否有效。本实验显示CUMS诱导的小鼠体重和糖水偏好率显著下降,SFSP和WPC显著提升了抑郁小鼠体重和糖水偏好率。Orosco等[15]发现长期食用α-乳清蛋白的小鼠相比富含酪蛋白的饮食,对糖水的偏好明显增加,与本研究一致。葵花籽蛋白和乳清蛋白显著减少了悬尾和强迫游泳不动时间,预防抑郁小鼠在矿场和高架十字迷宫的焦虑行为,二者效果相当。Ahmed等[16]发现暴露于压力源中的小鼠在悬尾和强迫游泳实验中不动时间显著增加,给予乳清蛋白分离物的小鼠不动时间显著减少。研究报道[15,17],给予富含乳清蛋白饮食的小鼠在旷场实验中进入中央区域次数和高架十字迷宫中进入总次数,开臂次数和开臂时间百分比显著增加,显示抗焦虑效果。本实验中与模型组相比,乳清蛋白组小鼠进入中央区域次数虽无显著性差异,但进入次数多于抑郁小鼠。表明葵花籽蛋白可改善小鼠抑郁行为。
抑郁症的发展伴随氧化应激的发生,抑郁症患者血浆中SOD等抗氧化因子水平显著降低,而MDA水平显著升高[18]。ROS在某些神经精神疾病如重度抑郁中起作用,如果ROS的浓度超过人体中和能力,会改变氧化剂和抗氧化因子之间的平衡而造成氧化损伤[19]。本研究显示葵花籽蛋白能够显著提升抑郁小鼠皮层内GSH-Px、SOD和CAT活性,降低MDA和ROS浓度,其与乳清蛋白抗抑郁效果相当。研究[20]报道WPC可下调大鼠体内ROS和NO水平,防止氧化损伤的发展。表明葵花籽蛋白能够发挥类似乳清蛋白的抗抑郁作用,通过改善小鼠皮层内氧化应激状态,减少自由基的产生,调节体内氧化因子与抗氧化子的平衡起到改善抑郁的作用。
长期应激压力会激活下丘脑-垂体-肾上腺轴,从而导致循环中的糖皮质激素(如啮齿类动物的CORT或灵长类动物的皮质醇)增加,皮质醇异常升高可能导致抑郁症的发展[21]。本结果显示CUMS诱导小鼠血浆CORT含量显著降低,葵花籽蛋白可以逆转其含量降低。单胺类神经递质在抑郁症中起着重要作用,5-HT、NE和DA等参与调节精神活动、情绪反应、睡眠和性欲等与神经系统有关的生理反应。BDNF是一种BDNF-TrkB信号转导的突触功能和神经可塑性的调节因子,其和神经元形成、快感缺乏症以及学习记忆障碍等方面有关[22]。本实验发现抑郁小鼠海马中5-HT、DA、NE和BDNF含量显著降低,葵花籽蛋白可明显抑制CUMS诱导的小鼠海马中神经递质和BDNF水平降低,其效果与乳清蛋白效果相当。研究报道乳清蛋白分离物显著提高抑郁小鼠体内5-HT、DA、NE,其效果与氟西汀相当[16],这与本实验结果一致。研究发现5-HT具有抗氧化性,是氧化应激信号通路的关键调节剂之一,5-HT的产生会影响ROS水平,从而来调节氧化应激[23],这与我们的相关性分析一致,表明5-HT与氧化应激存在相关性。表明葵花籽蛋白可能通过调节单胺类神经递质减少和改善单胺能神经元功能不足,增强大脑神经可塑性而发挥抗抑郁作用。
Trp进入大脑的转运是由亮氨酸偏爱的L型氨基酸转运载体1系统介导的,Trp/LNAA的比例决定了Trp进入大脑的流量,从而决定5-HT的生物合成,被认为是脑Trp可用性的敏感指数[24],增大Trp/LNAA 比率,可以促进Trp穿过血脑屏障进入大脑,合成神经递质5-HT,参与情绪调节。本结果显示抑郁小鼠血清中Trp、Phe、Tyr浓度及Trp/LNAA比值明显低于正常组,给予葵花籽蛋白和乳清蛋白可显著抑制CUMS诱导的小鼠血清中Trp浓度和Trp/LNAA比值的降低。Markus等[25]报道,受试者服用α-乳清蛋白可增加血浆中Trp及Trp/LNAA的比例,并可能通过改变脑内血清素的含量来提高应对能力。提示葵花籽蛋白可能通过调节Trp浓度以及Trp/LNAA比值,促进Trp进入大脑,增强5-HT的合成和释放而发挥抗抑郁作用。
综上,葵花籽蛋白可显著改善抑郁,活性与乳清蛋白相当,主要通过改善抑郁模型小鼠大脑氧化应激损伤和提高单胺类神经递质浓度而实现。但是,以葵花籽蛋白为主要食物蛋白来源在在现实中难以实现,目前国外市场主要的富含葵花籽蛋白的产品是葵花籽酱,但我国消费比较少。有研究显示,蛋白水解物比完整或纯Trp能更明显、更快和更持久的增加大脑Trp[26]。因此,下一步研究需要集中于葵花籽富含Trp的水解物组分的鉴定,开发相应的食品配料,用于少量摄取即可发挥预防抑郁的作用。
