桦褐孔菌化学成分的胆碱酯酶抑制和细胞毒活性研究
2020-07-29魏艳梅陈惠琴梅文莉陈志宝戴好富
魏艳梅,陈惠琴,杨 理,梅文莉,陈志宝,3*,戴好富*
1黑龙江八一农垦大学生命科学技术学院,大庆 163319;2海南省黎药资源天然产物研究与利用重点实验室 中国热带农业科学院热带生物技术研究所,海口 571101;3广东海洋大学农学院,湛江 524088
桦褐孔菌(Inonotusobliquus),也称作桦树茸、白桦茸,是俄罗斯的一种民间药用真菌,主产于北纬40°~50°的高寒地区,在我国主要分布于吉林和黑龙江省,其寄生于白桦树上,生长期达15~20年,可耐零下40 ℃的极寒[1]。桦褐孔菌入药部位主要是菌核,大量药理实验表明其有治疗糖尿病[2]、抗癌[3,4](乳腺癌、肝癌、胃癌、肺癌、宫颈癌)、抗病毒[5]和增强免疫力[6]等作用。还有研究发现从桦褐孔菌中分离得到的桦褐孔菌醇可以保护PC12细胞免受氧葡萄糖剥夺-再恢复引起的损伤[7],表明其有用于治疗中风的可能。而目前关于桦褐孔菌中化合物对与神经系统相关的胆碱酯酶抑制作用的研究较少,为了进一步明确桦褐孔菌中的药理活性成分,本课题对桦褐孔菌乙酸乙酯部分进行了化学成分研究,并对分离得到的所有单体化合物进行胆碱酯酶抑制活性以及细胞毒活性测试。
1 仪器与材料
Bruker AV-500型超导核磁共振波谱仪(瑞士Bruker公司);Autospec300质谱仪(英国VG公司);分析型高效液相色谱仪(美国Agilent公司);半制备高效液相色谱仪(美国Dionex公司);红外光谱仪(Nicolet 380美国赛默飞世尔Thermo公司);紫外光谱仪(UV-2550 Shimadzu);旋光仪MCP 5100(奥地利Anton Paar有限公司);N-1000(2 L)立式旋转蒸发仪和CA-1111冷却水循环装置(上海爱朗仪器有限公司);SHZ-D(Ⅲ)循环真空泵(上海隆拓仪器设备有限公司);SW-40超净工作台(上海博讯实业有限公司医疗设备厂);ELX-800酶标仪(美国宝特公司);AS 220.R2 万分之一电子秤(RADWAG Wagi Elektroniczne);Sephadex LH-20凝胶(Merck Co.,Ltd.);C18反相硅胶(20~45 μm,日本Fuji Silysia Chemical Ltd公司);柱层析用硅胶和薄层层析硅胶板(青岛海洋化工厂);乙酰胆碱酯酶、丁酰胆碱酯酶、碘代硫代乙酰胆碱、二硫代二硝基苯甲酸(DNTB)和他克林均购自Sigma公司;人慢性髓原白血病细胞(K562)、人肝癌细胞(BEL-7402)、人胃癌细胞(SGC-7901)、人肝癌细胞(HepG2)购买自中国中科院上海生命科学研究院,人肺癌细胞(A549)和人宫颈癌细胞(Hela)购买自中南大学实验动物学部。
桦褐孔菌样品于2017年6月购买自俄罗斯,经中国热带农业科学院热带生物技术研究所王军博士鉴定为桦褐孔菌(Inonotusobliquus),标本(No.20170620)存放于中国热带农业科学院热带生物技术研究所。
2 提取与分离
将块状的桦褐孔菌(13.0 kg)粉粹,用95%的乙醇浸泡提取3次,减压浓缩至无醇味,得到乙醇浸膏0.76 kg。将乙醇浸膏用水分散形成悬浊液,依次用石油醚和乙酸乙酯分别萃取3次,分别浓缩得石油醚萃取物(32.8 g)和乙酸乙酯萃取物(211.0 g)。将乙酸乙酯萃取物(211.0 g)经减压硅胶柱色谱,以石油醚-乙酸乙酯(100∶1→1∶1)梯度洗脱得到28个流份(Fr.1~Fr.28)。
Fr.3重结晶得化合物4(2.5 g)。Fr.5(17.0 g)先经C18反相硅胶柱色谱以甲醇-水(1∶1→1∶0)梯度洗脱,得到25个流份(Subfr.5-1~Subfr.5-25)。Subfr.5-18(258.9 mg)经硅胶柱色谱以石油醚-氯仿-丙酮(10∶5∶0.1→0∶1∶1)梯度洗脱,得到16个流份(Subfr.5-18-1~Subfr.5-18-16)。Subfr.5-18-13(45.8 mg)经硅胶H柱色谱以石油醚-乙酸乙酯(20∶1)等梯度洗脱,得到化合物8(25.8 mg)。Subfr.5-18-15(42.0 mg)经硅胶H柱色谱以石油醚-氯仿-乙酸乙酯(6∶5∶1)等梯度洗脱,得到化合物7(22.5 mg)。Fr.9(5.2 g)经硅胶柱以石油醚-氯仿-乙酸乙酯(6∶3∶0.01→0∶1∶1)梯度洗脱,得到15个流份(Subfr.9-1~Subfr.9-14),Subfr.9-9(1.0 g)经硅胶柱以石油醚-氯仿-丙酮(30∶1∶0.3→0∶1∶1)梯度洗脱得到5个流份(Subfr.9-9-1~Subfr.9-9-5),将Subfr.9-9-3重结晶得化合物3(33.4 mg)。Subfr.9-15(1.4 g)经硅胶柱以石油醚-二氯甲烷-异丙醇(5∶3∶0.25→1∶2∶0)梯度洗脱,得到22个流份(Subfr.9-15-1~Subfr.9-15-22),Subfr.9-15-3重结晶得到化合物2(65.2 mg)。Fr.11(4.3 g)经C18反相硅胶柱色谱以甲醇-水(1∶1→1∶0)梯度洗脱,得到33个流份(Subfr.11-1~Subfr.11-33)。Subfr.11-27(840.6 mg)经硅胶柱以石油醚-乙酸乙酯(40∶1→10∶1)梯度洗脱,得到24个流份(Subfr.11-27-1~Subfr.11-27-24)。Subfr.11-27-12(8.5 g)经制备TLC以氯仿-甲醇(100∶1)等梯度洗脱得化合物1(8.0 mg)。
Fr.19(7.4 g)经C18反相硅胶柱色谱以甲醇-水(3∶7→1∶0)梯度洗脱,得到32个流份(Subfr.19-1~Subfr.19-32)。Subfr.19-3(112.8 mg)经Sephadex LH-20凝胶柱以氯仿-甲醇(1∶1)除杂,再经硅胶柱以石油醚-丙酮(10∶1)等梯度洗脱得化合物9(22.5 mg)。Subfr.19-23(155.9 mg)经硅胶柱石油醚-氯仿-乙酸乙酯(10∶5∶1→∶1∶2∶1)梯度洗脱得到4个流份(Subfr.19-23-1~Subfr.19-23-4)。Subfr.19-23-1(12.9 mg)经制备TLC以石油醚-氯仿-异丙醇(5∶5∶0.5)展开得到化合物5(6.4 mg)。Subfr.19-23-4(12.7 mg)先经Sephadex LH-20凝胶柱除杂,再经硅胶柱以氯仿-甲醇(60∶1)等梯度洗脱得到化合物6(3.9 mg)。
Fr.26(25.3 mg)经C18反相硅胶柱色谱,以甲醇-水(1∶9→1∶0)梯度洗脱,得到12个流份(subf.26-1~Subfr.26-12)。Subfr.26-2(0.4 g)经凝胶柱色谱(100%甲醇)划分为5个流份(Subfr.26-2-1~Subfr.26-2-5),Subfr.26-2-4(82.1 mg)通过半制备HPLC(C18柱,甲醇-酸水V∶V = 18∶82等梯度洗脱,流速为4 mL/min,检测波长254 nm)分离得到化合物10(5.5 mg,tR=6 min)和11(5.1 mg,tR=8 min)。Subfr.26-4-9(20.0 mg)经半制备HPLC(C18柱,甲醇-酸水V∶V = 35∶65等梯度洗脱,流速为4 mL/min,检测波长254 nm)分离得到化合物12(1.3 mg,tR=7 min)。
3 结构鉴定
化合物1白色粉末(CHCl3);ESI-MS:m/z445[M + H]+;分子式为C30H52O2;1H NMR(500 MHz,CDCl3)δ:3.20(1H,dd,J= 11.5,4.8 Hz,H-3),1.22(3H,s,H-29),1.12(3H,s,H-30),1.06(3H,s,H-25),0.97(3H,s,H-26),0.96(3H,s,H-27),0.84(3H,s,H-24),0.81(3H,s,H-23),0.76(3H,s,H-28);13C NMR(125 MHz,CDCl3)δ:38.8(C-1),27.5(C-2),79.1(C-3),39.0(C-4),55.3(C-5),18.5(C-6),34.7(C-7),41.5(C-8),55.3(C-9),37.2(C-10),21.5(C-11),29.2(C-12),37.6(C-13),43.7(C-14),27.7(C-15),35.7(C-16),44.8(C-17),48.4(C-18),50.1(C-19),73.6(C-20),28.9(C-21),40.4(C-22),28.1(C-23),15.5(C-24),16.3(C-25),16.3(C-26),15.0(C-27),19.4(C-28),24.9(C-29),31.7(C-30)。上述波谱数据与文献[8]数据对照基本一致,故鉴定化合物1为monogynol A(图1)。

图1 化合物1~12的化学结构
化合物2白色粉末(CHCl3);ESI-MS:m/z457[M + H]+;分子式为C30H48O3;1H NMR(500 MHz,CDCl3)δ:4.58(1H,s,H-30a),4.46(1H,s,H-30b),2.87(1H,m,H-3),1.54(3H,s,H-29),1.15(1H,d,J= 12.6 Hz,H-9),0.83(3H,s,H-27),0.76(3H,s,H-23),0.76(3H,s,H-24),0.66(3H,s,H-26),0.55(3H,s,H-25);13C NMR(125 MHz,CDCl3)δ:38.3(C-1),27.2(C-2),76.9(C-3),38.6(C-4),55.0(C-5),18.0(C-6),34.0(C-7),40.3(C-8),50.0(C-9),36.8(C-10),20.5(C-11),25.2(C-12),37.7(C-13),42.1(C-14),30.2(C-15),31.8(C-16),55.5(C-17),48.6(C-18),46.7(C-19),150.4(C-20),29.3(C-21),36.4(C-22),28.2(C-23),15.8(C-24),15.9(C-25),16.0(C-26),14.5(C-27),177.3(C-28),19.0(C-29),109.7(C-30)。上述波谱数据与文献[9]数据对照基本一致,故鉴定化合物2为桦木酸。
化合物3白色粉末(CHCl3);ESI-MS:m/z443[M + H]+;分子式为C30H50O2;1H NMR(500 MHz,CDCl3)δ:4.68(1H,br s,H-30a),4.58(1H,br s,H-30a),3.79(1H,d,J= 10.7 Hz,H-28a),3.33(1H,d,J= 10.7 Hz,H-28b),3.18(1H,dd,J= 11.4,4.8 Hz,H-3),1.68(3H,s,H-29),1.64(1H,m,H-13),1.60(1H,m,H-18),1.02(3H,s,H-26),0.98(3H,s,H-27),0.96(3H,s,H-23),0.82(3H,s,H-25),0.76(3H,s,H-24);13C NMR(125 MHz,CDCl3)δ:38.8(C-1),27.5(C-2),79.1(C-3),39.0(C-4),55.4(C-5),18.4(C-6),34.4(C-7),41.0(C-8),50.5(C-9),37.3(C-10),21.0(C-11),25.3(C-12),37.4(C-13),42.8(C-14),27.2(C-15),29.3(C-16),47.9(C-17),48.9(C-18),47.9(C-19),150.6(C-20),29.9(C-21),34.1(C-22),28.1(C-23),15.5(C-24),16.3(C-25),16.1(C-26),14.9(C-27),60.2(C-28),19.2(C-29),109.8(C-30)。上述波谱数据与文献[10]数据对照基本一致,故鉴定化合物3为白桦酯醇。
化合物4白色粉末(CHCl3);ESI-MS:m/z427[M + H]+;分子式C30H50O;1H NMR(500 MHz,CDCl3)δ:5.09(1H,t,J= 7.0 Hz,H-24),3.23(1H,dd,J= 11.6,4.5 Hz,H-3),1.68(3H,s,H-26),1.60(3H,s,H-27),0.99(3H,s,H-28),0.97(3H,s,H-19),0.90(3H,d,J= 6.4 Hz,H-21),0.87(3H,s,H-30),0.80(3H,s,H-28),0.68(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:36.5(C-1),28.0(C-2),79.1(C-3),39.0(C-4),50.5(C-5),18.4(C-6),26.6(C-7),134.5(C-8),134.5(C-9),37.2(C-10),21.1(C-11),31.0(C-12),44.6(C-13),49.9(C-14),31.1(C-15),28.3(C-16),50.5(C-17),15.9(C-18),19.3(C-19),36.4(C-20),18.8(C-21),35.7(C-22),25.1(C-23),125.4(C-24),131.0(C-25),25.9(C-26),17.8(C-27),15.6(C-28),28.1(C-29),24.4(C-30)。上述波谱数据与文献[11]数据对照基本一致,故鉴定化合物4为羊毛甾醇。
化合物5白色粉末(CHCl3);ESI-MS:m/z459[M + H]+;分子式C30H50O3;1H NMR(500 MHz,CDCl3)δ:5.21(1H,t,J= 7.4 Hz,H-24),4.01(1H,dd,J= 10.8,4.0 Hz,H-21),3.82(1H,dt,J= 10.6,2.9 Hz,H-22),3.71(1H,t,J= 10.6 Hz,H-21),3.22(1H,dd,J= 11.6,4.5 Hz,H-3),1.75(3H,s,H-26),1.68(3H,s,H-27),0.99(3H,s,H-28),0.98(3H,s,H-19),0.85(3H,s,H-30),0.81(3H,s,H-29),0.77(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:35.7(C-1),28.0(C-2),79.1(C-3),39.0(C-4),50.5(C-5),18.4(C-6),26.6(C-7),134.2(C-8),134.7(C-9),37.2(C-10),21.2(C-11),27.5(C-12),44.8(C-13),49.8(C-14),30.9(C-15),30.9(C-16),47.4(C-17),16.0(C-18),19.3(C-19),43.2(C-20),63.6(C-21),75.4(C-22),30.0(C-23),121.0(C-24),135.9(C-25),26.1(C-26),18.2(C-27),15.6(C-28),28.1(C-29),24.4(C-30)。上述波谱数据与文献[12]数据对照基本一致,故鉴定化合物5为inoterpene D。
化合物6白色粉末(CHCl3);ESI-MS:m/z457[M + H]+;分子式C30H48O3;1H NMR(500 MHz,CDCl3)δ:8.31(1H,s,H-21),5.44(1H,d,J= 6.3 Hz,H-7),5.36(1H,d,J= 6.4 Hz,H-11),3.00(1H,m,H-3),1.09(3H,s,H-26),1.06(3H,s,H-27),0.91(3H,s,H-28),0.90(3H,s,H-19),0.84(3H,s,H-30),0.77(3H,s,H-29),0.56(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:35.4(C-1),27.5(C-2),76.8(C-3),38.3(C-4),48.9(C-5),22.6(C-6),119.7(C-7),142.5(C-8),145.7(C-9),37.0(C-10),116.1(C-11),34.8(C-12),43.4(C-13),49.5(C-14),31.1(C-15),26.3(C-16),48.9(C-17),16.4(C-18),22.5(C-19),48.7(C-20),79.1(C-21),24.0(C-22),28.2(C-23),57.7(C-24),70.7(C-25),28.7(C-26),27.1(C-27),16.1(C-28),28.3(C-29),25.5(C-30)。上述波谱数据与文献[13]数据对照基本一致,故鉴定化合物6为inonotsutriol C。
化合物7白色粉末(CHCl3);ESI-MS:m/z445[M + H]+;分子式C29H48O3;1H NMR(500 MHz,CDCl3)δ:5.39(1H,m,H-7),5.21(1H,dd,J= 15.3,7.3 Hz,H-23),5.15(1H,dd,J= 15.3,8.0 Hz,H-22),4.04(1H,tt,J= 11.0,4.8 Hz,H-3),3.38(3H,s,6-OCH3),3.16(1H,d,J= 4.7 Hz,H-6),2.02(1H,m,H-20),1.84(1H,m,H-24),1.01(3H,d,J= 6.6 Hz,H-21),0.99(3H,s,H-19),0.91(3H,d,J= 6.8 Hz,H-28),0.83(3H,d,J= 6.4 Hz,H-26),0.81(3H,d,J= 6.5 Hz,H-27),0.58(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:32.9(C-1),31.0(C-2),67.9(C-3),39.7(C-4),76.5(C-5),82.6(C-6),115.1(C-7),143.8(C-8),44.0(C-9),37.4(C-10),22.3(C-11),39.5(C-12),44.0(C-13),55.1(C-14),23.0(C-15),28.1(C-16),56.1(C-17),12.4(C-18),18.5(C-19),40.5(C-20),21.2(C-21),135.6(C-22),132.2(C-23),42.9(C-24),33.2(C-25),20.1(C-26),19.8(C-27),17.7(C-28),58.4(6-OCH3)。上述波谱数据与文献[14]数据对照基本一致,故鉴定化合物7为(3β,5α,6β,22E)-6-methoxyergosta-7,22-diene-3,5-diol。
化合物8白色粉末(CHCl3);ESI-MS:m/z429[M + H]+;分子式C28H44O3;1H NMR(500 MHz,CDCl3)δ:6.50(1H,d,J= 8.4 Hz,H-7),6.24(1H,d,J= 8.4 Hz,H-6),5.21(1H,dd,J= 15.3,7.5 Hz,H-23),5.13(1H,dd,J= 15.2,8.3 Hz,H-22),3.96(1H,dd,J= 10.6,4.6 Hz,H-3),0.99(3H,d,J= 6.4 Hz,H-21),0.90(3H,d,J= 6.8 Hz,H-28),0.88(3H,s,H-19),0.82(3H,d,J= 7.3 Hz,H-26),0.81(1H,d,J= 7.3 Hz,H-27),0.80(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:34.8(C-1),30.2(C-2),66.6(C-3),37.1(C-4),82.3(C-5),135.3(C-6),130.9(C-7),79.6(C-8),51.2(C-9),37.1(C-10),20.8(C-11),39.5(C-12),44.7(C-13),51.8(C-14),23.5(C-15),28.8(C-16),56.3(C-17),13.0(C-18),18.3(C-19),39.9(C-20),21.0(C-21),135.5(C-22),132.4(C-23),42.9(C-24),33.2(C-25),20.1(C-26),19.8(C-27),17.7(C-28)。上述波谱数据与文献[15]数据对照基本一致,故鉴定化合物8为过氧化麦角甾醇。
化合物9白色粉末(MeOH);ESI-MS:m/z169[M + H]+;分子式C8H8O4;1H NMR(500 MHz,CD3OD)δ:7.47(1H,m,H-7),7.46(1H,m,H-3),6.75(1H,d,J= 8.8 Hz,H-4),3.80(3H,s,H-8);13C NMR(125 MHz,CD3OD)δ:170.04(C-1),123.02(C-2),113.73(C-3),115.79(C-4),152.59(C-5),148.59(C-6),125.24(C-7),56.35(C-8)。上述波谱数据与文献[16]数据对照基本一致,故鉴定化合物9为香草酸。
化合物10黄色油状(MeOH);ESI-MS:m/z259[M + H]+;分子式C14H10O5;1H NMR(500 MHz,CD3OD)δ:9.69(1H,s,H-8),7.33(1H,m,H-6),7.32(1H,m,H-5′),6.91(1H,d,J= 8.0 Hz,H-7),6.85(1H,s,H-2′),6.74(2H,s,H-4,6′),5.22(1H,s,H-2);13C NMR(125 MHz,CD3OD)δ:104.8(C-2),115.8(C-4),130.8(C-5),126.4(C-6),116.2(C-7),147.2(C-8),153.7(C-9),193.1(C-10),146.1(C-1′),114.8(C-2′),146.7(C-3′),131.1(C-4′),115.4(C-5′),119.4(C-6′)。上述波谱数据与文献[17]数据对照基本一致,故鉴定化合物10为2-(3′,4′-二羟苯基)-1,3-胡椒环-5-醛。
化合物11无色油状(MeOH);ESI-MS:m/z243[M + H]+;分子式C11H14O6;1H NMR(500 MHz,DMSO-d6)δ:9.40(1H,s,OH-4),7.28(2H,s,H-2,H-6),5.10(1H,d,J= 6.9 Hz,OH-8),4.99(1H,m,H-8),4.74(1H,t,J= 5.9 Hz,OH-9),3.82(6H,s,OCH3-3,OCH3-5),3.68(1H,m,H-9a),3.60(1H,m,H-9b);13C NMR(125 MHz,DMSO-d6)δ:125.5(C-1),106.6(C-2),147.5(C-3),141.1(C-4),147.5(C-5),106.6(C-6),198.4(C-7),73.8(C-8),64.4(C-9),56.2(OCH3-1,OCH3-2)。上述波谱数据与文献[18]数据对照基本一致,故鉴定化合物11为2,3-二羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮。
化合物12无色油状(MeOH);ESI-MS:m/z227[M + H]+;分子式C11H14O5;1H NMR(500 MHz,CD3OD)δ:7.33(2H,s,H-2,H-6),3.95(1H,t,J= 6.2 Hz,H-9),3.91(6H,s,OCH3-3,OCH3-5),3.19(3H,t,J= 6.2 Hz,H-8);13C NMR(125 MHz,CD3OD)δ:129.3(C-1),107.3(C-2),149.0(C-3),142.6(C-4),149.0(C-5),107.3(C-6),199.7(C-7),41.7(C-8),58.9(C-9),56.9(OCH3-3,OCH3-5)。上述波谱数据与文献[19]数据对照基本一致,故鉴定化合物12为3-hydroxy-1-(4-hydroxy-3,5-dimethoxyphenyl)propan-1-one。
4 活性测试
4.1 胆碱酯酶抑制活性测试
采用Ellman法[20]测定各单体化合物的乙/丁酰胆碱酯酶抑制活性。取150 μL PBS缓冲液(pH为8.0)、10 μL待测化合物溶液和20 μL乙/丁酰胆碱酯酶溶液(浓度为0.1 U/mL)于96孔板中,于30℃放置15 min后,依次加入10 μL 5,5′-二硫-双-2-硝基苯甲酸溶液(DTNB,浓度为2 mM)和10 μL碘代硫代乙酰胆碱溶液(AICI,浓度为10 mM)/10 μL硫代碘代丁酰胆碱溶液(BICI,浓度为10 mM),充分混匀,30 min后,在412 nm波长下测定并记录每孔的吸光度,重复三次取平均值。以他克林作为阳性对照,DMSO作为阴性对照,试验重复操作3次。按下面公式计算各浓度下的抑制率,并计算得到化合物对乙/丁酰胆碱酯酶的半抑制浓度(IC50值)。

结果(表1)显示化合物2和3具有较好的乙酰胆碱酯酶抑制作用,化合物2、3、4和6显示有较好的丁酰胆碱酯酶抑制活性,其他化合物均未表现出明显活性。

表1 化合物的胆碱酯酶抑制活性
4.2 化合物对胆碱酯酶的动力学测试
按照“4.1”方法,在不同底物[S]和样品的浓度下,分别测定各反应体系的吸光度变化率,以底物浓度的倒数(1/[S])为横坐标,酶促反应初始速率的倒数(1/V)为纵坐标,绘制Lineweaver-Burk双倒数曲线图。然后根据米氏常数Km和最大反应速率数值(Vmax)的变化可判断抑制类型。以化合物浓度为横坐标,双倒数图中各个浓度直线的斜率为纵坐标,作二级曲线图,与X轴的截距为抑制常数Ki。
竞争型抑制剂的双倒数方程可表示为:
混合型抑制剂的双倒数方程可表示为:
式中,[S]为底物浓度,[I]为抑制剂浓度,Vmax为最大速率,Km为米氏常数,Ki和Kis分别表示抑制剂与游离酶和酶-底物复合物结合的解离常数。
由化合物2(A)和3(B)抑制乙酰胆碱酯酶的双倒数图(图2)可知,所有直线均交于第二象限内,该结果表明,化合物对乙酰胆碱酯酶的抑制属于混合型抑制剂,化合物既可以和游离酶结合也可以和酶-底物复合物结合。由化合物2(C)和3(D)抑制丁酰胆碱酯酶双倒数图(图3)可知,所有直线均交于Y轴,该结果表明,化合物2、3对丁酰胆碱酯酶的抑制均属于竞争型抑制剂,化合物与底物竞争酶的结合位点。
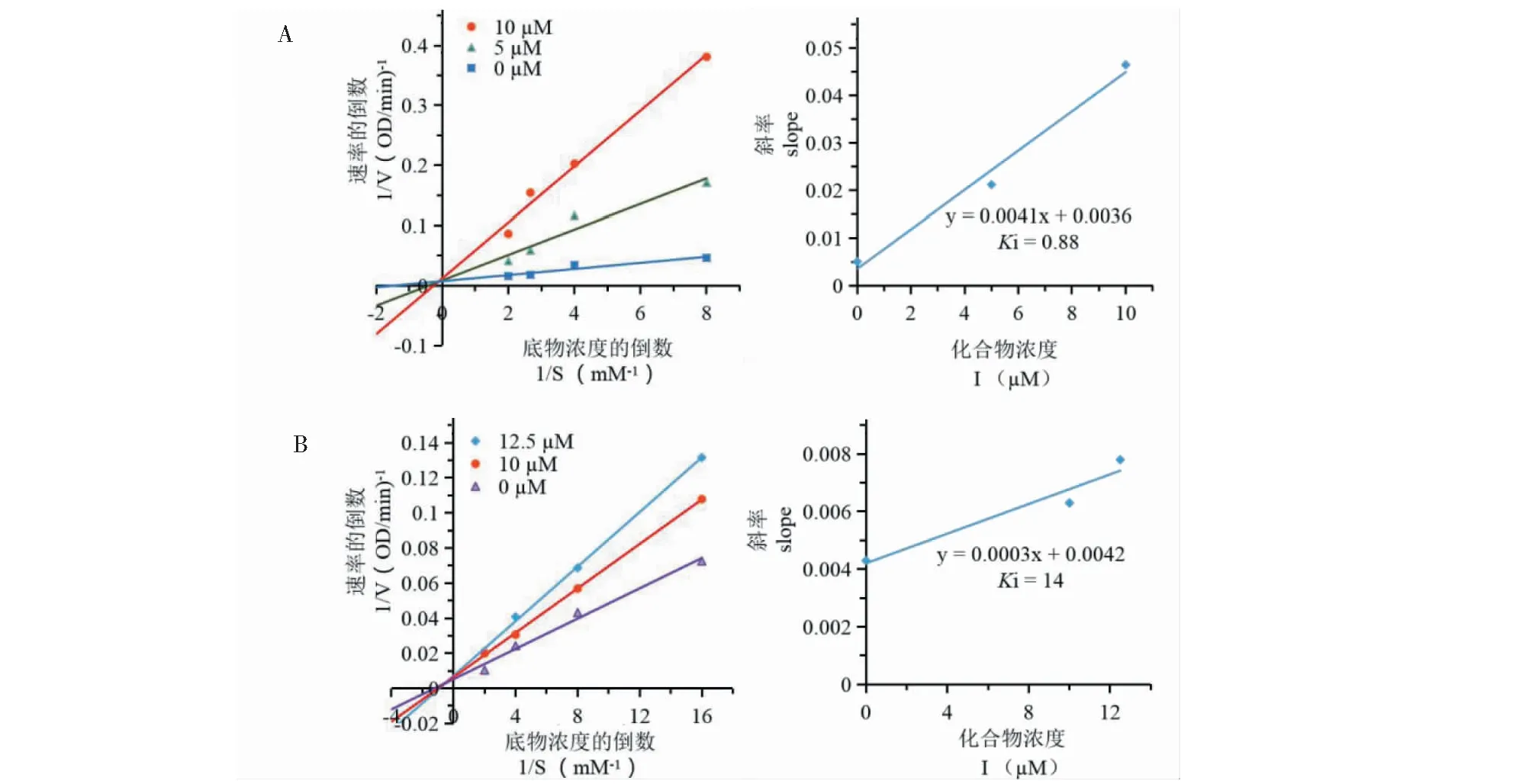
图2 化合物2(A)和3(B)抑制乙酰胆碱酯酶的Lineweaver-Burk双倒数图

图3 化合物2(C)和3(D)抑制丁酰胆碱酯酶的Lineweaver-Burk双倒数图
4.3 细胞毒活性测定
采用MTT法[21]测定化合物的肿瘤细胞抑制活性,分别在96孔板上接种100 μL浓度约5×104个/mL的待测细胞,于37 ℃,5% CO2,90%以上湿度条件下培养24 h,加入100 μL待测化合物溶液,继续培养72 h后,向每孔细胞中加入15 μL浓度为5 mg/mL的MTT溶液,4 h后吸走上清液,再向每孔加入100 μL DMSO,使其充分溶解。在490 nm波长下测定每孔的OD值,按下面公式计算肿瘤细胞生长抑制率。阳性对照组为盐酸阿霉素,阴性对照组为DMSO,待测化合物设为5个浓度梯度,横坐标表示待测化合物浓度,纵坐标表示抑制率,作图求出待测化合物的半数抑制浓度(IC50)值。

对化合物1~6和9~12进行细胞毒活性测试,结果(表2)表明化合物1、5和6对不同的细胞均表现出一定的抑制活性,化合物4、9、10、11和12对检测的所有细胞均没有细胞毒性(IC50> 100)。

表2 桦褐孔菌中化合物的细胞毒活性
5 讨论
桦褐孔菌具有悠久的民间药用历史,在临床应用方面疗效显著,在糖尿病、抗肿瘤等药用领域显示出较好疗效,目前已成为国内外许多学者的研究热点。桦褐孔菌的药理活性主要集中在抗肿瘤,降血糖等方面,对于其他方面的活性研究较少,因此有必要探索其潜在的其他生物活性,为充分挖掘其潜在价值提供理论支持。本研究对桦褐孔菌乙醇提取物的乙酸乙酯部位的化学成分进行系统研究,共分离鉴定了12个化合物,其中化合物1、10和11为首次从桦褐孔菌中分离得到。活性筛选结果显示,化合物1、5和6对多种肿瘤细胞显示出较好的细胞毒活性,根据文献报道化合物2和3对多种肿瘤细胞有较好的细胞毒活性[22,23],佐证了桦褐孔菌的抗肿瘤活性。除此之外,化合物2、3、4和6的丁酰胆碱酯酶抑制活性较好,化合物2和3对乙酰胆碱酯酶抑制活性较好。通过动力学分析阐明了这些化合物与胆碱酯酶的酶抑制机制,化合物2和3为乙酰胆碱酯酶混合型抑制剂,化合物能与乙酰胆碱酯酶的活性部位结合,也可以与酶和底物的复合物结合从而抑制其活性;而对丁酰胆碱酯酶则属于竞争型抑制,通过与其催化中心的活性位点相结合从而抑制其活性。胆碱酯酶是参与中枢神经系统的一种关键酶,神经退行性疾病如阿尔兹海默病(AD)就与大脑内乙酰胆碱的缺失有关,因此开发针对胆碱酯酶有活性的药物意义重大。本文初步阐释了化合物2和3抑制胆碱酯酶的作用机制,为桦褐孔菌针对阿尔兹海默病开发利用提供了科学依据。
