土牛膝抗炎成分分离、鉴定与含量测定研究
2020-07-29欧阳文罗懿钒王雄龙张云坤周华荣唐纯玉李顺祥
欧阳文,罗懿钒,李 震,王雄龙,张云坤,周华荣,唐纯玉*,李顺祥
1湖南中医药大学药学院,长沙 410208;2湖南时代阳光药业股份有限公司,永州 410116;3湖南食品药品职业学院;4湖南省中药活性物质筛选工程技术研究中心,长沙 410208;5湖南省抗感染中药工程技术研究中心;6湖南时代阳光博士后科研流动站协作研发中心,永州 410116
土牛膝别名倒钩草、倒梗草等,来源较为复杂,包括苋科植物粗毛牛膝AchyranthesasperaLinnacus、柳叶牛膝A.longifolia(Makino)Makino及牛膝A.bidentataBlume野生种的干燥根及根茎。具有活血祛瘀,泻火解毒,利尿通淋之功效。主治闭经,跌打损伤,风湿关节痛,痢疾,白喉,咽喉肿痛,疮痈,淋证,水肿[1]。“喉咽清”来源于民间验方,由土牛膝、马兰草、车前草和天名精四位药味组成,土牛膝为君药,具有清热解毒和利咽止痛的功效,主要用于肺胃实热所导致的咽部肿痛、发热、口渴、便秘、扁桃体炎、咽炎等证[2]。喉咽清口服液(颗粒)为国家重点新产品和国家医保目录品种,在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)防治中,于2020年2月7日被湖南省卫生健康委员会纳入《湖南省儿童新型冠状病毒感染临床诊断与治疗专家共识(试行第一版)》,用于儿童新型冠状病毒感染的防治,适于咽痛偏于风热者[3]。
土牛膝提取物具有很好的抗炎功效,Rao等[4]建立家兔声带炎症模型,观察研究了土牛膝提取物对大白兔急性咽喉炎的治疗作用,结果表明土牛膝提取物可以显著抑制家兔急性咽喉炎的症状。Ou等[5]研究土牛膝提取物的抗炎作用,结果表明土牛膝提取物对二甲苯致小鼠耳廓肿胀和鸡蛋清引起的大鼠足跖肿胀以及急性炎症导致的腹腔毛细血管通透性均有不同程度的抑制作用。前期本课题组对土牛膝化学成分进行了系统研究,已经分得16个单体化合物,包括蜕皮甾酮类和齐墩果酸为苷元的三萜皂苷类,还分得生物碱、脂肪酸及一种新异黄酮类化合物[6,7]。以脂多糖刺激小鼠单核巨噬细胞株RAW264.7,可以诱导细胞产生多种相关介质和细胞因子如NO、tumor necrosis factor-α(TNF-α)、interleukin-6(IL-6)、cyclooxygenase-2(COX-2)等而形成炎症细胞模型,此模型被广泛应用于抗炎药物的筛选评价。NO作为众多炎症介质中的重要因子之一,在调节多种生理功能方面起重要作用,例如血管扩张、神经传递和炎症应答等,其浓度可以用来评价炎症反应的强弱程度[8]。为进一步明确土牛膝抗炎活性成分,本课题组建立脂多糖刺激的RAW264.7炎症模型,分析不同土牛膝的抗炎作用,并在活性指导下对粗毛牛膝抗炎成分进行分离纯化,鉴定结构并测定主要活性成分含量随季节变化规律,现将研究结果报告如下。
1 材料与仪器
1.1 材料
粗毛牛膝(A.asperaLinnacus)和柳叶牛膝(A.longifolia(Makino)Makino)采自湖南永州马鞍岭瑶家寨湖南时代阳光药业股份有限公司种植基地,野生牛膝(A.bidentataBl.野生种)采自湖南长沙湖南中医药大学药用植物园,怀牛膝(A.bidentataBl.)采自河南焦作东岩村,以上品种均由湖南中医药大学药用植物学教研室王智老师鉴定,凭证标本保存(No.2018072201(粗毛牛膝)、2018072202(柳叶牛膝)、2018072501(野生牛膝)、2018102401(怀牛膝))在湖南中医药大学中药活性物质筛选工程技术研究中心。
1.2 仪器与试剂
小鼠单核巨噬细胞株(RAW264.7)购于中科院上海细胞库。竹节参皂苷IVa(PS010730)购买于成都普思生物科技股份有限公司,纯度大于98%;脂多糖、地塞米松、二甲基亚砜、thiazolyl blue tetrazolium bromide(MTT)(美国Sigma公司);dulbecco’s modified eagle media(DMEM)高糖培养基(美国gibco公司);胎牛血清fetal calf serum(FBS)(德国pan seratech公司);phosphate buffered saline(PBS)磷酸盐缓冲液(hyclone公司);NO检测试剂盒(碧云天公司);色谱级乙腈、甲醇、反相硅胶板(德国默克公司);octadecysilyl-A(ODS-A)和ODS-AQ(50 μm,日本YMC公司);柱层析硅胶(80~100目和200~300目),薄层色谱板(青岛海洋公司);常规提取分离用试剂甲醇等均为分析纯试剂(长沙汇虹试剂公司)。
AL104万分之一电子天平(梅特勒-托利多公司);C18色谱柱(日本YMC公司),LC-20A高效液相色谱仪(日本岛津公司);R204B3型旋转蒸发器(上海申顺科技有限公司);超净工作台(苏州艾克林净化设备有限公司);二氧化碳培养箱(美国Thermo公司);倒置显微镜(日本Olympus公司);低速冷冻离心机(湖南湘仪实验室仪器开发有限公司);酶标仪(美国Biotek公司);数显恒温水浴锅(上海齐欣科学仪器有限公司);G2-XS QTof超高效液相-质谱联用仪(美国Waters公司);INOVA-600 MHz高分辨超导核磁共振谱仪(瑞士Bruker公司)。
2 方法
2.1 RAW264.7细胞培养
参照文献[9,10],简述如下:将RAW264.7细胞接种于细胞培养瓶中,加入含10%灭活胎牛血清的DMEM培养基中,充分吹打混匀,放入37 ℃,5%CO2的培养箱内培养,每日在光学显微镜下观察细胞的生长状况,1天更换一次培养基,取对数生长期的细胞进行后续试验。另外还包括细胞传代、细胞冻存和细胞复苏等基本操作。
2.2 活性测试样品的制备与分离
取不同品种土牛膝和怀牛膝粉末约30 g,分别采用10、6、4倍甲醇回流提取三次,每次提取1 h,提取液过滤并减压浓缩和冷冻干燥得醇提取物。精确称取各提取物样品,DMSO完全溶解(终体积不得超过0.1%)。用完全培养基配制成相应浓度的稀释液,现配现用,用0.22 μm微孔滤器除菌后测定细胞毒性和抗炎活性。
粗毛牛膝(A.asperaL.)1.17 kg,阴干过20目筛,10倍甲醇回流提取3次,每次2 h,提取液浓缩并干燥得浸膏130 g。再将浸膏与117.5 g ODS-AQ全亲水性反相硅胶搅拌,低于60 ℃水浴锅挥干溶剂,经ODS柱层析(4cm×10 cm),利用甲醇-水溶液梯度洗脱,其中水、10%、30%、50%、70%、90%的甲醇-水溶液和纯甲醇,丙酮分别洗脱2 L,各分离部位减压浓缩干燥后,分别得到水洗脱物(110.5 g)、10%甲醇洗脱物(1.3 g)、30%甲醇洗脱物(2.42 g)、50%甲醇洗脱物(2.99 g)、70%甲醇洗脱物(4.37 g)、90%甲醇洗脱物(4.31 g)、100%甲醇洗脱物(3.39 g)、丙酮洗脱物(1.27 g),各部分测定活性。
合并50%~70%甲醇洗物3.0 g,用甲醇溶解后,拌硅胶10 g并挥干溶剂,过硅胶柱层析(2 cm×20 cm),采用二氯甲烷-甲醇(98∶2、97∶3、96∶4、95∶5、90∶10、80∶20、70∶30、2∶1、1∶1,纯甲醇)梯度洗脱,共获得40组分,其中Fr.15(二氯甲烷-甲醇90∶10洗脱)组分经过硅胶柱层析,得到Fr.15A-E五个组分,Fr.15B再反复通过硅胶柱,二氯甲烷-甲醇9∶1洗脱,分离得到化合物1(55 mg)和2(12 mg);Fr.15D过ODS柱层析,40%甲醇水反复洗脱分离,得化合物3(4.7 mg)。Fr.9(二氯甲烷-甲醇95∶5洗脱)组分,先过ODS-A反相色谱柱,55%甲醇洗脱纯化,并进一步经过硅胶柱分离(二氯甲烷-甲醇97∶3洗脱),获得两个主要组分(Fr.9A和Fr.9B),组分Fr.9A进一步经制备液相色谱(37%乙腈-水溶液)制备纯化,获得化合物4(7.0 mg)和5(4.4 mg)。组分Fr.9B进一步经制备液相色谱(37%乙腈-水溶液)制备纯化,获得化合物6(5.0 mg)和7(5.4 mg)。Fr.30(二氯甲烷-甲醇7∶3洗脱)组分,过ODS-A反相色谱柱,65%甲醇-0.1%甲酸水溶液反复洗脱纯化,获得化合物8(4.1 mg)。Fr.6(二氯甲烷-甲醇97∶3洗脱)组分,过ODS柱色谱,水-甲醇梯度洗脱得到7个亚组分Fr.6A~G,其中Fr.6B过ODS柱色谱,50%甲醇反复洗脱,得到结晶10(2.3 mg)。
100%甲醇洗脱物,经过ODS柱色谱,90%甲醇分离,主要化合物9(11.3 mg)以结晶形式析出。
2.3 化合物结构鉴定
通过分析理化性质,采用现代波谱技术(1H NMR、13C NMR及MS)方法解析,并结合对照品分析比较鉴定化合物结构。
2.4 MTT法分析样品细胞毒性实验
称取25 mg的MTT,放入10 mL的离心管中,加5 mL的PBS缓冲液,配成浓度为5 mg/mL的MTT溶液,超声完全溶解后用0.22 μm微孔滤器除菌,4 ℃避光保存。取生长状态良好,处于对数生长期的培养细胞,脱壁后,用含10%灭活胎牛血清的DMEM培养基配制成单细胞悬液,用细胞计数器计数,以3×104个/孔,每孔100 μL接种于96孔板中,置于37 ℃,5%CO2细胞培养箱中培养。设空白组、对照组和样品组。空白组无细胞,对照组加入含细胞的100 μL DMEM培养基。样品组分别加入不同浓度样品,使终体积为100 μL,每组设3个复孔,培养24 h。弃去旧培养基,再加入质量浓度为5 mg/mL的MTT溶液20 μL,置于CO2培养箱37 ℃孵育,4 h后弃去培养液,每孔加入150 μL DMSO溶液,在培养板平台震荡机上震荡10 min,置酶标仪中490 nm处测定各孔吸光值(OD值)。按公式计算细胞存活率。计算公式如下:

2.5 炎症模型中NO释放量检测
处于对数生长期的培养细胞,脱壁后,用含10%灭活胎牛血清的DMEM培养基制成单细胞悬液,细胞计数器计数,调节细胞密度为3×104个/mL,均匀接种于96孔培养板上,每孔100 μL,置37 ℃,5%CO2培养箱中培养24 h。将原培养液弃去,设置正常组、模型组和样品组。正常组不加LPS和样品;模型组在培养液中加入LPS溶液(终浓度1 μg/mL);样品组为不同浓度土牛膝提取物和单体化合物的稀释培养基100 μL,每组设置3个复孔。培养24 h,取其上清液于离心管中。按照试剂盒说明书中的操作方法,先将培养基按顺序加入各试剂,于波长550 nm处的酶标仪上测定各孔的吸光度值(OD值),根据标准曲线测定NO释放量(μM)。配置单体和提取物溶液时,DMSO(终体积不得超过0.1%)完全溶解,用完全培养基配制成相应浓度的稀释液,现配现用,并用0.22 μm微孔滤器除菌。
2.6 活性测试数据处理
2.7 反相液相色谱测定β-蜕皮甾酮条件
参照文献[11],岛津HPLC仪(LC-20A二元高压梯度仪,SPD-20A紫外检测仪),色谱柱为岛津YMC C18柱(250 mm × 4.6 mm,5 μm),检测波长250 nm,柱温30 ℃,流动相为乙腈-0.1%磷酸水溶液(16∶84,V/V),流速为1 mL/min。
2.8 含量测定样品制备
2.8.1 对照品的制备
精密称取β-蜕皮甾酮2.8 mg,置于10 mL容量瓶,加色谱甲醇溶解并定容,配置0.28 mg/mL的储液。精密吸取储液1 mL,置于另一10 mL容量瓶,加色谱甲醇定容,即得0.028 mg/mL的对照品溶液。
2.8.2 供试品制备
参考文献[12],称取药材粗粉(过四号筛)约0.1 g,精密称定,置于10 mL容量瓶,加甲醇至刻度,超声30 min(功率:40 kHz,100 W),放冷后甲醇定容,过0.45 μm微孔滤膜,即得供试品溶液,精密吸取20 μL进样,按色谱条件分析。
2.9 方法学考察
2.9.1 线性关系
精密吸取0.028 mg/mL的对照品溶液1、2、4、8、20 μL进样,按色谱条件分析,按照进样量(ng)和β-蜕皮甾酮峰面积计算线性回归方程。
2.9.2 精密度试验
精密吸取β-蜕皮甾酮对照品溶液10 μL,按照色谱条件中的方法测定,重复进样6次。
2.9.3 重现性试验
分别取同一批粉末6份,按样品溶液的制备操作,并按色谱条件进行测定。
2.9.4 样品稳定性试验
取同一份样品溶液,室温放置,分别于0、2、4、8、12、24 h测定β-蜕皮甾酮峰面积值。
2.9.5 回收率试验
采用加样回收试验,精密吸取已知含量的柳叶牛膝粉末,加入大体相同量的对照品溶液,流动相定容至10 mL容量瓶,过膜,微量进样器精密吸取20 μL按照色谱条件下进行测定。
3 结果
3.1 MTT法测定不同土牛膝甲醇提取物对RAW264.7细胞的毒性作用
由表1可知,柳叶牛膝和野生牛膝醇提取物在25~400 μg/mL时,细胞存活率高,且与正常组相比,无显著性差异(P>0.05),而粗毛牛膝和怀牛膝提取物在浓度为400~120 0 μg/mL时,细胞均有不同程度地死亡。故本研究选取浓度为50、100、200 μg/mL进行后续干预,测定抗炎活性。

表1 各提取物的细胞存活率
3.2 土牛膝各提取物对LPS诱导RAW264.7细胞释放NO的影响研究
由表2可知,对照组与模型组比较,LPS诱导RAW264.7细胞时,使NO释放量明显增加(P<0.01)。与模型组相比,怀牛膝和不同土牛膝提取物干预时,NO释放量均有减少,且呈剂量依赖性抑制;在浓度为200 μg/mL时,三种土牛膝的抗炎作用均强于怀牛膝,对比不同土牛膝醇提取物的NO释放量发现,抑制作用最强的为粗毛牛膝,NO释放量为12.92±0.50 μM,与模型组有极显著差异。故进一步对粗毛牛膝醇提取物进行分离,测定活性。

表2 不同提取物对LPS诱导RAW264.7细胞释放NO的影响
3.3 MTT法测定粗毛牛膝各分离部位对RAW264.7细胞的毒性作用
粗毛牛膝醇提取物经反相柱层析分离,水-甲醇梯度洗脱得到各个洗脱组分。各部分细胞毒性结果如表3所示,除去90%甲醇洗物组外,其它部位均在浓度范围为25~200 μg/mL时无明显细胞毒性,细胞存活率较高;在浓度为400~120 0 μg/mL时,细胞均有不同程度地死亡。故除90%甲醇洗物组外,各洗脱组分均选取浓度为50、100、200 μg/mL进行干预,测定抗炎活性。

表3 粗毛牛膝各分离部位的细胞存活率
3.4 土牛膝各分离部位对LPS诱导RAW264.7细胞释放NO的影响研究
各洗脱部分抗炎结果如表4所示,与模型组相比,粗毛牛膝各洗脱部位作用后,NO释放量均有减少,且呈浓度依赖性。50和100 μg/mL的浓度下,水洗物对NO释放量无抑制作用(P>0.05),浓度为200 μg/mL的水洗物和50、100 μg/mL的10%甲醇洗物对NO释放量有抑制作用(P<0.05);其他组在各浓度下对NO释放量具有显著抑制作用(P<0.01)。另外,30%、50%、70%、100%甲醇洗物和丙酮洗物在50、100、200 μg/mL的浓度下对NO释放量的抑制作用均极其明显。综合各洗脱物得率及抗炎活性,确定50%、70%及100%甲醇洗物为重点分离对象。

表4 粗毛牛膝分离部位对LPS诱导RAW264.7细胞释放NO的影响
3.5 化合物结构鉴定
化合物1为白色晶体;紫外光下显暗紫色荧光,香草醛-浓硫酸反应显蓝绿色。液质联用分析,给出准分子离子峰[M+H]+(481.318 1),[M+H-2H2O]+(445.297 0),结合文献[7]和课题组前期分离对照品,确定该化合物为β-蜕皮甾酮。
化合物2为无色针状结晶;紫外光下可见暗紫色荧光,该化合物的比移值与β-蜕皮甾酮相似,香草醛-浓硫酸反应显示红色。与已知对照品比较,确定为牛膝甾酮,高效液相色谱分析显示两个峰。进行超高液相色谱-四级杆串联飞行时间质谱分析,出现两个峰,质谱数据显示相同准分子离子峰[M+H]+(481.316 3和481.316 0),证明两个化合物分子式均为C27H44O7,结合文献比较[13],鉴定化合物为25-R牛膝甾酮,25-S牛膝甾酮。
化合物3为白色结晶性粉末;紫外光下可见暗紫色荧光。负离子模式ESI-MS给出准分子离子峰[M+2H2O-H]-(531.271 6),经过与前期分离对照品在三种高效液相色谱条件下比较,确定为水龙骨甾酮B。
化合物4白色粉末状物质;1H NMR(600 MHz,CD3OD)δ:7.45(1H,d,J= 15.6 Hz,H-7),7.13(1H,s,H-2),7.07(2H,d,J= 7.8 Hz,H-2′,6′),7.04(1H,d,J= 7.8,H-6),6.81(1H,d,J= 7.8 Hz,H-5),6.73(2H,d,J= 7.8 Hz,H-3′,5′),6.42(1H,d,J= 15.6 Hz,H-8),3.90(3H,s,3-OCH3),3.48(2H,t,J= 7.2 Hz,H-8′),2.77(2H,t,J= 7.2 Hz,H-7′);13C NMR(150 MHz,CD3OD)δ:169.5(s,C-9),149.6(s,C-4),157.2(s,C-3),142.4(d,C-7),128.6(s,C-1),123.5(d,C-6),119.0(d,C-8),116.8(d,C-5),111.8(d,C-2),131.6(s,C-1′),131.0(d,C-2′,6′),150.1(s,C-4′),116.6(d,C-3′,5′),56.7(q,3-OCH3),42.9(t,C-8′),36.1(t,C-7′)。以上波谱数据与文献[14,15]基本一致,鉴定为N-反式阿魏酰酪胺。
化合物5为白色粉末状物质;核磁共振氢谱和碳谱数据同化合物4基本一致,且两者一同制备分离得到,化合物5长时间放置不太稳定,可逐步转化为化合物4;两者的区别在于化合物5中δ5.83(1H,d,J= 12.6 Hz),6.63(1H,d,J= 12.6 Hz)是一个顺式双键。1H NMR(600 MHz,CD3OD)δ:7.38(1H,s,H-2),6.94(1H,d,J= 7.8,H-6),6.75(1H,d,J= 7.8 Hz,H-5),6.63(1H,d,J= 12.6 Hz,H-7),5.83(1H,d,J= 12.6 Hz,H-8),3.85(3H,s,3-OCH3),7.01(2H,d,J= 7.8 Hz,H-2′,6′),6.70(2H,d,J= 7.8 Hz,H-3′,5′),3.41(2H,t,J= 7.2 Hz,H-8′),2.71(2H,t,J= 7.2 Hz,H-7′);13C NMR(150 MHz,CD3OD)δ:170.3(s,C-9),148.5(s,C-4),156.9(s,C-3),138.4(d,C-7),131.1(s,C-1),128.5(d,C-6),124.8(d,C-8),115.8(d,C-5),113.9(d,C-2),56.3(q,3-OCH3),131.4(s,C-1′),130.7(d,C-2′,6′),116.2(d,C-3′,5′),148.5(s,C-4′),42.3(t,C-8′),35.5(t,C-7′)。以上波谱数据与文献[14,15]报道一致,故鉴定为N-顺式阿魏酰酪胺。
化合物6白色粉末;1H NMR(600 MHz,CD3OD)δ:6.79(1H,s,H-2),6.74(1H,d,J= 7.8 Hz,H-5),6.94(1H,d,J= 7.8 Hz,H-6),2.73(2H,t,J= 7.2 Hz,H-7),3.44(2H,t,J= 7.2 Hz,H-8),7.38(1H,s,H-2′),6.70(1H,d,J= 7.8 Hz,H-5′),6.62(1H,m,H-6′),6.62(1H,d,J= 12.6 Hz,H-7′),5.84(1H,d,J= 12.6 Hz,H-8′),3.80(3H,s,3-OCH3),3.84(3H,s,3′-OCH3);13C NMR(150 MHz,CD3OD)δ:131.9(s,C-1),113.9(d,C-2),148.5(s,C-3),148.9(s,C-4),124.8(d,C-5),l16.1(d,C-6),138.3(d,C-7),121.5(d,C-8),170.4(s,C-9),128.5(s,C-1′),113.4(d,C-2′),146.0(s,C-3′),148.5(s,C-4′),122.1(d,C-5′),115.8(d,C-6′),36.0(t,C-7′),42.3(t,C-8′),56.3(q,3′-OCH3),56.2(q,3-OCH3)。以上数据与文献[14,15]报道一致,故鉴定为N-顺式阿魏酰-3-甲氧基酪胺。
化合物7为白色粉末状物质;核磁共振氢谱和碳谱数据同化合物6基本一致,两者一同制备分离得到,且化合物6长时间放置不太稳定,可逐步转化为化合物7;两者的区别在于化合物7中δ6.33(1H,d,J= 15.6 Hz),7.36(1H,d,J= 15.6 Hz)是一个反式双键。1H NMR(600 MHz,CD3OD)δ:6.75(1H,s,H-2),6.68(1H,d,J= 7.8 Hz,H-5),6.60(1H,d,J= 7.8 Hz,H-6),2.70(2H,t,J= 7.3 Hz,H-7),3.42(2H,t,J= 7.3 Hz,H-8),7.05(1H,s,H-2′),6.72(1H,d,J= 8.0 Hz,H-5′),6.95(1H,d,J= 7.8 Hz,H-6′),7.36(1H,d,J= 15.6Hz,H-7′),6.33(1H,d,J= 15.6 Hz,H-8′),3.76(3H,s,3-OCH3),3.81(3H,s,3′-OCH3);13C NMR(150 MHz,CD3OD)δ:132.0(s,C-1),113.4(d,C-2),149.0(s,C-3),149.8(s,C-4),123.2(d,C-5),116.4(d,C-6),142.0(d,C-7),118.7(d,C-8),169.2(s,C-9),128.2(s,C-1′),111.5(d,C-2′),146.0(s,C-3′),149.3(s,C-4′),122.3(d,C-5′),116.1(d,C-6′),36.2(t,C-7′),42.4(t,C-8′),56.3(q,3′-OCH3),56.3(q,3-OCH3);以上数据与文献[14,15]报道一致,故鉴定为N-反式阿魏酰-3-甲氧基酪胺。
化合物8通过与对照品比较,在三种不同高效液相色谱条件下分析,与竹节参皂苷Ⅳa一致,故鉴定化合物8为竹节参皂苷Ⅳa。
化合物9通过与对照品比较,在三种不同高效液相色谱条件下分析,与竹节参皂苷Ⅰ一致,故鉴定化合物9为竹节参皂苷Ⅰ。
化合物10为无色针状结晶(甲醇),香草醛-浓硫酸反应显红色。1H NMR(600 MHz,CD3OD)δ:7.93(1H,s,H-2),7.38(1H,t,J= 8.4Hz,H-4′),7.22(1H,d,J= 8.4Hz,H-6′),7.05(1H,d,J= 8.4Hz,H-3′),6.99(1H,t,J= 8.4Hz,H-5′),6.72(1H,s,H-8),4.59(2H,s,H-11),3.85(3H,s,5-OCH3),3.78(3H,s,2′-OCH3),3.44(3H,s,11-OCH3),以上数据与文献[6]报道一致,故鉴定为5,2′-二甲氧基-6-甲氧甲基-7-羟基-异黄酮。
3.6 MTT法测定不同浓度单体化合物对RAW264.7细胞的毒性作用
选取地塞米松(dexamethasone,DXMS)为阳性对照药物,分析10个单体的细胞毒性和抗炎活性,由表5可见,各单体化合物均在12.5~50 μM浓度范围时对细胞无明显毒性;在浓度为100~200 μM时,细胞均有不同程度地死亡。各单体化合物均在低于50 μM的浓度范围内细胞存活率较高,且与正常对照组相比,无显著性差异(P>0.05)。故各单体化合物选取12.5、25、50 μM进行NO释放量检测。

表5 不同浓度单体化合物的细胞存活率
3.7 单体化合物对LPS诱导RAW264.7细胞释放NO的影响研究
由表6可见,与模型组相比,阳性对照药物地塞米松(DXMS)和各单体作用时,NO的释放量均有减少,且呈浓度依赖性降低,各浓度下均有显著的抑制作用(P<0.01)。在LPS+25 μM单体浓度下,化合物抗炎活性强弱依次为4>1>5>2>6>9>10>3>7>8,化合物4(N-反式阿魏酰酪胺)抗炎活性最强,但综合比较各单体抗炎活性和在提取物及原药材含量,β-蜕皮甾酮(1)为主要抗炎活性单体。

表6 土牛膝各单体化合物对LPS诱导RAW264.7细胞释放NO的影响
3.8 系统适用性试验结果与分析
分别吸取对照品溶液、供试样品溶液、样品溶液加对照品溶液各20 μL,按“色谱条件”注入液相色谱仪测定,结果表明采用本色谱条件,β-蜕皮甾酮与相邻峰分离度好,大于1.5,且在与对照品相同的保留时间内,空白无干扰。
3.8.1 线性关系考察结果
β-蜕皮甾酮进样量在28~560 ng范围内线性关系好,线性方程为y=840.35x-701 3.1,R2= 0.999 7。
3.8.2 精密度试验
精密吸取5 μL对照品溶液,连续重复进样6次,测定峰面积并计算RSD,结果显示β-蜕皮甾酮峰面积RSD为2.44%,表明仪器精密度好。
3.8.3 稳定性试验
取同一供试品溶液20 μL,分别于0、2、4、8、12、24 h注入液相色谱仪,测定待测成分峰面积并计算RSD;结果表明β-蜕皮甾酮峰面积的RSD为2.15%,表明供试品溶液室温放置24 h内稳定。
3.8.4 重现性试验
按样品制备方法,平行制备6份供试品溶液,按色谱条件进行测定,结果表明β-蜕皮甾酮平均含量为0.060 4%,RSD为1.99%,说明方法重现性好。
3.8.5 加样回收率试验
精密称取已测含量的柳叶牛膝粉末约0.1 g,置10 mL容量瓶中,精密加入用色谱纯甲醇配置的对照品溶液2.5 mL(即加入β-蜕皮甾酮70 μg),甲醇定容,按样品制备方法制备加样供试品溶液,测定并计算加样回收率。结果如下表7所示,平均回收率为104.05%,RSD为1.54%,说明该方法测定结果准确。
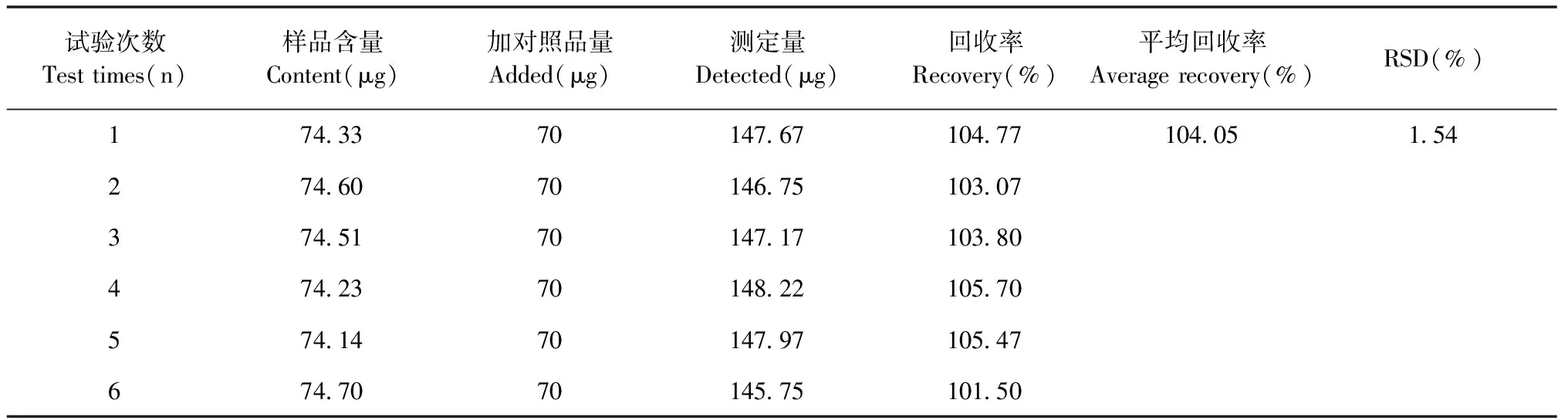
表7 加样回收率试验结果
3.9 土牛膝不同季节蜕皮甾酮含量测定结果
对不同土牛膝和不同月份β-蜕皮甾酮含量测定,结果如下表8所示。野生牛膝(采集于湖南中医药大学药用植物园)和柳叶牛膝(种植基地,两年生)地下根茎不同月份中含量差异较大,从4月到12月季节变化过程中,含量先逐渐增加,后又逐渐降低,其中8月含量最高,分别为0.914±0.016和1.412±0.038 mg/g。8月是湖南地区温度最高季节,说明温度高有利于次生代谢产物β-蜕皮甾酮的累积。粗毛牛膝(种植基地,两年生)β-蜕皮甾酮含量随季节变化影响不大。

表8 不同品种土牛膝不同季节蜕皮甾酮含量测定结果
4 结论与讨论
粗毛牛膝、野生牛膝和柳叶牛膝醇提取物均能剂量依赖性抑制NO量的释放,其中以粗毛牛膝醇提取物抗炎效果最佳;粗毛牛膝醇提物过反相层析组分,50%、70%及100%甲醇洗脱物表现为细胞毒性低,抗炎活性高;进一步经分离鉴定,从50%~70%甲醇洗脱物分离鉴定出9种单体化合物:β-蜕皮甾酮(1)、牛膝甾酮(2)、水龙骨甾酮 B(3)、N-反式阿魏酰酪胺(4)、N-顺式阿魏酰酪胺(5)、N-顺式阿魏酰-3-甲氧基酪胺(6)、N-反式阿魏酰-3-甲氧基酪胺(7)、竹节参皂苷Ⅳa(8)、5,2′-二甲氧基-6-甲氧甲基-7-羟基-异黄酮(10);竹节参皂苷Ⅰ(9)为100%甲醇洗脱物主要成分;体外抗炎结果表明,各单体在安全剂量范围内,均能剂量依赖性抑制NO量的释放,在LPS+25 μM单体浓度下,化合物抗炎活性强弱依次为4>1>5>2>6>9>10>3>7>8,比较抗炎活性与原药材含量,β-蜕皮甾酮(1)为主要抗炎活性单体;野生牛膝和柳叶牛膝(两年生)地下根茎β-蜕皮甾酮含量随季节有明显变化,体现在温度高季节含量高,温度低含量降低;而两年生粗毛牛膝随季节变化规律不明显。以上结果表明土牛膝具有显著的抗炎作用,抗炎成分包括甾酮类、三萜皂苷、生物碱类及异黄酮类,具有抗炎活性的阿魏酰酪胺生物碱为首次从土牛膝中分离鉴定。
ODS-AQ是日本YMC公司研发的一种独特高品质亲水性球形C18色谱填料,可用100%水系为流动相。本实验中采用ODS-AQ柱对粗毛牛膝醇提取物进行分离,首先采用纯水洗脱,将糖类或糖苷类洗脱下来,本实验水洗物特别多,干燥后占总提取物约85%,活性测定显示水洗物基本无抗炎活性,因此使用ODS-AQ柱对粗毛牛膝醇提取进行活性分离是成功的。水洗后,反相ODS-AQ柱继续用甲醇-水梯度洗脱,甲醇比例逐渐增加,洗脱成分极性也逐渐降低,活性测定显示,抗炎活性也逐渐升高,这充分说明土牛膝中起到关键抗炎作用的是极性较低化合物,这与文献[16]记载“土牛膝根吹末或温酒治疗,效果更佳”是一致的。项目前期已经从土牛膝中分离得到了几个吲哚类生物碱,此次又首次分离鉴定了阿魏酰酪胺生物碱类,进一步丰富了土牛膝的化学资源库,也提示进一步对土牛膝极性较低组分展开化学成分研究,将得到更多活性好和有趣的化合物。
β-蜕皮甾酮是土牛膝起抗炎的主要活性成分,含量测定结果表明野生牛膝和柳叶牛膝(两年生)地下根据含量随季节有明显变化,体现在温度高季节含量高,温度低含量降低,而两年生粗毛牛膝随季节变化规律不明显,这可能与粗毛牛膝地下根茎粗硬,对β-蜕皮甾酮的累积影响小。在β-蜕皮甾酮含量测定,中国药典采用水饱和正丁醇超声提取或甲醇提取,提取液蒸干后再甲醇溶解定容,我们在操作中发现,提取液蒸干后,样品变得很黏,甲醇溶解转移后损失大。另外在甲醇超声提取时,超声仪的功率和超声时间对提取影响大,超声提取功率为40 kHz(100 W)和超声30 min能将β-蜕皮甾酮充分提取出来。β-蜕皮甾酮结构中含有不饱和羰基结构,250 nm为最大吸收波长,摩尔吸收系数大,因此0.1 g药材置于10 mL容量瓶超声提取,提取液用滤膜过滤测定,即使药材中蜕皮甾酮含量低至万分之一也在线性范围内。
