蛹虫草菌生物合成虫草素的研究进展
2020-07-29赵星月李倩刘文静关海晴李成王际辉王亮
赵星月,李倩,刘文静,关海晴,李成,王际辉,3,王亮
·综 述·
蛹虫草菌生物合成虫草素的研究进展
赵星月1,李倩2,刘文静1,关海晴1,李成1,王际辉1,3,王亮1
1 大连工业大学 生物工程学院,辽宁 大连 116034 2 大连大学 生命科学与技术学院,辽宁 大连 116622 3 东莞理工学院 化学工程与能源技术学院,广东 东莞 523808
蛹虫草是我国传统的药用真菌,虫草素是蛹虫草的主要活性成分,具有抗癌、抗肿瘤、抗病毒等多种生理功能。蛹虫草菌液体发酵是最有希望实现高效生产虫草素的途径,但现阶段生产强度低,亟需应用发酵工程及代谢工程手段提高虫草素产量。文中对液体发酵体系中培养基组分 (碳/氮源、前体物质、金属离子等) 和培养条件 (pH、溶氧量、光照等) 对虫草素产量的影响进行了总结,并对虫草素的分离纯化、生物合成基因簇及合成代谢途径进行了阐述,最后探讨了实现虫草素高效生产的关键环节。
虫草素,蛹虫草菌,液体发酵,生物合成途径,高效生产
1950年Cunningham等首次从药用蕈菌蛹虫草菌的发酵液中分离得到虫草素[1]。是一种昆虫病原真菌,寄生于鳞翅昆虫的幼虫和蛹中。虫草素,即3′-脱氧腺苷,分子式为C10H13N5O3,是一种核苷类似物,由一个嘌呤分子 (腺嘌呤)和一个核糖分子 (呋喃核糖) 组成,且两者通过β-N9-糖苷键连接。虫草素结构类似腺苷 (图1),但缺乏3′-OH,正是由于这点不同,才赋予虫草素多种生理功能。
虫草素作为蛹虫草的主要活性物质,具有调节机体免疫功能、提高机体综合抗病能力、抗菌消炎等功效[2],自发现之后备受医学界关注。虫草素分子存在一个游离的-OH,作为核苷类似物嵌入到肿瘤细胞的DNA和RNA中可以阻止其合成、影响信号转导过程等,从而抑制肿瘤细胞核酸的合成[3-5]。研究发现,虫草素能够有效抑制白血病[6]、结肠癌、肝癌[2]、肾癌、肺癌[7]、胃癌[7]、乳腺癌[8]、宫颈癌[9]、膀胱癌、前列腺癌等癌细胞的增殖[10],此外,虫草素还对大肠杆菌、链球菌、类腐败梭菌、产气荚膜梭菌等病原菌[11-13]以及白色念珠菌、克鲁氏假丝酵母等致病性真菌有明显的抑制作用[14]。下面就虫草素来源、发酵生产、分离纯化及生物合成途径相关研究进行综述。

图1 蛹虫草子实体 (A)、腺苷 (B) 和虫草素 (C) 的化学结构式
1 微生物发酵生产虫草素
虫草素可以通过化学合成法和生物法获得。化学合成法原料成本高、合成工艺繁琐、产物收率低且副产物多,限制了其工业应用[15]。生物法生产虫草素主要有两种途径:一是直接从天然或人工培育的蛹虫草子实体中提取,二是经过液体发酵,从蛹虫草菌丝体和发酵液中提取。第一种途径主要问题是蛹虫草子实体的培养周期长 (约60 d)、培养条件复杂、不易控制,且虫草素产量较低,不能满足工业原料需求。第2种途径液体发酵生产周期短 (约15 d),发酵过程易于控制,产物生成目的性强。液体发酵技术已经应用于虫草素生产,且逐渐发展为主要生产手段,并且在菌种改良、过程工程优化等方面也积累了大量工作。
1.1 虫草素生产菌
能够合成虫草素的微生物包括蛹虫草菌[1,16]、构巢曲霉[17]、九州虫草菌[18]等丝状真菌。其中,自然条件下蛹虫草菌的虫草素含量较高,常用于发酵生产虫草素的研究。国内外开展了大量诱变育种工作以获得高产虫草素的蛹虫草菌株:Das等利用高能质子束诱变技术筛选获得 8-氮鸟嘌呤抗性突变株,弱化了虫草素积累产生的反馈抑制,液体浅层培养21 d虫草素产量达到3.1 g/L,较出发菌株产量提高约72%[19];Kang等通过孢子杂交手段获得高产虫草素的蛹虫草菌KSP8,虫草素含量提高约116.67%,达到6.63 mg/g[20];王亮等通过超声波和硫酸二乙酯复合诱变处理获得黄嘌呤鸟嘌呤双重营养缺陷型突变体,通过阻断黄嘌呤和鸟嘌呤的合成代谢,使代谢通量更多地流向前体物质腺嘌呤或腺苷,虫草素产量提高40%,虫草素产量达到1.76 g/L[21]。
1.2 优化培养基成分提高虫草素发酵产量
微生物培养过程中,碳源、氮源、前体物质、金属离子等培养基组分的种类及含量变化对菌体生长和产物合成会产生不同程度的影响 (表1)。
1.2.1 碳、氮源
碳、氮是细胞的基本组成元素,碳源、氮源以及C/N比的选择都会对细胞生长和代谢产生较大影响。大量碳源优化实验表明,葡萄糖是蛹虫草菌发酵生产虫草素的最优碳源[22]:Mao等考察了乳糖、蔗糖、果糖、葡萄糖、半乳糖、麦芽糖和木糖等多种碳源对蛹虫草菌液体发酵体系虫草素产量的影响,发现葡萄糖为最适碳源,当以42.0 g/L葡萄糖进行液体发酵,虫草素产量最高,第18天达到 (345.4±8.5) mg/L[24];Wongsa等比较了葡萄糖、蔗糖和木糖3种碳源,也发现以葡萄糖为碳源时虫草素产量最高,达到 (249.74±12.71) mg/L,较木糖和蔗糖组分别提高6.09%和17.41%,但单位细胞的虫草素得率YP/X却是木糖组最高 (0.094 g/g DCW),为葡萄糖和蔗糖组的1.92倍和2.41倍[40],这可能是由于菌体生长差异导致的 (生物量:葡萄糖≈蔗糖>木糖)。
葡萄糖是许多微生物生长的常见碳源和能源,多数研究都集中在将葡萄糖转化为虫草素,但葡萄糖的快速代谢会导致多种次级代谢产物的生物合成速率降低,并抑制其他碳源的利用。Tang等以葡萄糖为基础碳源同时补加棉籽油、花生油等植物油作为第二碳源,由于培养基中植物油的溶解度低,可避免碳分解代谢物的阻遏作用,同时改变呼吸熵,强化了碳通量流向虫草素的生物合成,在40 g/L葡萄糖基础上添加20 g/L花生油作为初始碳源,液体发酵20 d虫草素产量可提高约217%,达到5.29 g/L[23]。
在氮源方面,铵盐能够显著提高虫草素产量,Mao等在蛹虫草菌液体深层培养过程进行铵盐流加补料,虫草素产量达 (420.5±15.1) mg/L,较分批培养提高70%[41]。Leung等报道在培养第3天流加补料10 mmol/L NH4Cl,显著刺激了虫草素的生物合成,菌丝体虫草素产量增加312.3% (由28.5 μg/g增加到117.5 μg/g)[28]。Shih等发现C/N比为1︰1.5时有利于腺苷和虫草素的积累,但C/N比过低 (1︰3) 会导致其产量减少[27]。有机氮源对蛹虫草菌代谢的贡献则主要是促进细胞生长[30-31],陈磊等发现使用牛肉膏、蛋白胨等有机氮源时,菌丝浓密,而使用无机氮源(NH4)2SO4和NH4Cl时,菌丝稀疏[31]。Raethong等构建了蛹虫草菌的基因组尺度代谢网络模型,基于此设计合成培养基组分以实现菌体快速生长和虫草素的大量积累,当C/N比控制为8︰1时,培养液中虫草素产量达到 (377.6±5.5) mg/L,较未优化培养基提高246.42%[32]。
1.2.2 前体物质
前体物质能直接被微生物在生物合成过程中结合到产物分子中,添加合适的前体物质一般可以显著提高产物的产量。腺苷和腺嘌呤等嘌呤代谢的中间代谢物与虫草素结构类似,被认为可能是参与虫草素生物合成的前体物质。Das等添加6 g/L腺苷作为前体物质进行高产突变株液体发酵,虫草素产量高达8.57 g/L,较对照组提高28.10%[19,29]。Sari等向培养基中添加6.75 g/L腺嘌呤,虫草素产量提高了360%,达到6.24 g/L[34]。组合添加腺嘌呤和甘氨酸也能显著提高虫草素产量:Masuda等实验发现1 g/L腺嘌呤和16 g/L甘氨酸为最优前体添加组合,虫草素产量提高310%,达2.5 g/L[33];康超等提出黑暗振荡条件下 (光照影响见下文) 添加前体物质 (1 g/L腺嘌呤和16 g/L甘氨酸) 是提高虫草素产量的最优方案,其虫草素发酵产量可提高39%,达到1.02 g/L[35]。

表1 培养基成分对虫草素产量的影响
1.2.3 金属离子
金属离子与细胞的生长和代谢有着密切的关系,过量或缺乏都会对细胞功能造成影响。Hung等利用海水开展蛹虫草菌发酵实验,发现一定浓度下Mg2+、Na+、Ca2+和Fe2+有利于虫草素积累[38]。Fan等发现液体发酵体系Fe2+促进虫草素的积累,初始添加1 g/L FeSO4·7H2O,虫草素产量达 596.59 mg/L,较未添加组提高约70%[37]。
左言美等发现外源添加高浓度Zn2+引起细胞内锌积累,引发的氧化胁迫抑制菌体生长,35 g/L锌质量浓度为蛹虫草菌菌体生长极限浓度,虫草素的含量也随锌质量浓度的增加而显著降低[39]。然而,笔者所在研究组发现,在蛹虫草菌液体深层培养体系 (合成培养基) 中添加10 mmol/L Zn2+,25 ℃培养15 d后培养液中虫草素浓度达到(1 553.21±105.77) mg/L,是无锌对照体系 ((225.66±20.53) mg/L) 的6.88倍 (数据待发表),初步推测锌离子参与全局转录调控影响虫草素生物合成。
1.2.4 其他因素
维生素与氨基酸等也证明与虫草素积累相关。在基础培养基中补充10 mg/L生长因子 (VB1、VB6、VB7、VB11、α-萘乙酸 (NAA)、3-吲哚乙酸或2,4-二氯苯氧乙酸),发现添加VB1、VB11和NAA有利于虫草素积累,添加10 mg/L VB1虫草素产量最高,液体培养35 d可达(1 159.34±109.01) mg/L,较对照组提高约95.8%[25]。Raethong等通过代谢组学分析比较了不同碳源条件下蛹虫草菌的基因表达,发现甲硫氨酸代谢与虫草素合成存在关联[42]。Oh等利用GC-MS分析蛹虫草子实体中的代谢物,认为虫草素生物合成与谷氨酰胺及谷氨酸代谢相关[43]。
综上所述,培养基成分对于任何发酵产物的产量都非常重要,特别是碳、氮源,这些组分与细胞生长和代谢产物的生物合成直接相关。虫草素作为次级代谢产物,其生物合成主要由嘌呤代谢中间产物转化形成,表明虫草素合成代谢与细胞生长 (初级代谢) 存在一定关联,因此,在选择碳、氮源时需要同时考虑产物合成和细胞生长。多数研究表明,当使用单一碳源进行虫草素发酵时,葡萄糖为虫草素发酵的最佳碳源[22]。虽然在以木糖为碳源时,单位细胞的虫草素得率YP/X高于葡萄糖,但葡萄糖较木糖更有利于蛹虫草菌的生长[40]。在氮源选择方面,有机氮源含多种氨基酸及生长因子,能够显著促进菌体生长,但不利于虫草素合成;而无机氮源铵盐虽不利于菌体生长,但能促进虫草素大量积累[28,41]。由此可见,蛹虫草菌在菌体生长和产物合成阶段对碳、氮源的偏好不同,因此可应用两步法发酵或混合碳源发酵策略提高虫草素产量,即先利用葡萄糖、蛋白胨 (或酵母浸粉等) 作为碳、氮源,提供菌体生长所需营养物质,后期切换为木糖 (或植物油等)、铵盐作为碳、氮源,促进虫草素合成;或利用葡萄糖作为基础碳源,同时补木糖、植物油等其他碳源进行混合碳源发酵。除碳、氮源外,在发酵培养基中添加一定量前体物质 (如1 g/L腺嘌呤和16 g/L甘氨酸)、补充适量金属元素 (如3.6 mmol/L Fe2+、10 mmol/L Zn2+) 和维生素 (如 10 mg/L VB1) 可进一步提高虫草素产量。
1.3 优化培养条件提高虫草素发酵产量
除了培养基成分优化外,培养条件优化也是一种常用的提高虫草素产量的过程工程策略,如pH、溶氧量以及光照条件等 (表2)。

表2 培养条件对虫草素产量影响
1.3.1 溶氧量
溶氧量 (DO) 作为发酵的重要指标,对虫草素的产量存在显著影响。Mao等在蛹虫草菌液体培养体系提出了两阶段溶氧控制策略:前4天DO控制在50%–60%,之后DO控制在30%左右,第13天虫草素产量最高达到194.5 mg/L,较无DO控制体系提高10%;进一步在5-L涡轮搅拌生物反应器中应用该策略,虫草素产量提高了约15%[44]。
Shih等考察摇瓶培养、静置培养和振荡-静置两阶段培养3种不同溶氧条件的培养方式,发现两阶段发酵体系虫草素产量和生产强度分别为 1 103.0 mg/L和34.4 mg/(L·d),较静置 (220.3 mg/L,9.2 mg/(L·d)) 和摇瓶培养体系 (135.0 mg/L,11.2 mg/(L·d)) 虫草素产量和生产强度显著提 高[27]。此外,Suparmin等通过转录组学分析深层液体发酵和浅层液体发酵体系的基因表达,发现浅层液体发酵体系的氧缺乏有利于虫草素积累[51]。
1.3.2 pH
培养体系pH变化是细胞酸性及碱性物质代谢的综合体现。在蛹虫草菌液体发酵体系,pH随着发酵的进行逐渐下降,甚至可以降到2.0以下。目前,蛹虫草菌发酵研究主要考察的是初始pH的影响。多数研究认为控制酸性初始pH条件有利于虫草素积累。Xie等发现培养温度28 ℃、初始pH 6.2为最优发酵条件,生物量和虫草素产量分别达到19.1 g/L和1.8 mg/g[45]。万涛等考察了初始pH 2.0–10.0范围内菌体生长和虫草素积累的变化,发现随着培养基初始pH逐渐升高,生物量和虫草素产量均呈现先上升后下降的趋势,蛹虫草菌生长的最适初始pH在6.0左右,而虫草素产量在pH 5.0时最高,达到264.0 mg/L[46]。Shih等也同样发现菌体生长的最适初始pH在6.0左右,在pH 4.0–7.0初始pH范围内随着初始pH逐渐升高,虫草素产量逐渐降低,当培养基初始pH为4.0,第25天发酵液中虫草素产量最高 (315.2 mg/L),是pH 7.0条件下的2.28倍[27]。
1.3.3 光照
光照影响蛹虫草子实体生长及次级代谢产物的积累。Dong等发现光源波长对菌丝生长、腺苷及虫草素的生成有显著影响。与蓝光、白光和黑暗条件等相比,620–630 nm的红光最适合菌丝生长和腺苷积累,但不适合虫草素积累;而440–450 nm的蓝光最适合虫草素积累[48],推测与蓝光受体蛋白CmWC-1功能相关,此蛋白参与调控蛹虫草子实体发育和次级代谢产物形成[50]。蛹虫草菌液体培养经LED蓝灯 (440–450 nm) 照射 (16 h/d),显著促进了虫草素的积累,第14天虫草素产量达3.48 g/L,较对照组提高约58%[49]。
综上所述,在蛹虫草菌液体发酵体系,通过调控溶氧、pH、光照等培养条件能够显著提高虫草素产量。与碳、氮源利用相似,细胞生长和产物积累的最适溶氧、pH、光照条件不一致。基于此,应用两步法液体发酵策略有利于提高虫草素产量,即发酵前期,选择葡萄糖、蛋白胨 (或酵母浸粉) 作为碳、氮源,控制高DO (50%–60%)、弱酸性pH (pH 6.0)、红光光照 (620–630 nm),促进菌体生长;发酵后期,选择木糖 (或植物油)、铵盐作为碳、氮源,控制低DO (0–30%)、酸性pH (pH 4.0)、蓝光光照 (440–450 nm),强化虫草素积累。
2 虫草素的分离纯化
虫草素来源不同,提取方法也有一定的差别。目前生物法获取虫草素可通过蛹虫草子实体培养和液体深层发酵两种形式。对于子实体培养而言,子实体和固体培养基残基均需用于虫草素分离;对于液体发酵系统,研究表明超过50%的虫草素存在于发酵液中[24,40,52]。因此,对发酵液中的虫草素进行分离纯化就可回收大部分目的产物。
用于虫草素分离的方法有浸提法、热回流法、超声波提取法[53-54]、微波提取法[55]、超临界流体萃取法[56]、树脂吸附法、制备色谱法[57]等,其中浸提法、热回流法、超声波/微波提取等溶剂萃取法主要应用于子实体和固体培养基残基中虫草素的分离。
在液体发酵体系,Masuda等采用结晶法从蛹虫草菌突变株G81-3培养液中分离纯化虫草素。发酵液首先经过冻干,在室温条件下制备虫草素的浓缩液 (pH 2.7,虫草素含量约40 g/L),通过降低温度或调节pH,均能得到虫草素晶体,回收率为79.8%,纯度为99.4%[58]。此方法具有简单易行、不依赖于复杂设备、成本低等优点,但需要制备较高浓度的虫草素浓缩液。
大孔吸附树脂吸附方法也可用于虫草素分离,具有工艺简单、绿色环保、高效安全的特点,可满足工业生产的需求。李从镇等从多种大孔树脂中筛选出最合适虫草素分离的NAK-II大孔树脂,其吸附量可达到16.5 mg/g,解析率可达95%[59]。Ni等设计了一种循环式大孔树脂柱层析萃取法,使用3种不同层析柱组成的循环柱层析萃取系统,萃取废弃培养基中的虫草素回收率可达97.24%[60]。Zhang等采用NKA-Ⅱ大孔树脂吸附法分离子实体中虫草素、N6-(2-羟乙基)-腺苷(HEA) 和腺苷,通过大孔树脂吸附制备的粗品含有3.4%的虫草素、3.7%的HEA和4.9%的腺苷,通过循环高速逆流色谱进一步纯化粗品,在一步分离中从500 mg粗制样品中获得3种核苷,包括15.6 mg虫草素、16.9 mg HEA和23.2 mg腺苷,其纯度分别为98.5%、98.3%和98.0%[61]。
利用大孔树脂实现发酵-分离耦合则为虫草素高效生产提供了新思路。基于高浓度虫草素对其生物合成过程产生强烈反馈抑制,关海晴等提出应用发酵分离耦合技术移除部分虫草素、弱化反馈抑制,在30 g/L葡萄糖的分批发酵体系中,经过两次NKA-Ⅱ大孔树脂吸附,发酵21 d后虫草素产量达到644.50 mg/L,较对照组提高32.07%[62]。
具有高选择性的分子印迹技术也成功应用于虫草素分离。Zhang等以甲基丙烯酸和丙烯酰胺作为分子印迹聚合物 (Molecularly imprinted polymers,MIPS) 的功能单体,以改性硅胶为内核,以虫草素为模板,以乙二醇二甲基丙烯酸酯为交联剂,以偶氮二异丁腈为引发剂,制成MIPS。经测试该MIPS最大虫草素吸附量为95.37 mg/g,使用MIPS从蛹虫草发酵液中分离虫草素,虫草素回收率为25.67%,纯度为98%[63]。分子印迹分离技术可以特异性吸附虫草素,而不受其他杂质的干扰,有助于区分腺苷、2′-脱氧腺苷等结构类似物,但此方法需要大量有机溶剂,且合成MIPS过程复杂,应用于大规模生产尚有一定困难。
3 虫草素生物合成途径
3.1 虫草素生物合成基因簇
自1950年虫草素发现以来[1],由于缺乏基因组相关信息,其生物合成途径迟迟未被解析,直到2011年才由中国科学院植物生理生态研究所Zheng等完成蛹虫草菌的全基因组测序[64]。
此前,Kaczka等发现在构巢曲霉中也能产生虫草素[17],Xia等推断蛹虫草菌和构巢曲霉中必定共同存在负责虫草素合成的关键基因[16]。Xia等通过比较蛹虫草菌和构巢曲霉基因组,发现了几个高度同源的蛋白编码基因,且紧密排列形成一个基因簇,蛹虫草菌中分别是1、2、3和4,对应构巢曲霉中的同源基因分别是1、2、3和4。蛋白质功能分析显示1编码氧化还原酶,2编码金属离子依赖的磷酸水解酶,3编码ATP依赖的磷酸转移酶,4编码一个ABC型的转运蛋白[16]。2019年Zhao等通过转录组和蛋白质组学分析九州虫草 (Kob) 也发现了高度同源的虫草素生物合成基因簇1-4[18]。
Xia等通过组合敲除基因1-4,并在酿酒酵母及罗伯茨绿僵菌中异源表达了1–4,结果表明1和2是虫草素生物合成的关键基因,3基因参与喷司他汀的生物合成,4可能编码喷司他汀的转运蛋白[16]。1和2编码蛋白在胞内形成蛋白复合体且定位于脂滴。虫草素在胞内可被腺苷脱氨酶 (Adenosine deaminase,ADA) 催化脱毒去除氨基生成无细胞毒性的3′-脱氧肌苷,喷司他汀可通过抑制ADA的活性调控虫草素合成。因此,喷司他汀被认为是平衡细胞毒性和虫草素积累水平的关键因素[16]。蛹虫草菌虫草素合成基因簇的揭示为阐述虫草素合成机理、对关键靶点进行代谢工程改造和利用合成生物学方法高效生产虫草素奠定了坚实基础。虽然4不负责蛹虫草中虫草素的分泌运输,但研究表明液体发酵体系中大部分虫草素均存在于发酵液中[24,40,52],表明蛹虫草菌可能存在未知的特异性虫草素转运蛋白。
3.2 虫草素生物合成途径
虫草素生物合成途径的揭示经历了曲折的过程。自虫草素被发现后,Kredich等利用碳同位素示踪法对虫草素的生物合成进行了探究,起初认为虫草素是由细胞预先合成的虫草糖 (3′-脱氧核糖) 和腺嘌呤通过糖苷键聚合而成[65]。然而,多位科学家通过同位素示踪实验提出一种截然不同的观点,认为虫草素的合成是以腺苷或其他衍生物为前体,在合成过程中糖苷键不发生断裂[66-68],且添加腺嘌呤或腺苷等前体物质能显著提高虫草素产量[19,29,33]。由于细胞内普遍存在腺苷及其衍生物,通过同位素标记难以精确定位中间代谢物,示踪虫草素的生物合成途径难度较大。
随着组学技术的发展,Li等基于转录组学分析预测了虫草素的生物合成途径 (图2棕色标记路径),认为虫草素是以腺苷为前体,首先在腺苷激酶(ADK) 作用下通过磷酸化生成腺苷单磷酸 (AMP),进而在腺苷酸激酶 (ADEK) 的作用下生成了腺苷二磷酸 (ADP),并且在高度保守的核苷酸还原酶 (RNRs) 亚基作用下生成3′-dADP和2′-dADP,3′-dADP在腺苷酸激酶 (ADEK) 的作用下生成3′-dAMP,最终通过5′-核苷酸酶 (NT5E) 生成3′-脱氧腺苷 (虫草素,COR)[69]。而2′-dADP经过类似的反应最终生成了2′-脱氧腺苷参与核酸代谢[70-71]。
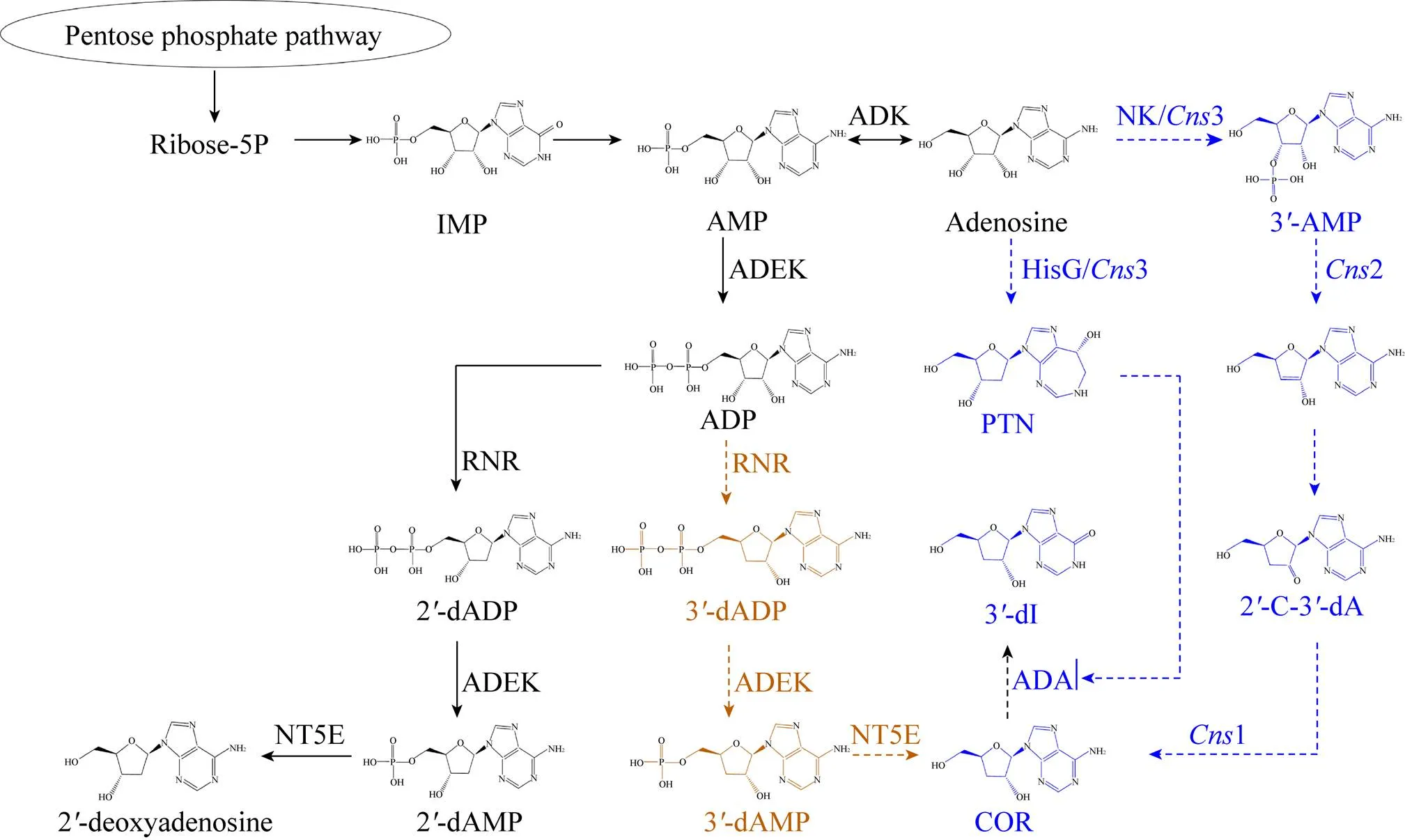
图2 虫草素合成途径预测[16,70]
然而,Kato等通过在大肠杆菌中异源表达蛹虫草菌来源的核苷酸还原酶 (RNRs) 的大小亚基CmR1和CmR2,发现其仅催化由ADP生成2′-dADP的反应,不参与催化ADP生成3′-dADP的反应,表明在蛹虫草菌中RNR不参与虫草素生物合成[72],说明虫草素合成依赖其他代谢途径。
随着蛹虫草菌基因组全测序工作的完成,Xia等基于比较基因组分析,进一步提出了新的虫草素生物合成路径 (图2蓝色标记路径),认为腺苷首先经过特异的ATP依赖的磷酸转移酶 (3编码) 将3′-OH磷酸化生成3′-AMP,进而3′-AMP在金属离子依赖的磷酸水解酶 (2编码) 作用下去磷酸化形成不稳定的烯醇化合物,通过自发异构形成2-羰基-3-脱氧腺苷,最终在氧化还原酶 (1编码) 作用下生产虫草素。Xia等提出虫草素代谢与喷司他汀(PTN) 的合成相关联,PTN通过抑制腺苷脱氨酶 (ADA) 活性而避免虫草素脱氨,胞内PTN水平是调节虫草素合成的关键因素[16,73]。
4 结论和展望
蛹虫草作为中国传统的中药材,可开发其生物活性物质用于食品、药品及化妆品行业[3,74-76]。随着上世纪50年代其重要活性成分虫草素的发现,学术界开展了大量虫草素合成及其药用功能的研究,巨大的市场需求亟需开发虫草素高效生产技术。虽然蛹虫草人工培育技术成熟,但固体培养周期长、空间利用率低、操作复杂,因此目前液体发酵已发展成为虫草素的重要生产手段,国内外学者对此开展了大量培养基和工艺条件优化研究,建立了一系列提高虫草素产量的过程工程策略,如前体添加、铵盐补料、光照调节等。
由于虫草素是次级代谢产物,可以考虑采用分阶段控制发酵过程,即前一阶段实现生物量的积累,后一阶段主要实现虫草素的积累,两段的培养基组成、光照条件、pH、DO等可以各不相同。
同时,虫草素高效生产仅仅靠发酵工艺优化也是不够的,还需要在上游菌株改造及下游产品分离纯化方面开展研究。虽然有许多关于虫草素提取分离的报道,但多数研究是以蛹虫草子实体为对象,缺少在液体发酵体系建立的高效分离工艺。对于具有细胞毒性的虫草素发酵,开发原位发酵-分离耦合工艺可及时解除产物抑制、降低细胞毒性、提高细胞存活率,最终提高虫草素产量[62-63]。
由于缺乏蛹虫草菌的遗传信息,早期高产菌株的选育主要是通过物理或化学诱变得到,但随着蛹虫草菌基因组序列解析[64],以及转录组、蛋白质组学等多种组学研究的开展[42,51,77-79],虫草素生物合成途径逐渐清晰,确定了负责虫草素合成的关键基因1和2,研究认为1和2蛋白产物形成复合体参与虫草素合成[16],但具体催化机制有待进一步解析。
菌种的分子改造往往受限于没有合适的遗传操作系统,包括合适的载体系统、DNA胞内递送方法等。近年来蛹虫草菌的分子改造技术也逐渐成熟,建立了农杆菌介导及原生质体遗传转化体 系[80-81]、基于Split‑Marker重组技术开发的基因敲除系统等[82]。此外,Chen等首次在蛹虫草菌中成功开展了CRISPR-Cas9基因编辑工作[83],为蛹虫草菌的基因工程改造提供了更为高效快捷的技术手段。借助组学分析差异表型,甄选影响虫草素生物合成的关键基因,借助现代分子生物学技术进行改造,将大幅度提高蛹虫草菌虫草素生产能力。
近年来合成生物学研究发展迅速,在原核或真核底盘细胞中构建外源生物合成途径,已经成功实现了多种次级代谢物的高效生产[84-86],笔者所在研究组也将虫草素合成关键基因成功在酿酒酵母和毕赤酵母中表达并合成了虫草素。将合成生物学技术应用于虫草素的高效生产,需要优化底盘生物代谢通量、缓解产物的细胞毒性、提高产物胞外转运效率等,再结合过程工程策略、优化菌种-发酵-分离的各个环节,将真正实现虫草素的高效大规模工业生产。
[1] Cunningham KG, Manson W, Spring FS, et al. Cordycepin, a metabolic product isolated from cultures of(Linn.) Link. Nature, 1950, 166(4231): 949.
[2] Bi YE, Zhou YL, Wang MQ, et al. Targeted delivery of cordycepin to liver cancer cells using transferrin-conjugated liposomes. Anticancer Res, 2017, 37(9): 5207–5214.
[3] Tuli HS, Sharma AK, Sandhu SS, et al. Cordycepin: a bioactive metabolite with therapeutic potential. Life Sci, 2013, 93(23): 863–869.
[4] Holbein S, Wengi A, Decourty L, et al. Cordycepin interferes with 3′ end formation in yeast independently of its potential to terminate RNA chain elongation. RNA, 2009, 15(5): 837–849.
[5] Yoon SY, Park SJ, Park YJ. The anticancer properties of cordycepin and their underlying mechanisms. Int J Mol Sci, 2018, 19(10): 3027.
[6] Chou SM, Lai WJ, Hong TW, et al. Synergistic property of cordycepin in cultivated-mediated apoptosis in human leukemia cells. Phytomedicine, 2014, 21(12): 1516–1524.
[7] Zhou YH, Zhan Z, Tang YP, et al. Mechanisms of proliferative inhibition by maimendong & Qianjinweijing decoction in A549 cells. Chin J Lung Cancer, 2010, 13(5): 477–482 (in Chinese). 周宇辉, 詹瑧, 唐于平, 等. 麦门冬合千金苇茎汤抑制A549细胞增殖作用及其机制. 中国肺癌杂志, 2010, 13(5): 477–482.
[8] Choi S, Lim MH, Kim KM, et al. Cordycepin-induced apoptosis and autophagy in breast cancer cells are independent of the estrogen receptor. Toxicol Appl Pharm, 2011, 257(2): 165–173.
[9] Seong DB, Hong S, Muthusami S, et al. Cordycepin increases radiosensitivity in cervical cancer cells by overriding or prolonging radiation-induced G2/M arrest. Eur J Pharmacol, 2016, 771: 77–83.
[10] Khan A, Tania M. Cordycepin in anticancer research: molecular mechanism of therapeutic effects. Curr Med Chem, 2019, 27(6): 983–996, doi: 10.2174/0929867325666181001105749.
[11] Jiang Q, Lou ZX, Wang HX, et al. Antimicrobial effect and proposed action mechanism of cordycepin againstand. J Microbiol, 2019, 57(4): 288–297.
[12] Huang M, Zhang S. Research advances of physiological efficacies of cordycepin. J Fungal Res, 2010, 8(4): 234–238, 244 (in Chinese). 黄冕, 张松. 虫草素生理功效的研究进展. 菌物研究, 2010, 8(4): 234–238, 244.
[13] Ahn YJ, Park SJ, Lee SG, et al. Cordycepin: selective growth inhibitor derived from liquid culture ofagainstspp. J Agric Food Chem, 2000, 48(7): 2744–2748.
[14] Sugar AM, McCaffrey RP. Antifungal activity of 3’-deoxyadenosine (cordycepin). Antimicrob Agents Chemother, 1998, 42(6): 1424–1427.
[15] Li QH, Yang RC, Ruan ZZ, et al. Total synthesis of cordycepin. Chinese J Org Chem, 2013, 33(6): 1340–1344 (in Chinese). 李启欢, 阳如春, 阮志忠, 等. 虫草素的全合成研究. 有机化学, 2013, 33(6): 1340–1344.
[16] Xia YL, Luo FF, Shang YF, et al. Fungal cordycepin biosynthesis is coupled with the production of the safeguard molecule pentostatin. Cell Chem Biol, 2017, 24(12): 1479–1489.e4.
[17] Kaczka EA, Dulaney EL, Gitterman CO, et al. Isolation and inhibitory effects on KB cell cultures of 3′-deoxyadenosine from(Eidam) Wint. Biochem Biophys Res Commun, 1964, 14(5): 452–455.
[18] Zhao X, Zhang GY, Li CY, et al. Cordycepin and pentostatin biosynthesis gene identified through transcriptome and proteomics analysis ofKob. Microbiol Res, 2019, 218: 12–21.
[19] Das SK, Masuda M, Hatashita M, et al. A new approach for improving cordycepin productivity in surface liquid culture ofusing high‐energy ion beam irradiation. Lett Appl Microbiol, 2008, 47(6): 534–538.
[20] Kang N, Lee HH, Park I, et al. Development of high cordycepin-producingstrains. Mycobiology, 2017, 45(1): 31–38.
[21] Wang L, Liu WJ, Cao ZP, et al. Screening of a double auxotrophicmutant and its high fermentation yield of cordycepin. Mod Food Sci Technol, 2017, 33(3): 54–59 (in Chinese). 王亮, 刘文静, 曹照平, 等. 双重营养缺陷型蛹虫草突变株的选育及其高产虫草素的研究. 现代食品科技, 2017, 33(3): 54–59.
[22] Zhang JG, Fang TT, Li QL, et al. Production of cordycepin byusing submerged liquid culture: optimization of the culture medium and repeated batch fermentation. J Food Agric Environ, 2013, 11(3): 534–538.
[23] Tang JP, Qian ZQ, Wu H. Enhancing cordycepin production in liquid static cultivation ofby adding vegetable oils as the secondary carbon source. Bioresour Technol, 2018, 268: 60–67.
[24] Mao XB, Eksriwong T, Chauvatcharin S, et al. Optimization of carbon source and carbon/nitrogen ratio for cordycepin production by submerged cultivation of medicinal mushroom. Process Biochem, 2005, 40(5): 1667–1672.
[25] Kang C, Wen TC, Kang JC, et al. Optimization of large-scale culture conditions for the production of cordycepin withby liquid static culture. ScientificWorldJournal, 2014, 2014: 510627.
[26] Tang JP, Liu YT, Zhu L. Optimization of fermentation conditions and purification of cordycepin from. Prep Biochem Biotechnol, 2014, 44(1): 90–106.
[27] Shih IL, Tsai KL, Hsieh C. Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture ofBiochem Eng J, 2007, 33(3): 193–201.
[28] Leung PH, Wu JY. Effects of ammonium feeding on the production of bioactive metabolites (cordycepin and exopolysaccharides) in mycelial culture of afungus. J Appl Microbiol, 2007, 103(5): 1942–1949.
[29] Das SK, Masuda M, Hatashita M, et al. Optimization of culture medium for cordycepin production usingmutant obtained by ion beam irradiation. Process Biochem, 2010, 45(1): 129–132.
[30] Gu YX, Wang ZS, Li SX, et al. Effect of multiple factors on accumulation of nucleosides and bases in. Food Chem, 2007, 102(4): 1304–1309.
[31] Chen L. Biological characteristics and fermentation research of[D]. Beijing: Peking Union Medical College, 2009. 陈磊. 蛹虫草()生物学特性及发酵研究[D]. 北京: 北京协和医学院, 2009.
[32] Raethong N, Wang H, Nielsen J, et al. Optimizing cultivation offor fast growth and cordycepin overproduction using rational design of synthetic media. Comput Struct Biotechnol J, 2020, 18: 1–8.
[33] Masuda M, Urabe E, Honda H, et al. Enhanced production of cordycepin by surface culture using the medicinal mushroom. Enzyme Microb Technol, 2007, 40(5): 1199–1205.
[34] Sari N, Suparmin A, Kato T, et al. Improved cordycepin production in a liquid surface culture ofisolated from wild strain. Biotechnol Bioproc Eng, 2016, 21(5): 595–600.
[35] Kang C, Wen TC, Kang JC, et al. Effects of additives and different culture conditions on cordycepin production by the medicinal fungus. Mycosystema, 2012, 31(3): 389–397 (in Chinese). 康超, 文庭池, 康冀川, 等. 不同培养条件和前体对蛹虫草液体发酵产虫草素的影响. 菌物学报, 2012, 31(3): 389–397.
[36] Li Z, Yu JP, Liang ZQ, et al. Effect of precursor and fungal elicitor on cordycepin production. Food Sci, 2008, 29(6): 273–275 (in Chinese). 李祝, 郁建平, 梁宗琦, 等. 前体物质与真菌激发子对虫草菌素产量的影响. 食品科学, 2008, 29(6): 273–275.
[37] Fan DD, Wang W, Zhong JJ. Enhancement of cordycepin production in submerged cultures ofby addition of ferrous sulfate. Biochem Eng J, 2012, 60: 30–35.
[38] Hung YP, Wang JJ, Wei BL, et al. Effect of the salts of deep ocean water on the production of cordycepin and adenosine of-fermented product. AMB Expr, 2015, 5(1): 53–62.
[39] Zuo YM, Cheng XH, Zhu M, et al. Effect of zinc accumulation on cordycepin and adenosine content in mycelia of. J Fungal Res, 2013, 11(2): 124–128 (in Chinese). 左言美, 程显好, 朱萌, 等. 锌富集对蛹虫草菌丝体内虫草素、腺苷含量的影响. 菌物研究, 2013, 11(2): 124–128.
[40] Wongsa B, Raethong N, Chumnanpuen P, et al. Alternative metabolic routes in channeling xylose to cordycepin production ofidentified by comparative transcriptome analysis. Genomics, 2020, 112(1): 629–636.
[41] Mao XB, Zhong JJ. Significant effect of NH4+on cordycepin production by submerged cultivation of medicinal mushroom. Enzyme Microb Technol, 2006, 38(3/4): 343–350.
[42] Raethong N, Laoteng K, Vongsangnak W. Uncovering global metabolic response to cordycepin production inthrough transcriptome and genome-scale network-driven analysis. Sci Rep, 2018, 8: 9250.
[43] Oh J, Yoon DH, Shrestha B, et al. Metabolomic profiling reveals enrichment of cordycepin in senescence process offruit bodies. J Microbiol, 2019, 57(1): 54–63.
[44] Mao XB, Zhong JJ. Hyperproduction of cordycepin by two-stage dissolved oxygen control in submerged cultivation of medicinal mushroomin bioreactors. Biotechnol Prog, 2004, 20(5): 1408–1413.
[45] Xie CY, Liu GX, Gu ZX, et al. Effects of culture conditions on mycelium biomass and intracellular cordycepin production ofin natural medium. Ann Microbiol, 2009, 59: 293.
[46] Wan T, Du LX. Effect of precursor and fungal elicitor on cordycepin production. Mod Food Sci Technol, 2007, 23(9): 29–31 (in Chinese). 万涛, 杜连祥. 培养条件对蛹虫草液体培养生产虫草素的影响. 现代食品科技, 2007, 23(9): 29–31.
[47] Zhong SM, Du M, Chen WB, et al. Liquid culture conditions for promoting cordycepin secreted frommycelia. Mycosystema, 2011, 30(2): 229–234 (in Chinese). 钟思敏, 杜梅, 陈往滨, 等. 蛹虫草菌丝产虫草素液体培养条件的研究. 菌物学报, 2011, 30(2): 229–234.
[48] Dong JZ, Liu MR, Lei C, et al. Effects of selenium and light wavelengths on liquid culture oflink. Appl Biochem Biotechnol, 2012, 166(8): 2030–2036.
[49] Lin LT, Lai YJ, Wu SC, et al. Optimal conditions for cordycepin production in surface liquid-culturedtreated with porcine liver extracts for suppression of oral cancer. J Food Drug Anal, 2018, 26(1): 135–144.
[50] Yang T, Guo MM, Yang HJ, et al. The blue-light receptor CmWC-1 mediates fruit body development and secondary metabolism in. Appl Microbiol Biotechnol, 2016, 100(2): 743–755.
[51] Suparmin A, Kato T, Dohra H, et al. Insight into cordycepin biosynthesis of: Comparison between a liquid surface culture and a submerged culture through transcriptomic analysis. PLoS ONE, 2017, 12(11): e0187052.
[52] Masuda M, Urabe E, Sakurai A, et al. Production of cordycepin by surface culture using the medicinal mushroom. Enzyme Microb Technol, 2006, 39(4): 641–646.
[53] Ling JY, Sun YJ, Lv P. Capillary zone electrophoresis determination of cordycepin inspp. extracted by using ultrasonic. Mycosystema, 2002, 21(3): 394–399 (in Chinese). 凌建亚, 孙迎节, 吕鹏. 虫草属真菌中虫草素的超声波提取及其毛细管电泳测定. 菌物系统, 2002, 21(3): 394–399.
[54] Wang HJ, Pan MC, Chang CK, et al. Optimization of ultrasonic-assisted extraction of cordycepin fromusing orthogonal experimental design. Molecules, 2014, 19(12): 20808–20820.
[55] Xia M, Wen L. Study on extraction of cordycepin with microwave. Food Sci, 2006, 27(10): 248–251 (in Chinese). 夏敏, 温鲁. 微波法提取虫草素研究. 食品科学, 2006, 27(10): 248–251.
[56] Ling JY, Zhang GY, Lin JQ, et al. Supercritical fluid extraction of cordycepin and adenosine fromand purification by high-speed counter-current chromatography. Sep Purif Technol, 2009, 66(3): 625–629.
[57] Xie HC, Liang Y, Lao DQ, et al. Preparative separation of high-purity cordycepin from(L.) link by high-speed countercurrent chromatography. J Liq Chromatogr Relat Technol, 2011, 34(7): 491–499.
[58] Masuda M, Hatashita M, Fujihara S, et al. Simple and efficient isolation of cordycepin from culture broth of amutant. J Biosci Bioeng, 2015, 120(6): 732–735.
[59] Li CZ, Mao N. Purification of cordycepin from medium residues by macroporous resin. Chin Biotechnol, 2014, 34(1): 90–94 (in Chinese). 李从镇, 毛宁. 大孔吸附树脂分离纯化培养基残基中虫草素. 中国生物工程杂志, 2014, 34(1): 90–94.
[60] Ni H, Zhou XH, Li HH, et al. Column chromatographic extraction and preparation of cordycepin fromwaster medium. J Chromatogr B, 2009, 877(22): 2135–2141.
[61] Zhang Z, Tudi T, Liu YF, et al. Preparative isolation of cordycepin, N6-(2-hydroxyethyl)-adenosine and adenosine fromby macroporous resin and purification by recycling high-speed counter- current chromatography. J Chromatogr B, 2016, 1033–1034: 218–225.
[62] Guan HQ, Li HY, Li Q, et al. Efficient production of cordycepin during submerged liquid fermentation bycoupled with macroporous resin adsorption. CIESC J, 2019, 70(7): 2675–2683 (in Chinese).关海晴, 李鸿宇, 李倩, 等. 蛹虫草菌深层液体发酵耦合大孔树脂吸附高效生产虫草素. 化工学报, 2019, 70(7): 2675–2683.
[63] Zhang YQ, Wan JF, Cao XJ. Synthesis of surface molecularly imprinting polymers for cordycepin and its application in separating cordycepin. Process Biochem, 2016, 51(4): 517–527.
[64] Zheng P, Xia YL, Xiao GH, et al. Genome sequence of the insect pathogenic fungus, a valued traditional Chinese medicine. Genome Biol, 2012, 12(11): R116.
[65] Kredich NM, Guarino AJ. Studies on the biosynthesis of cordycepin. Biochim Biophys Acta, 1961, 47(3): 529–534.
[66] Suhadolnik RJ, Cory JG. Further evidence for the biosynthesis of cordycepin and proof of the structure of 3-deoxyribose. Biochim Biophys Acta, 1964, 91: 661–662.
[67] Chassy BM, Suhadolnik RJ. Nucleoside antibiotics IV. Metabolic fate of adenosine and cordycepin byduring cordycepin biosynthesis. Biochim Biophys Acta, 1969, 182(2): 307–315.
[68] Lennon MB, Suhadolnik RJ. Biosynthesis of 3'-deoxyadenosine by: mechanism of reduction. Biochim Biophys Acta, 1976, 425(4): 532–536.
[69] Lin S, Zhou CB, Zhang HC, et al. Expression, purification and characterization of 5′-nucleotidase from caterpillar fungus by efficient genome-mining. Protein Expres Purif, 2020, 168: 105566.
[70] Shi LC, He L, Sun WJ, et al. Transcriptome analysis of thefruiting body reveals putative genes involved in fruiting body development and cordycepin biosynthesis. Genomics, 2014, 103(1): 154–159.
[71] Liu TF, Liu ZY, Yao XY, et al. Identification of cordycepin biosynthesis-related genes through de novo transcriptome assembly and analysis in. Roy Soc Open Sci, 2018, 5(12): 181247.
[72] Kato T, Ahmad S, Park EY. Functional analysis of ribonucleotide reductase fromexpressed in. Appl Biochem Biotechnol, 2017, 182(4): 1307–1317.
[73] Wellham PAD, Kim DH, Brock M, et al. Coupled biosynthesis of cordycepin and pentostatin in: implications for fungal biology and medicinal natural products. Ann Transl Med, 2019, 7(S3): S85.
[74] Paterson RRM.–a traditional Chinese medicine and another fungal therapeutic biofactory? Phytochemistry, 2008, 69(7): 1469–1495.
[75] Das SK, Masuda M, Sakurai A, et al. Medicinal uses of the mushroom: current state and prospects. Fitoterapia, 2010, 81(8): 961–968.
[76] Kunhorm P, Chaicharoenaudomrung N, Noisa P. Enrichment of cordycepin for cosmeceutical applications: culture systems and strategies. Appl Microbiol Biotechnol, 2019, 103(4): 1681–1691.
[77] Xiong CH, Xia YL, Zheng P, et al. Developmental stage-specific gene expression profiling for a medicinal fungus. Mycology, 2010, 1(1): 25–66.
[78] Yin J, Xin XD, Weng YJ, et al. Transcriptome-wide analysis reveals the progress ofsubculture degeneration. PLoS ONE, 2017, 12(10): e0186279.
[79] Wang F, Liu Q, Zhang JJ, et al. Comparative transcriptome analysis between a spontaneous albino mutant and its sibling strain ofin response to light stress. Front Microbiol, 2018, 9: 1237.
[80] Zheng ZL, Huang CH, Cao L, et al.-mediated transformation as a tool for insertional mutagenesis in medicinal fungus. Fungal Biol, 2011, 115(3): 265–274.
[81] Zhang M, Shan YL, Gao HT, et al. Expression of a recombinant hybrid antimicrobial peptide magainin II-cecropin B in the mycelium of the medicinal fungusand its validation in mice. Microb Cell Fact, 2018, 17: 18.
[82] Lou HW, Ye ZW, Yun F, et al. Targeted gene deletion inusing the split-marker approach. Mol Biotechnol, 2018, 60(5): 380–385.
[83] Chen BX, Wei T, Ye ZW, et al. Efficient CRISPR-Cas9 gene disruption system in edible-medicinal mushroom. Front Microbiol, 2018, 9: 1157.
[84] Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528–532.
[85] Galanie S, Thodey K, Trenchard IJ, et al. Complete biosynthesis of opioids in yeast. Science, 2015, 349(6252): 1095–1100.
[86] Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast. Cell Res, 2014, 24(6): 770–773.
Advances in biosynthesis of cordycepin from
Xingyue Zhao1, Qian Li2, Wenjing Liu1, Haiqing Guan1, Cheng Li1, Jihui Wang1,3, and Liang Wang1
1,,116034,,2,,116622,,3,,523808,,
Cordycepin as the main active ingredient of, a traditional medicinal fungus in China, has many physiological functions such as anti-cancer, anti-tumor and anti-virus activity. The most potential route for effective cordycepin production has been considered as liquid fermentation ofthough with low productivity at present. Thus, it is urgent to apply both process engineering strategy and metabolic engineering strategy to enhance the productivity of cordycepin. In this review, the effects of medium components (i.e. the carbon/nitrogen source, precursor substances and metal ions) and operation factors (i.e. pH, dissolved oxygen and light) on cordycepin biosynthesis in liquid fermentation system are summarized. Besides, separation of cordycepin, the gene cluster involved and predicted biosynthesis pathways of cordycepin are also discussed, providing possible solutions of finally realizing efficient production of cordycepin.
cordycepin,, liquid fermentation, biosynthesis pathway, efficient production
10.13345/j.cjb.190500
November 11, 2019;
March 3, 2020
Supported by:National Key Research and Development Program of China (No. 2018YFC1406800), Science and Technology Innovation Foundation of Dalian, China (No. 2019J12SN59), Natural Science Foundation of Liaoning, China (No. 2019-ZD-0575), Science Research Foundation of Educational Department of Liaoning Province, China (No. J2020102).
Liang Wang. Tel: +86-411-86324050; Fax: +86-411-86323646; E-mail: wangliang@dlpu.edu.cn
Jihui Wang. Tel: +86-411-86324050; Fax: +86-411-86323646; E-mail: wangjh@dlpu.edu.cn
国家重点研发计划 (No. 2018YFC1406800),大连市科技创新基金 (No. 2019J12SN59),辽宁省自然科学基金 (No. 2019-ZD-0575),辽宁省教育厅科研项目 (No. J2020102) 资助。
赵星月, 李倩, 刘文静, 等. 蛹虫草菌生物合成虫草素的研究进展. 生物工程学报, 2020, 36(7): 1293–1304.
Zhao XY, Li Q, Liu WJ, et al. Advances in biosynthesis of cordycepin from. Chin J Biotech, 2020, 36(7): 1293–1304.
(本文责编 郝丽芳)
