腹腔镜与开腹手术治疗子宫内膜癌的近期效果及安全性研究
2020-07-29杜秀芳
杜秀芳,刘 静
子宫内膜癌是源于子宫内膜腺体的妇科常见恶性肿瘤,围绝经期、绝经后女性易发,具有较高的发病率和病死率[1]。本病约占女性所有生殖系恶性肿瘤的20%~30%,且发病率逐年升高[2]。目前子宫内膜癌发生机制尚不完全清楚,大部分学者认为与患者生活方式等因素相关,>50岁、过度肥胖(体质量指数≥35 kg/m2)及伴糖尿病、高血压病史等是其高危因素[3]。既往临床多采用开腹手术治疗子宫内膜癌,因该手术方式创伤大,加之患者个体的差异性,同时受到年龄、过度肥胖及糖尿病、高血压病史等因素影响,术中易产生大量出血,术后常引发切口感染、切口愈合不良、泌尿系感染等并发症,延长患者住院时间,加重术后疼痛,不利于患者术后恢复,严重影响患者术后生活质量[4]。腹腔镜手术因具有手术创伤小、刺激小、术后并发症少、住院时间短、术后恢复快等优点,近年被越来越多地用于治疗子宫内膜癌[5]。本研究对比分析腹腔镜手术治疗子宫内膜癌的近期效果及安全性,现报告如下。
1 对象与方法
1.1纳入及排除标准
1.1.1纳入标准:①符合子宫内膜癌诊断[6]并经病理检查证实诊断;②单发,术前无远处转移;③无手术禁忌证;④术前未行放化疗;⑤无腹部手术史;⑥患者及其家属知情同意;⑦临床资料完整。
1.1.2排除标准:①影像学检查疑似宫颈间质受累者;②伴肝、心、肾功能严重不全者;③存在手术禁忌证者;④过度肥胖(体质量指数≥35 kg/m2)者;⑤术前行放化疗者;⑥伴宫颈癌、卵巢癌、输卵管癌等其他生殖系肿瘤者;⑦依从性差不能配合本研究治疗方案者;⑧临床资料欠缺者。
1.2对象及分组 选取2016年4月—2017年9月我院行手术治疗且符合上述纳入及排除标准的79例子宫内膜癌,年龄39~65(53.86±7.59)岁;病程7个月~2年4个月(1.78±0.54)年;文化程度:初中及以上61例,初中以下18例;体质量指数20~30(25.76±5.02)kg/m2;肿瘤直径2~8(5.14±2.06)cm;按照国际妇产科联盟标准[7],临床分期Ⅰa/Ⅰb期51例,Ⅰc、Ⅱa期28例;病理类型:内膜样腺癌60例,腺鳞癌9例,透明细胞癌6例,浆液性腺癌4例。所有患者据手术方式的不同分为观察组41例和对照组38例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准同意。

表1 采用不同手术方法治疗的子宫内膜癌两组一般资料比较
1.3治疗方法 所有患者术前常规检查,术前3 d进流质饮食,并每日两次碘伏擦拭阴道,术前常规口服抗生素3 d。术日前晚、术日晨行清洁肠道等肠道准备。两组术后均行辅助放化疗,并予中药汤剂提高机体免疫力,定期复查观察肿瘤复发及转移情况。
1.3.1对照组:对照组予传统开腹手术治疗,具体方法:采取气管插管静脉复合麻醉或连续硬膜外麻醉,患者取仰卧位,切口选择耻骨联合中点至脐间,后逐层纵向切开探查盆腹腔。行全子宫双附件切除术+盆腔、腹主动脉旁淋巴结切除和清扫术,后逐层缝合并置管引流[8]。术后予抗感染等对症治疗。
1.3.2观察组:观察组予腹腔镜子宫内膜癌根治术,具体方法:气管插管静脉复合麻醉,患者取膀胱截石位,常规消毒铺巾插导尿管。于患者脐孔正中处行1 cm小切口,制作人工气腹,压力维持在12~14 mmHg,采用“四孔法”行腹腔镜操作。穿刺进镜后探查盆腹腔,留取盆腹腔积液200 ml送检。腹腔镜下电凝双侧输卵管峡部,以免癌组织经输卵管进入盆腹腔。使用超声刀打开后腹膜,双极电凝高位处理卵巢血管,切除子宫双侧附件;打开膀胱返折腹膜,将膀胱推至宫颈下3~4 cm位置。分离宫旁组织,暴露子宫动静脉,双极电凝子宫动脉。使用超声刀打开子宫直肠腹膜,下推直肠,切断双侧主、侧韧带。离宫颈口1~2 cm处沿阴道穹隆环切开阴道壁,依次清除双侧髂总、髂外、腹股沟深、髂内、闭孔和腹主动脉旁淋巴结。间断“8”字缝合阴道残端,双极电凝创面止血,用0.9%氯化钠注射液冲洗盆腹腔后退镜并缝合穿刺口,放置引流管。放气后缝合各穿刺孔。术后常规予抗感染等对症治疗。
1.4观察指标
1.4.1手术相关指标:比较两组手术时间、术中出血量、术中淋巴结清扫个数、术后肛门排气时间、术后自主下床活动时间、术后住院时间。
1.4.2术后疼痛及生存质量评分:术后1 d采用疼痛视觉模拟评分(visual analogue scale,VAS)量表评估两组术后疼痛情况,该量表分为0~10分,0分表示无痛,10分表示难以忍受的最剧烈疼痛[9]。术后6个月采用简明健康状况调查量表(short from 36 health survey questionnaire, SF-36)评估两组术后生存质量,该量表包括生理功能、身体疼痛、总体健康、活力、精神健康、社会功能、生理职能、情感职能8个维度,总分100分,SF-36评分越高表示患者生存质量越好[10]。
1.4.3术后并发症:术后随访半年,记录两组术后并发症发生情况。
1.4.4近期生存情况:所有患者随访2年,观察终点为随访时间截止或患者死亡,比较两组中位生存时间及生存率。
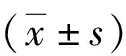
2 结果
2.1手术相关指标比较 两组手术时间、淋巴结清扫个数比较差异无统计学意义(P>0.05);观察组术中出血量少于对照组,术后肛门排气时间、术后自主下床活动时间及术后住院时间均短于对照组,差异有统计学意义(P<0.05或P<0.01),见表2。

表2 采用不同手术方法治疗的子宫内膜癌两组手术相关指标比较
2.2术后疼痛及生存质量评分比较 术后1 d VAS评分观察组低于对照组,术后6个月SF-36评分观察组高于对照组,差异有统计学意义(P<0.05),见表3。
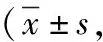
表3 采用不同手术方法治疗的子宫内膜癌两组术后疼痛及生存质量评分比较分)
2.3术后并发症比较 术后随访半年,观察组术后并发症总发生率为14.63%低于对照组的36.84%(χ2=5.144,P=0.023),见表4。

表4 采用不同手术方法治疗的子宫内膜癌两组术后并发症比较[例(%)]
2.4近期生存情况比较 两组随访率均为100%,随访期内两组均有1例死亡。术后随访2年,两组中位生存时间及生存率比较差异均无统计学意义(P>0.05),见表5。

表5 不同手术治疗的子宫内膜癌两组近期生存情况比较
3 讨论
子宫内膜癌是一种上皮来源性肿瘤,每年新增病例高达20万人,且病死率较高,是仅次于卵巢癌和宫颈癌的第三大女性生殖系统恶性肿瘤[11]。流行病学研究显示,子宫内膜癌为西方国家女性发病率最高的生殖系恶性肿瘤[12]。子宫内膜癌大多表现为阴道不规则出血,病因可能与未孕、产次少、合并糖尿病、过度肥胖等有关[13]。相关资料表明,近年因多种原因致使我国子宫内膜癌患者不断增多,且呈年轻化趋势,故及早明确诊断并采取安全有效的治疗是改善本病预后的关键[14]。开腹肿瘤切除和淋巴结清扫术是临床治疗子宫内膜癌的传统方法,虽手术操作简单,但创伤性较大、手术时间过长、具有出血风险且术后恢复较慢[15]。近年,随医学技术的快速发展,腹腔镜技术得到广泛应用,与传统开腹手术相比,腹腔镜手术具有创伤小、术后恢复快及对患者刺激小等优点[16]。
随医疗技术的不断提高及医疗器械的不断改进,以及妇产科医师腹腔镜手术台数的增加和经验的积累,腹腔镜手术时间并不长于甚至短于开腹手术,且因腹腔镜有放大作用,视野更加清晰,可达到与传统开腹手术同样的手术范围,避免了淋巴结清扫不全等弊端[17]。腹腔镜手术CO2气腹的建立使腹腔压升高起到止血作用,加之超声刀的使用极大减少了术中出血量,且可清晰显示术区解剖结构,保证手术切口良好愈合[18]。还有研究显示,腹腔镜手术创伤小,患者术后疼痛较轻,术后1~2 d患者便能下床活动,有利于促进胃肠道功能的恢复[19]。本研究显示:观察组术中出血量少于对照组,术后肛门排气时间、术后自主下床活动时间及术后住院时间短于对照组,与上述研究结果相符。提示腹腔镜手术治疗效果更佳。
子宫内膜癌早期无明显临床症状,随病情进展阴道可出现不规则出血,部分患者可出现淡红色、脓性伴腥臭味分泌物,对患者生活质量造成一定影响[20]。传统开腹手术存在对患者生活质量影响较大等缺陷,且随人民生活水平逐渐提高,人们对生存质量的关注度逐渐增大。有研究指出,腹腔镜手术具有术后疼痛较轻等优点[21]。本结果显示:术后1 d VAS评分观察组低于对照组,术后6个月SF-36评分观察组高于对照组,提示腹腔镜手术有利于降低子宫内膜癌患者术后疼痛及提高术后生活质量。
Janda等[22]对不同地区、不同种族的760例子宫内膜癌的长期随访结果显示,行腹腔镜手术和传统开腹手术患者在总生存率和中位生存时间上并无明显差异。本研究也得到类似结果,术后随访2年两组中位生存时间及生存率比较差异无统计学意义,提示两种术式短期生存情况相当。本研究还观察两种术后半年内并发症发生情况,传统开腹手术切口较大,对患者创伤较大,术后并发症发生率较高,不利于患者术后康复;而腹腔镜手术中CO2气腹使手术获得足够大的空间,可防止手术器械的牵拉,减少子宫周围脏器损伤,术后能较快恢复肠道功能,因而减少了手术并发症的发生[23]。本结果显示:术后随访半年,观察组术后并发症总发生率为14.63%低于对照组的36.84%,与上述研究结果相符。提示腹腔镜手术较传统开腹手术治疗子宫内膜癌有更低的术后并发症发生率,手术安全性较好。
综上,腹腔镜手术和传统开腹手术治疗子宫内膜癌在手术时间、淋巴结清扫效果、短期中位生存时间及生存率方面效果相当,但腹腔镜手术治疗可明显减少术中出血量,促进术后肠功能恢复,减轻术后疼痛,缩短住院时间,提高患者术后生活质量,降低术后并发症发生率,值得推广应用。
