滁菊总黄酮和滁菊多糖配伍体内外抗氧化活性研究
2020-07-28李婷婷汪梦圆方文秀黎文军
吴 冕,李婷婷,汪梦圆,方文秀,黎文军,王 琮,俞 浩
(安徽科技学院 生命与健康科学学院,安徽 凤阳 233100)
相对单体化学成分来说,中药组分活性研究更能体现中药的作用特点,因此,中药组分及组分配伍活性研究越来越受到研究者的重视[1]。滁菊Dendranthema morifolium Ramat.为栽培药材,产地仅限于安徽滁州地区,为“十大皖药”之一,临床主要用于治疗肝阳上亢证[2]。清光绪年间《滁州志》既有甘菊产大柳者药用价值高,且功效优于杭菊的记载,大柳即现在的安徽省滁州市南谯区大柳镇。叶桔泉所著的《现代实用中药》再次肯定了滁菊的药用价值,认为滁菊在药用菊花中品质最优,药效最好。滁菊富含多种活性成分,如黄酮、多糖、挥发油、微量元素等[3]。其中滁菊总黄酮(Total flavonoids of Chuzhou chrysanthemum,TFCC)能够显著改善缺血性心脑血管疾病,机制是抗脂质过氧化损伤[4-7]。同时,TFCC对炎症、疼痛和血液流变学均有显著的生理活性[8-10]。滁菊多糖(Polysaccharides of Chuzhou chrysanthemum,PCC)能够抗疲劳、抗氧化和增强耐缺氧能力[11-12]。本研究从滁菊中提取TFCC和PCC,观察TFCC和PCC配伍的体内外抗氧化活性,以期为滁菊及其活性组分的研究开发提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物 SPF级昆明种小鼠,雄性,18月龄,购自南京市江宁区青龙山动物繁殖场,实验动物许可证号:SCXK(苏)2017-0001。饲养与实验期间动物自由摄食饮水。
1.1.2 药材与试剂 滁菊,采自安徽科技学院中药科技园,经安徽科技学院俞浩教授鉴定为正品滁菊;DPPH(分析纯,上海阿拉丁生化科技股份有限公司,批号:1929061);ABTS(美国Sigma公司);维生素C(Vc,北京化学试剂有限公司);超氧化物歧化酶(SOD),谷胱甘肽还原酶(GSH-Px),丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号分别为20180920、20180913、20180920)。
1.1.3 仪器设备 中药粉碎机(吉首市中州制药器械厂);HH-4型恒温水浴锅(郑州群英予华仪器有限公司);UV-5600PC紫外-可见分光光度计(上海元析仪器有限公司);TDL-5型离心机(上海安亭科学仪器厂);电热恒温鼓风干燥箱(上海三发机械制造有限公司);TG16-WS型台式高速离心机(长沙湘仪离心机仪器有限公司)。
1.2 方法
1.2.1 滁菊加工处理 滁菊采摘后,置50 ℃烘箱48 h烘干,粉碎成粗粉,置阴凉干燥处保存备用。
1.2.2 TFCC提取纯化及含量测定 经70%乙醇提取,D-101大孔树脂纯化,得纯化后的TFCC溶液[13-14],置旋转蒸发仪中回收乙醇,将剩余液体于冷冻干燥机中冷冻干燥,得TFCC粉末。以芦丁为标准对照,绘制标准曲线。称取TFCC 2.032 mg,置10 mL容量瓶中70%乙醇溶解并定容,测定吸光度,绘制计算TFCC含量。
1.2.3 PCC提取纯化及含量测定 参照文献方法[15]采用水提醇沉法提取PCC,sevage试剂去蛋白,取离心后上清液,加入氯仿萃取,直至无浑浊,得沉淀,然后用80%乙醇、丙酮、石油醚各洗涤3次,得PCC。以葡萄糖为标准对照,测定并计算PCC含量。
1.2.4 TFCC和PCC配伍比例 精密称定TFCC和PCC,1%二甲基亚砜溶解后配制成不同比例配伍的待测样品溶液(表1)。
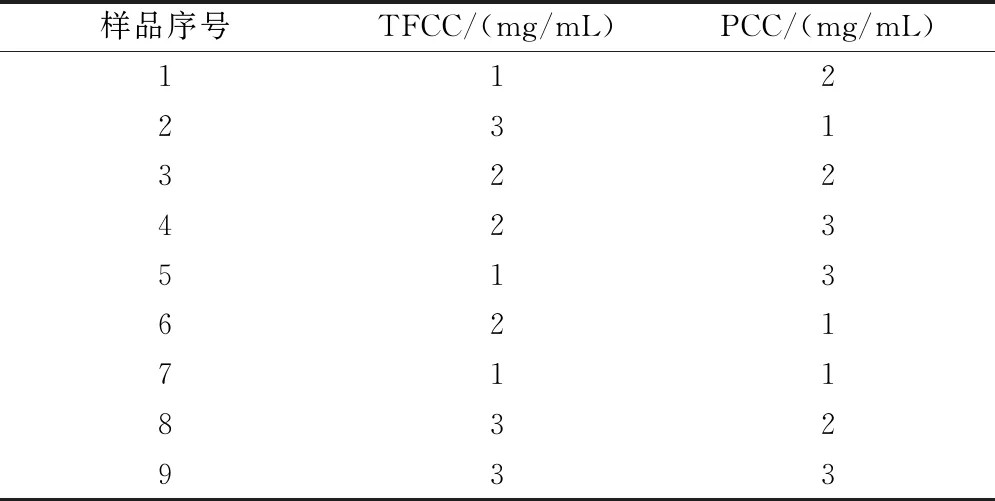
表1 TFCC和PCC配伍比例
1.2.5 TFCC和PCC配伍抗氧化活性测定
1.2.5.1 DPPH自由基清除率测定 参照文献方法配制25 μg/mL DPPH溶液[16-17]。精密量取2 mL不同比例配伍的待测样品溶液,按表2加入相应反应试剂,利用DPPH自由基单电子与抗氧化剂反应后颜色变浅,测定吸光度(重复3次),计算DPPH自由基清除率。DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100。

表2 DPPH自由基清除率测定试剂加样表
1.2.5.2 羟自由基清除率测定 精密量取2 mL不同比例配伍的待测样品溶液,利用·OH与水杨酸作用产生颜色反应,抗氧化剂能清除·OH,使颜色变浅的原理,测定吸光度(A1)[16-17]。以蒸馏水替代待测样品溶液的吸光度(A0),以蒸馏水代替水杨酸的吸光度(A2)。各检测样品分别重复测定3次。计算羟自由基清除率,羟自由基清除率(%)=100×[A0-(A1-A2)]/A0。
1.2.5.3 ABTS+·自由基清除率测定 精密量取不同比例配伍的待测样品溶液,利用抗氧化剂与ABTS+·溶液作用后颜色变浅的原理,测定吸光度(A1)[18]。各检测样品分别重复测定3次。计算ABTS自由基清除率,ABTS自由基清除率(%)=(1-A1/A0)×100。
1.2.5.4 Fe3+相对还原力测定 精密量取不同比例配伍的待测样品溶液,利用抗氧化剂能将K3[Fe(CN)6]还原成K4Fe(CN)6,并进一步与FeCl3反应生成Fe4[Fe(CN)6]3的原理,测定吸光度(A1)[19]。采用Vc(0.1 mg/mL)作阳性对照,测定吸光度(A)。测定空白管吸光度(A0)。各检测样品分别重复测定3次。计算Fe3+相对还原力,Fe3+相对还原力(%)=[(A1-A0)/(A-A0)]×100。
1.2.6 TFCC和PCC配伍对老年小鼠的抗氧化作用
1.2.6.1 动物分组及给药 取小鼠50只,随机分为TFCC+PCC组(40 mg/kg+60 mg/kg)、TFCC组(40 mg/kg)、PCC组(60 mg/kg)、维生素E组(200 mg/kg)和正常对照组,每组10只。采用灌胃方式给药,连续14 d,1次/d。
1.2.6.2 血清及肝脏SOD、GSH-Px、MDA水平测定 末次给药2 h后,采集血液和肝脏,制备血清和肝匀浆液,按试剂盒说明书测定各指标含量[20]。

2 结果与分析
2.1 TFCC测定结果
精密称定芦丁标准品,70%乙醇溶解并定容,配制成0.02 mg/mL的芦丁标准品溶液。芦丁标准曲线方程为:Y=9.65X-0.028,R2=0.997 8,在0.02~0.1 mg 范围内线性关系良好。TFCC含量为722.41 mg/g。
2.2 PCC测定结果
葡萄糖标准曲线方程为:Y=9.91X+0.126 3,R2=0.999 9,在0.01~0.09 mg范围内线性关系良好。PCC含量为626.32 mg/g。
2.3 TFCC和PCC配伍对DPPH自由基清除率的影响
由图1可知,TFCC和PCC不同比例配伍均有清除DPPH自由基作用,不同比例配伍间清除率存在差异,其中2∶3配伍自由基清除率最高,为92.13%;1∶1配伍自由基清除率最低,为64.24%。
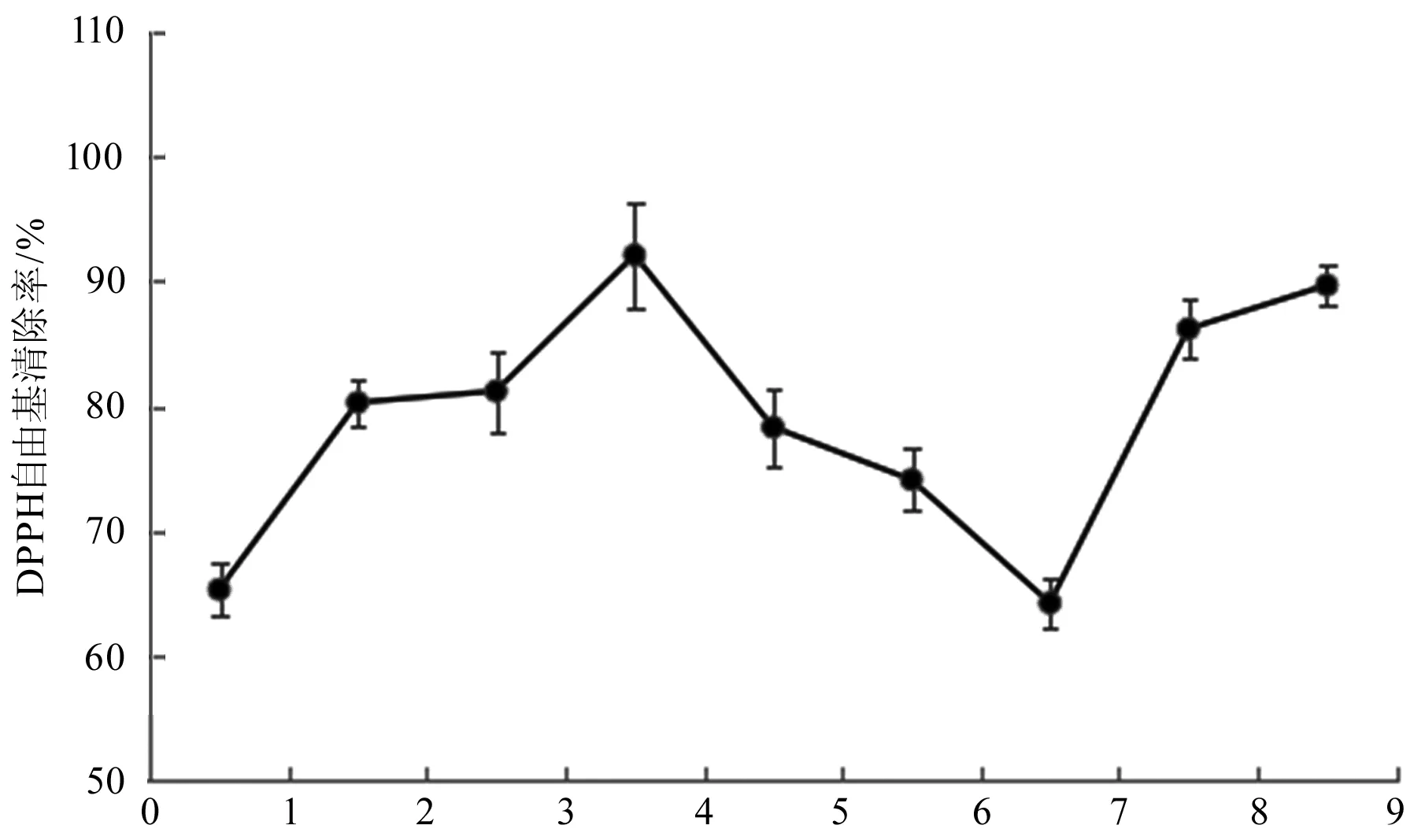
图1 TFCC和PCC配伍对DPPH自由基清除率的影响
2.4 TFCC和PCC配伍对羟自由基清除率的影响
由图2可知,TFCC和PCC不同比例配伍均有羟自由基清除作用,不同比例配伍间清除率存在差异,其中2∶3配伍自由基清除率最高,为86.76%;1∶1配伍自由基清除率最低,为59.31%。

图2 TFCC和PCC配伍对对羟自由基清除率的影响
2.5 TFCC和PCC配伍对ABTS+·自由基清除率的影响
由图3可知,TFCC和PCC不同比例配伍均有ABTS+·自由基清除作用,不同比例配伍间清除率存在差异,其中2∶3配伍自由基清除率最高,为88.23%;1∶1配伍自由基清除率最低,为60.65%。

图3 TFCC和PCC配伍对ABTS+·自由基清除率的影响Fig.3 Effect of TFCC and PCC on ABTS+·scavenging rate
2.6 TFCC和PCC配伍对Fe3+还原能力的影响
由图4可知,TFCC和PCC不同比例配伍均具有Fe3+还原作用,不同比例配伍间还原能力存在差异,其中2∶3配伍对Fe3+还原能力最强,与0.1 mg/mL Vc比较,相对还原力为102.73%;1∶1配伍对Fe3+还原能力最弱,与0.1 mg/mL Vc比较,相对还原力为69.82%。

图4 TFCC和PCC配伍对Fe3+还原能力的影响Fig.4 Effect of TFCC and PCC on Fe3+ reduction ability
2.7 TFCC和PCC配伍对老年小鼠血清SOD、GSH-Px活性及MDA含量的影响
TFCC+PCC组、TFCC组、PCC组小鼠血清SOD、GSH-Px活性均显著高于正常对照组(P<0.05或P<0.01),且TFCC+PCC升高小鼠血清SOD、GSH-Px活性作用显著强于单独给予TFCC或PCC(P<0.01)。TFCC+PCC组、TFCC组、PCC组小鼠血清MDA含量均显著低于正常对照组(P<0.05或P<0.01),且TFCC+PCC降低小鼠血清MDA含量作用显著强于单独给予TFCC或PCC(P<0.05或P<0.01)。维生素E与TFCC+PCC比较作用相当,无显著性差异(P>0.05)(表3)。

表3 TFCC和PCC配伍对老年小鼠血清SOD、GSH-Px活性及MDA含量的影响
2.8 TFCC和PCC配伍对老年小鼠肝脏SOD、GSH-Px活性及MDA含量的影响
TFCC+PCC组、TFCC组、PCC组小鼠肝脏SOD、GSH-Px活性均显著高与正常对照组(P<0.05或P<0.01),且TFCC+PCC升高小鼠肝脏SOD、GSH-Px活性作用显著强于单独给予TFCC或PCC(P<0.05或P<0.01)。TFCC+PCC组、TFCC组、PCC组小鼠肝脏MDA含量均显著低于正常对照组,且TFCC+PCC降低小鼠肝脏MDA含量作用显著强于单独给予TFCC或PCC(P<0.05或P<0.01)。维生素E与TFCC+PCC比较作用相当,比较无显著性差异(P>0.05)(表4)。

表4 TFCC和PCC配伍对老年小鼠肝脏SOD、GSH-Px活性及MDA含量的影响
3 结论与讨论
滁菊临床应用历史悠久,滁菊产业现已发展成为地方主要支柱产业,2018年滁菊获批“十大皖药”,助推了滁菊产业的快速发展。动物实验研究证实,滁菊活性组分对心血管系统具有显著药理作用,TFCC、PCC均显示了较好的抗氧化活性。随着中药药理研究的不断深入,从中药中提取活性组分,并进行定量分析,开展组分配伍的作用和作用机制评价,相对中药单体化学成分药理活性研究来说,更能体现中药整体观的特点[21]。本研究从滁菊中提取并纯化总黄酮和多糖,观察TFCC和PCC配伍的体内外抗氧化作用,对阐明中药组分配伍的合理性和滁菊的进一步深入研究具有重要意义。
本研究采用自由基清除法和Fe3+还原法观察TFCC和PCC的体外抗氧化作用[22-23]。结果表明,TFCC和PCC不同比例配伍均有清除DPPH自由基、羟自由基、ABTS+·自由基作用和Fe3+有还原作用,其中2∶3配伍抗氧化活性最强,1∶1配伍抗氧化活性最低。以Fe3+还原力为评价指标,TFCC和PCC 2∶3配伍对Fe3+还原力强于0.1 mg/mL Vc,相对还原力为102.73%。
在体外实验的基础上,以老年小鼠为研究对象,观察TFCC和PCC 2∶3配伍的体内抗氧化活性。TFCC体内试验剂量设置参照本课题组前期研究结果[3-4,10],设置TFCC剂量40 mg/kg,PCC剂量为60 mg/kg。SOD和GSH-Px是抗氧化酶,MDA是过氧化产物,血清和组织中抗氧化酶活性高低和过氧化产物含量多少能够客观反映药物的抗氧化活性[24-26]。研究结果表明,TPCC和PCC 2∶3配伍能够显著增加小鼠血清和肝脏SOD和GSH-Px活性,降低MDA含量,且活性显著强于单用TFCC或PCC,二者配伍在抗氧化活性方面产生了很好的协同作用,其机制有待进一步深入研究。
