低温等离子靶点射频消融联合胶原酶和臭氧治疗腰椎间盘突出症的疗效观察
2020-07-28杜建生孙全才林学武邓宗环
杜建生 孙全才 王 瑞 林学武 邓宗环
(1 淮南东方医院集团总院疼痛科,淮南232001;2 蚌埠医学院第一附属医院疼痛科,蚌埠233000)
随着社会发展,工作、学习及生活方式的改变,腰椎间盘突出症患病率逐年上升。目前临床现有的非手术治疗可使病人症状得以短期缓解,但不能使突出物回纳从而降低复发率。近年来微创手术的飞速发展为病人提供了更多的选择。目前常用的微创治疗包括胶原酶溶解术、臭氧注射术、低温等离子射频消融术、椎间盘镜下髓核切除术和椎间孔镜下髓核摘除术等。研究发现腰椎间盘突出症引起腰腿痛的机制不仅包括突出椎间盘对神经根的直接机械压迫,还包括局部炎症细胞浸润及免疫反应引起的炎症因子释放导致的神经根充血、水肿、粘连,神经纤维变性,因此许多文献报道单一的治疗手段效果欠佳[1,2]。但采取多种微创方法综合治疗腰椎间盘突出症的报道鲜见。为寻求一套更为安全、有效互补的综合治疗手段,近年来我科尝试采用低温等离子靶点射频消融联合胶原酶和臭氧治疗腰椎间盘突出症,并取得满意效果。现总结报告如下。
方 法
1.一般资料
经淮南东方医院集团总院伦理委员会批准并备案,选取2016 年2 月至2018 年2 月间疼痛科收治入院的腰椎间盘突出症病人60 例, L3-4突出9 例, L4-5突出31 例, L5-S1突出20 例。将病人按入院先后顺序随机分为对照组和实验组各30 例。对照组采用胶原酶联合臭氧注射治疗,实验组采用低温等离子靶点射频消融联合胶原酶、臭氧注射治疗。为了解椎间盘突出的节段及程度,所有纳入本研究的病人在治疗前均行腰椎MRI 及CT 检查。两组病例基线资料(年龄、性别、病程等)均无统计学差异(P> 0.05,见表1)。
纳入标准:①病人均存在腰腿痛或麻木症状,非手术治疗1 月以上,症状无缓解甚至加重,视觉模拟评分法(visual analogue scale, VAS)评分≥5;②腰椎CT 或MRI 影像学检查提示不同程度腰椎间盘突出,2 mm ≤ 突出物 ≤10 mm,腰椎管狭窄;③临床症状和影像学检查所示突出节段相一致;④签署知情同意书,自愿完成治疗计划。
排除标准:①合并有严重器质性病变、恶性肿瘤或既往长期卧床的病人;②高度怀疑术后不能解除症状者(如突出和症状节段提示不一致);③合并精神疾病;④有出血倾向;⑤单纯腰痛,未合并下肢症状;⑥MRI 或CT 显示腰椎椎间盘严重退变、突出物钙化或纤维环完全破裂致巨大突出、脱出及髓核游离;脊柱畸形、腰椎椎管严重狭窄或II 度以上腰椎滑脱。
设备仪器:高通低温等离子射频治疗仪;辽宁味邦生物制药有限公司胶原酶600 U;德国卡特医用臭氧治疗仪。
2.治疗方法
根据病人症状、体征及腰椎CT 和MRI 检查定位责任椎间盘,病人俯卧于CT 检查台上,腹部垫枕,选择合适的腰背部拉伸的姿势,放置定位标记线。常规薄层CT 扫描(1.5 mm)确定椎间盘突出最大层面,并在体表用记号笔定位靶点,相对应角度、距离后退出CT床,其中L3-4、L4-5椎间盘突出等离子穿刺针穿刺途径为关节突关节外侧缘(见图1A),注射胶原酶穿刺针途径为关节突关节内侧缘椎管内突出物最大层面为穿刺靶点(见图1B),L5-S1椎间盘突出为一针穿刺法,穿刺途径为侧隐窝关节突关节内侧缘盘内穿刺,穿刺靶点为椎管内突出物最大层面(见图1C)。
表1 两组一般资料比较 (n = 30, ±SD)

表1 两组一般资料比较 (n = 30, ±SD)
组别 性别 年龄(岁) 病程(月)男 女对照组 12 18 45.7±6.5 5.2±2.3实验组 16 14 45.6±6.8 5.0±1.9
(1)L3-4、L4-5椎间盘突出症手术治疗过程:消毒铺无菌巾后用1%利多卡因行穿刺点皮丘及深层麻醉,用腰椎等离子专用穿刺针穿刺到达纤维环或突出物内距离外缘2 mm 处,注入0.9%生理盐水0.5 ml,置入等离子刀头超过穿刺针口0.5 cm,分别以1 档、2 档、3 档、4 档调制消融键,病人下肢无跳动感、无不适,以4 档消融24 s,再往里置入刀头0.5 cm,以4 档消融24 s,取出刀头气化清理刀头,然后再次置入刀头至穿刺针口0.5 cm 处,分别以1 档、2 档、3 档调制气化键,待病人下肢无跳动、无不适,前后缓慢抽动0.5 cm(4 s 一次)来回抽动8 次。根据具体情况选择多靶点消融,一般一个间盘不超过三个靶点,然后将穿刺针退至纤维环或突出物外注入30 mg/l 臭氧5 ml,注入(2%利多卡因、地塞米松、生理盐水4:1:5 比例)混合液5 ml。同时用硬膜外穿刺针从关节突关节内侧缘穿刺到达椎管内突出物处,有突空感时,注入30 mg/l 浓度臭氧5 ml,再次CT 扫描确定针尖位于突出物处,硬膜外腔可见气体影,注入(2%利多卡因、地塞米松、生理盐水4:1:5 比例)混合液5 ml,置入针内针至突出内,观察15 min 无脊髓麻醉情况,盘内注入胶原酶300 U,突出物周围注入900 U,术毕,拔出穿刺针无菌敷料覆盖针眼,安返病房(见图1D)。
(2)L5-S1椎间盘突出症手术过程:消毒铺无菌巾后用1%利多卡因行穿刺点皮丘及深层麻醉,用颈椎等离子专用穿刺针穿刺到达纤维环或突出物内距离外缘2 mm 处,注入0.9%生理盐水0.5 ml,置入颈椎等离子刀头超过穿刺针口0.5 cm,分别以1 档、2 档、3 档调制消融键,病人下肢无跳动感、无不适,以3 档消融24 s,再往里置入刀头0.5 cm,以3 档消融24 s,取出刀头气化清理刀头,然后再次置入刀头至穿刺针口0.5 cm 处,分别以1 档、2档调制气化键,待病人下肢无跳动、无不适,前后缓慢抽动0.5 cm(4 s 一次)来回抽动8 次。根据具体情况选择多靶点消融,一般两个靶点为宜(多靶点只能沿着穿刺针的方向进入盘内,不能调整穿刺针重新穿刺),然后将穿刺针退至突出物外注入30 mg/l臭氧5 ml,注入(2%利多卡因、地塞米松、生理盐水3:1:1 比例)混合液5 ml,置入针内针至突出物内,观察15 min 无脊髓麻醉情况,突出物内注入胶原酶300 U,突出物周围注入900 U,术毕,拔出穿刺针无菌敷料覆盖针眼,安返病房(见图1E)。
(3)术后护理及康复:嘱咐病人俯卧位6 h,卧床72 h,术后3~4 天可出院,术后1 月内佩带腰围活动,1 周、3 月及6 月后门诊随访。
因在该研究中,L3-4、L4-5与L5-S1的等离子消融穿刺路径选择的不同是因不同间隙解剖结构不同,穿刺路径的选择是在保证安全的前提下穿刺针尖最接近突出物靶点,符合实验目的。
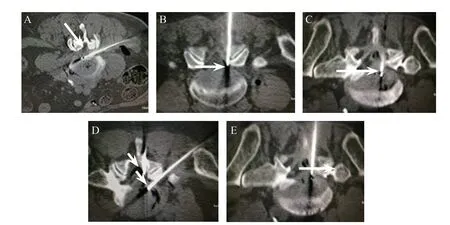
图1 CT 下穿刺针到达靶点图示
3.观察指标
在治疗前、治疗后1 周、3 月及6 月采用VAS和日本骨科协会腰痛评分量表(Japanese orthopaedic association, JOA)评分对病人疗效进行评分。通过对评分结果进行统计学分析客观评价三联微创治疗对腰椎间盘突出症的疗效。
(1)VAS 评分:让病人在标有“0~10”的直尺上标出与自己疼痛程度最为接近的位置,0 为无痛;1~3 为轻微疼痛;4~6 为中度疼痛并影响睡眠;7~10 为难以忍受的重度疼痛。
(2)JOA 评分:评估包括3 项主观症状(腰背痛、腿痛兼/或麻刺痛、步态,每项 3 分,共 9 分)、3 项临床体征(直腿抬高试验和加强试验、感觉障碍、运动障碍,每项 2 分,共 6 分)和 7 项日常活动(平卧翻身、站立、洗漱、前屈、坐位、举重物、行走,每项 2 分,共14 分),共计 29 分。分值越低,功能越差。
(3)术后 6 个月按照 MacNab 标准对临床疗效进行分级。优:腰腿痛等症状完全消失,能参加工作和运动;良:偶有局部痛感,活动轻度受限,不影响工作;可:症状体征有好转,影响工作;差:症状体征无改善,甚至加重。优良率=(优+良)例数/总例数 × 100%。
4. 统计学分析
数据采用 SPSS 18.0 软件处理,所有计量资料以均数 ± 标准差(±SD)表示,术前两组病人的基本情况中分类资料使用X2检验,计量资料(年龄,病程)采用t检验,因VAS 和JOA 评分数据属于重复测量数据,采用重复测量的方差分析,分析前进行球形检验,本实验数据各项指标的球形检验P> 0.05,数据符合Huynh-Feldt 条件,治疗前后比较采用单因素方差分析。P< 0.05 为差异有统计学意义。
结 果
两组病人在手术过程中及随访时,均未出现不良反应。术前两组在VAS 和JOA 评分上无统计学差异(P> 0.05)。术后1 周、3 月及6 月,两组VAS 和JOA 评分均较术前改善(P< 0.05)。实验组VAS 和JOA 评分在术后1 周、6 月均较对照组显著改善,差异有统计学意义(P< 0.01,见表2)。6 个月时随访两组优良率分别为实验组(90%)、对照组(80%),差异有统计学意义(P< 0.05,见表3)。
表2 两组术前及术后1 周、3 月、6 月VAS 和JOA 评分比较 (n = 30, ±SD)

表2 两组术前及术后1 周、3 月、6 月VAS 和JOA 评分比较 (n = 30, ±SD)
*P < 0.01,组内术前术后各项指标相比; #P < 0.01,组间各项指标随访期间相比;两组JOA 和VAS 评分术后1 周、3 月及6 月,差异均有统计学意义(P = 0.007, P = 0.03, P = 0.001)
术前 术后1 周 3 月 6 月VAS 对照组 8.4±1.0 3.3±1.0* 2.1±0.9* 1.9±0.8*实验组 8.2±1.1 2.6±0.8*# 1.6±0.8*# 1.1±0.7*#JOA 对照组 11.0±1.6 14.0±1.7* 18.2±1.4* 21.3±1.5*实验组 11.4±1.8 17.4±2.1*# 20.6±2.0*# 23.3±1.7*#
讨 论
据统计腰痛及坐骨神经痛为慢性疼痛的主要组成之一,其中约85%病人被确诊为LDH[3]。 LDH好发年龄段在40~50 岁之间,且有明显年轻化趋势,常见累及节段为L3-4、 L4-5及L5-S1[4,5]。当椎间盘发生退行性病理改变,纤维环破裂,髓核在重力作用下沿破裂的纤维环突出,使相应节段的神经根受到机械性压迫及炎症因子的化学刺激,引起神经组织缺血、水肿,神经纤维发生脱髓鞘改变及神经传导受阻,最终导致神经纤维变性及功能缺失,从而引发腰腿痛麻等一系列临床症状[6]。
LDH 病人大部分经保守治疗短时间内症状可缓解,但易反复发作。因此对于单节段突出较大的病人,临床更倾向手术治疗。但由于传统手术创面大、费用昂贵及术后恢复时间长等缺点,被许多病人排斥[7]。而微创手术以其创面小、费用低及疗程短的优点逐渐被越来越多的医师和病人推崇。其中胶原酶溶解术应用最早,技术最为成熟,胶原酶能够溶解以胶原蛋白为主要成分的髓核,使突出物髓核减小或消失,解除对神经组织的压迫。根据LDH 发病机制相关基础研究表明,与LDH 相关的腿部疼痛不仅是由于机械性神经根受压引起的,还包括细胞因子或其他炎症介质引起的化学性刺激[8,9]。在许多病人中,更重要的因素是炎症[9]。有学者[10]尝试利用臭氧本身的镇痛作用,以及其强氧化和抗炎作用,通过椎间盘内注射也一定程度缓解了LDH 引起的腰腿痛症状。但由于臭氧注射治疗范围有限,如果炎症累及腰丛神经,治疗仅限于椎间盘或硬膜外腔不能达到很好的效果。也有学者主张以胶原酶溶解术作为基础联合臭氧注射治疗腰椎间盘突出症,较单纯胶原酶溶解术疗效有所改善,但术后仍有部分病人存在疼痛加重期,且缺乏远期疗效观察[11,12]。本研究对照组采用胶原酶联合臭氧治疗腰椎间盘突出症,术后各时间点VAS 评分均显著降低,JOA评分明显升高,说明该方法治疗腰椎间盘突出症疗效确切,但如同文献报道,术后病人JOA 评分升高缓慢,甚至部分病人出现疼痛加重。究其原因,可能是药物注射时椎间盘基质肿胀压力增大,术后胶原蛋白的分解水化使盘内容量和压力进一步增加导致。因此在减少髓核的物理容量降低纤维环内的压力的同时又能及时解除盘外组织的炎性充血水肿成为了近几年研究热点。
随着射频消融术在腰椎间盘突出症病人中的广泛应用,发现在手术过程中射频消融术可通过射频热凝使突出椎间盘的部分髓核变性、凝固,从而缩小病变椎间盘的体积,降低盘内压,即刻缓解突出物对相应神经根及血管的压迫、刺激症状,此外还可毁损纤维环内层的伤害感受器,使疼痛症状进一步改善[13]。且短时间内升高椎间盘周围组织温度,可促进血运,加速炎症代谢,一定程度上增加镇痛效果,治疗椎间盘膨出效果明显,但对于纤维环破裂的椎间盘突出效果欠佳。鉴于此,本研究尝试将低温等离子射频消融、胶原酶髓核溶解及臭氧注射治疗三种方法结合,用于治疗LDH 病人,先利用低温等离子髓核消融术减少突出物髓核胶原纤维的总量,为后续注射胶原酶充分发挥其溶解突出物髓核过程体积增大提供空间,再注入臭氧,减轻突出节段周围炎症,即时镇痛,最后在盘内及突出物周围注入一定量胶原酶,充分发挥其化学髓核溶解作用。本研究发现,实验组术后VAS 评分较术前显著降低,JOA 评分升高明显。且实验组术后各时间点JOA 评分较对照组显著升高,术后1 周和6 月,VAS 评分降低与对照组比较更加明显,差异有统计学意义。术后6 月对照组的优良率为80%,而实验组高达90%。本研究表明两种联合疗法均能有效治疗腰椎间盘突出症,但低温等离子靶点射频消融联合胶原酶和臭氧效果更加确切,病人术后疼痛缓解更加明显,术后无疼痛加重,病人体验更佳。
综上所述,低温等离子髓核消融可有效抵消胶原酶化学髓核溶解时带来的体积增大进一步压迫神经的现象,低温等离子髓核消融、胶原酶化学髓核溶解、臭氧消炎镇痛三者结合治疗方法有效互补,相较于胶原酶联合臭氧注射治疗取得更为满意的临床效果。
