基于高通量测序技术分析生物质炭可溶性组分处理不结球白菜叶片的转录组学分析
2020-07-28时薇卞荣军郑聚锋刘晓雨张旭辉李恋卿潘根兴
时薇,卞荣军,郑聚锋,刘晓雨,张旭辉,李恋卿,潘根兴
(南京农业大学农业资源与生态环境研究所,江苏 南京 210095)
生物质炭是指生物质在一定的热裂解温度条件下,隔绝氧气使有机物发生裂解和聚合后再经固、液、气分离而得到的一类富含碳质元素的固体物质[1]。生物质在热裂解过程中,一部分有机物转变为小分子挥发性可燃气后冷凝形成类似木醋液的液体组分,而大部分有机物经过聚合反应形成富含芳香烃类的固体生物质炭。施用生物质炭可显著提升土壤肥力并促进作物生长和提高产量[2-3],但生物质炭-作物的直接作用机制仍鲜有报道。近年来,有研究发现生物质炭表面可溶性组分对作物生长的影响也具有重要作用[4-6]。
小分子有机物、挥发分伴随着生物质热裂解过程产生,吸附于生物质炭的表面及孔隙形成生物质炭表面可溶性组分[4,7-8]。其含量受热裂解温度和原料性质的影响[9],不同类型生物质炭水溶性有机物含量约为0.05%~4%[4]。生物质炭施入土壤后,可溶性有机碳随之溶解释放并参与土壤中的生物地球化学循环过程。然而,目前生物质炭可溶性有机-无机组分及其对作物生长的影响机制还不清楚。原因在于生物质炭表面可溶性物质组分复杂,包括多种可溶性盐、胶体矿物、小分子有机物、类腐殖酸的大分子有机化合物等[7,10]。其中有机组分与自然界中的溶解性有机物类似,具有很强的氧化还原活性,不仅影响土壤中金属元素赋存形态,也显著影响植物养分的吸收与体内的代谢途径和效率[10]。E等[6]发现稻壳生物质炭表面可溶性组分中有机小分子物质C7H8O2(5-甲基-2-乙酰基呋喃)可与生长素结合蛋白形成类似吲哚乙酸功能的植物生长激素,促进水稻的生长并显著影响植物代谢过程和防御功能。Lou等[5]发现叶面喷施小麦秸秆生物质炭可溶性组分不仅可显著增加不结球白菜的生物量,还可提高叶片中可溶性糖、维生素C和可溶性蛋白等含量。王盼等[11]基于生物质炭表面可溶性组分研制了具有显著促产提质效果的有机无机水溶肥。生物质炭表面的可溶性组分可能是生物质炭-作物相互作用的关键物质,目前缺少对植物生理过程变化机制的深入研究。有研究认为生物质炭的施用可以改变某些作物的基因表达,从而影响生理代谢途径[12]。
不结球白菜(Brassicacampestrisssp.chinensisMakino)是我国重要的叶菜类蔬菜,占长江中下游蔬菜总种植面积的30%~40%[13]。通过喷施生物质炭表面可溶性组分使不结球白菜生物量显著提高60%~90%,同时品质指标也得到显著改善[5]。因此,本研究利用高通量转录组分析技术,比较添加与未添加小麦秸秆生物质炭表面可溶性组分对不结球白菜叶片的基因表达影响,进而对差异基因进行功能注释并分析参与的代谢功能和途径,试图从转录组角度解释生物质炭表面可溶性组分对作物生长的影响,为完善生物质炭与作物间相互作用机制提供依据。
1 材料与方法
1.1 供试材料与处理
生物质炭制备:本研究中小麦秸秆采集于江苏省宜兴市徐舍镇,经自然晾干后剪碎至长度约3 cm,于350 ℃条件下进行热裂解炭化。不结球白菜品种为‘苏州青’。小麦秸秆及其制备的生物质炭有机碳含量采用重铬酸钾-浓硫酸外加热法测定。小麦秸秆和生物质炭经H2SO4-H2O2消煮后,采用凯氏定氮法测定全氮含量;采用钒钼黄比色法测定全磷含量;采用火焰光度计法测定全钾含量。采用乙酸钠-火焰光度计法测定生物质炭阳离子交换量;pH 值采用水浸提法(生物质炭与水的比例为1∶10)测定,结果见表1。

表1 供试小麦秸秆和生物质炭的基本性质Table 1 Basic properties of wheat straw and experimental biochar
生物质炭可溶性组分制备:将小麦秸秆生物质炭和水按照1∶20混合,沸水浴3 h,室温条件下180 r·min-1振荡24 h后,用0.45 μm滤膜抽滤,得到小麦秸秆生物质炭浸提液[5],其中可溶性有机碳(DOC)的浓度为807.92 mg·L-1。
试验于南京农业大学资源与环境科学学院温室内进行,室内温度为24~28 ℃,每天光照时间为16 h。经预先消毒浸种后,选取不结球白菜籽粒饱满、大小一致的种子,播种于装有混合基质(蛭石和珍珠岩的质量比为3∶1)的72孔育苗盘中。试验设置2个处理,分别为喷施常规1/4霍格兰营养液的对照(CK)和喷施用1/4霍格兰营养液稀释30倍的小麦秸秆生物质炭可溶性组分(BE)处理,并用稀酸(HCl)和稀碱(KOH)调节2种营养液pH值为6.5~6.8,每天每孔喷施10 mL营养液,每个处理种植不结球白菜72株。待不结球白菜发芽1个月后,随机剪取叶片混合并提取RNA。每个处理3次重复。
1.2 文库构建和上机测序
样品移交安诺优达基因科技有限公司完成后续文库的构建及上机测序等步骤。具体方法:用带有Oligo(dT)的磁珠富集经检测合格的总RNA样本中的mRNA,向富集出的mRNA中加入片段缓冲液将其打断形成短片段,再以其为模板,用六碱基随机引物合成cDNA第1链,并加入缓冲液、dNTPs、RNaseH和DNA PolymeraseⅠ继续合成cDNA第2链,经过QIAQuick PCR试剂盒纯化并加EB缓冲液洗脱。洗脱纯化后的双链cDNA再进行末端修复、加碱基A、加测序接头处理,经琼脂糖凝胶电泳回收目的片段并进行PCR扩增,完成整个文库制备工作。后期文库的转录组测序基于Illumina HiSeq 2000高通量测序平台,利用bcl2fastq软件进行碱基识别之后,将最初的原始图像结果数据转化为原始测序序列(sequenced reads),即为Raw Data或者Raw reads。
1.3 数据分析
1.3.1 数据的过滤及组装为保证数据分析的质量,需要过滤去除2个样本的原始序列中包含的接头或者低质量序列。判定条件为:1)接头污染碱基数大于5 bp的reads;2)质量值(Q)≤19碱基数,并占总碱基50%的低质量reads;3)未知碱基比例大于5%的reads。最终得到高质量序列。
由于不结球白菜尚未有完整基因组数据,采用无参转录分析组装软件Trinity(Trinity Release v2.4.0)组装高质量序列形成线性重叠群(Contigs)后,聚类得到同源基因可能的表征集合(Components),构建德布鲁因图(de Bruijn),组装出全长转录本序列;选取每个基因最长的序列作为单基因簇(Unigene)[14],并与拟南芥、油菜、甘蓝等基因数据比对。
1.3.2 基因功能注释利用TransDecoder对选取出的Unigene的编码区域进行鉴定,预测得到开放阅读框序列(ORF)和Trinity组装得到的Unigene序列,通过BLAST、HmmScan、Singal P、TmHMMP等工具与非冗余核酸序列数据库(NT)、非冗余蛋白序列数据库(NR)、蛋白质数据库(Uniport)、基因本体(GO)、原核生物基因直系同源关系数据库(COG)、真核生物基因直系同源关系数据库(KOG)、京都基因与基因组百科全书(KEGG)等数据库进行比对,获得最高序列相似性蛋白,最后用Trinotate(Trinotate Release v3.0.2)整合功能注释结果。利用NR数据库的注释结果,使用Blast2GO软件对GO结果进行统计,再用WEGO软件[15]根据二级GO条目(直属于细胞组分、生物过程和分子功能三大条目)统计结果绘制柱状图。通过京都基因与基因组百科全书KEGG的注释信息后,应用超几何分析找出差异基因显著富集的代谢通路(pathway),对基因的生物学行为做进一步研究。
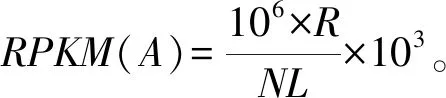
由于环境、空间、时间等因素造成基因表达的差异为差异基因,差异基因的筛选和富集分析对转录组数据的分析具有重要的意义。利用DESeq2软件比较参考组和处理组,并以|log2Ratio|≥1和P<0.05作为基准,筛选显著差异表达的基因,包括上调基因(up-regulated gene)和下调基因(down-regulated gene)。
1.4 荧光实时定量PCR检测
分别从果胶裂解酶、果胶酯酶、胼胝质合成酶、UDP-糖基转移酶差异表达的同源基因中,随机选取15个进行荧光定量PCR分析以验证其在处理中的表达情况。利用TaKaRa PrimeScript RT Master Mix试剂盒反转录得到cDNA,以cDNA为模板进行PCR反应,各基因的扩增引物见表2。提取得到的RNA经反转录得到cDNA,反转录方法采用PrimeScriptTMRT Master Mix试剂盒(RR036A)。反应液各组分包括2 μL 5×PrimeScript RT Master Mix(Perfect Real Time),1 μL Total RNA,7 μL RNase Free dH2O;反转录反应条件为:37 ℃ 15 min;85 ℃ 5 s。使用双蒸水(ddH2O)将获得的反转录反应液稀释至10 ng·μL-1,取2 μL反转录产物加到下一步的荧光实时定量PCR反应体系中,反应体系(20 μL)为:10 μL TBGreen,正、反引物各0.8 μL,2 μL RT反应液,6.4 μL dH2O。反应程序:96 ℃ 120 s;94 ℃ 20 s,56 ℃ 20 s,72 ℃ 20 s,40个循环;95 ℃ 10 s;65 ℃ 60 s,97 ℃ 1 s。选Actin作为内参基因,目的基因的相对表达水平利用ABI7500 SDS分析软件生成,每个基因设3个重复。
2 结果与分析
2.1 转录组装结果统计与质量分析
通过Illumina HiSeq 2000高通量测序平台转录组分析共获得274 770 358条reads,其中CK和BE处理分别平均得到44 385 115条和47 205 004条Raw reads,去除接头污染、低质量和含有大量未知碱基的reads之后,CK和BE分别获得42 965 753.33条和45 380 552条Clean reads。Clean reads占原始数据的比例达96.8%和96.1%,原始序列中质量值大于30的碱基数占总碱基数的比例(Q30)的平均值分别是94.27%和94.13%(表3)。
利用Trinity组装软件对Clean reads构建De novo转录组,共计组装出65 015条Unigene,Unigene的碱基数为57 709 300。其中转录本的平均为1 036 bp,最长的为16 399 bp,最短为201 bp,N50(序列从大到小排列,当其累计长度超过全部序列总长度50%时,最后1个序列的大小即为N50的大小)值为1 473 bp,N90(当其累计长度超过全部序列总长度90%时,最后1个序列的大小即为N90的大小)为496 bp,转录本长度主要集中在200~1 800 bp,且数量随长度的增加而递减(图1),GC(鸟嘌呤和胞嘧啶所占的比率)含量达到43.71%。若组装出的Unigene长度越长,就说明Unigene更接近全长。这些数据均说明本次研究组装结果较好,样本结果可靠,文库质量较高,能够为后续生物信息学分析的准确性提供保障。
2.2 不结球白菜叶片差异基因的分析
与对照相比,共筛选出499个差异基因,其中152个差异基因上调表达,347个差异基因下调表达。其中差异基因的差异表达倍数在5倍之内,占总数的99.2%。
2.3 差异转录基因的GO(Gene Ontology)分类统计
从图2可知:筛选到的499个差异基因分布于分子功能(molecular function)、生物学过程(biological process)和细胞组分(cellular component)的43个基本单元中的3个主要分支。这3类条目所占的比例分别为25.6%、46.5%和27.9%,这说明绝大多数的差异基因主要与生物学过程相关。在细胞组分当中,细胞组件(cell part)、细胞器(organelle)和细胞膜(membrane)的差异基因占有较大的比例。生物学过程中差异基因主要富集在代谢过程(metabolic process)和细胞过程(cellular process)中,应激反应(response to stimulus)所占的比例也相对较高。分子功能中则是催化活性(catalytic activity)和细胞结合(binding)占的比例明显高于其他基本单元。
2.4 差异基因GO显著性富集分析
根据错误发现率(FDR)值对分子功能、生物学过程和细胞组分三大类中差异基因在GO富集程度进行排序。由表4可知:筛选出的最显著富集GO条目主要集中于分解和代谢等过程。在生物学过程中,分别有48和70个差异基因富集在多糖代谢过程(GO:0005976)和碳水化合物代谢过程(GO:0005975)。其中多糖代谢过程中有46个差异基因下调表达,2个上调表达;富集于碳水化合物代谢中的70个差异基因中有68个下调表达,2个上调表达。分子功能中,富集程度最高的是葡糖基转移酶活性(GO:0046527),有9个差异基因上调表达,16个差异基因下调表达。细胞组分中,外部封装结构(GO:0030312)和细胞壁(GO:0005618)中各有58个完全相同的差异基因,其中57个下调表达,1个上调表达。胞外区中,61个差异基因中有56个下调表达,5个上调表达。除葡糖基转移酶活性中有较多的基因上调表达,其余显著富集GO条目中的差异基因多为下调表达,说明生物质炭可溶性组分可能对这类基因的表达和功能影响较大。GO条目富集结果表明不结球白菜叶片细胞壁部位的碳水化合物和多糖代谢过程速率降低,相对应多糖的含量增加。葡糖基转移酶活性中9个上调表达的基因均是UDP-糖基转移酶的同源基因,而UDP-糖基转移酶可以催化葡萄糖基从UDP-葡萄糖转移到受体分子的过程,并调节受体分子在细胞和机体内的活性,对生物活性、转运性、次生代谢产物的合成、解毒和防御功能等产生影响,下调基因调控的酶种类与多糖代谢过程中酶种类一致。以上结果说明添加小麦秸秆生物质炭可溶性组分很可能对不结球白菜的代谢功能和抗性产生一定的影响。
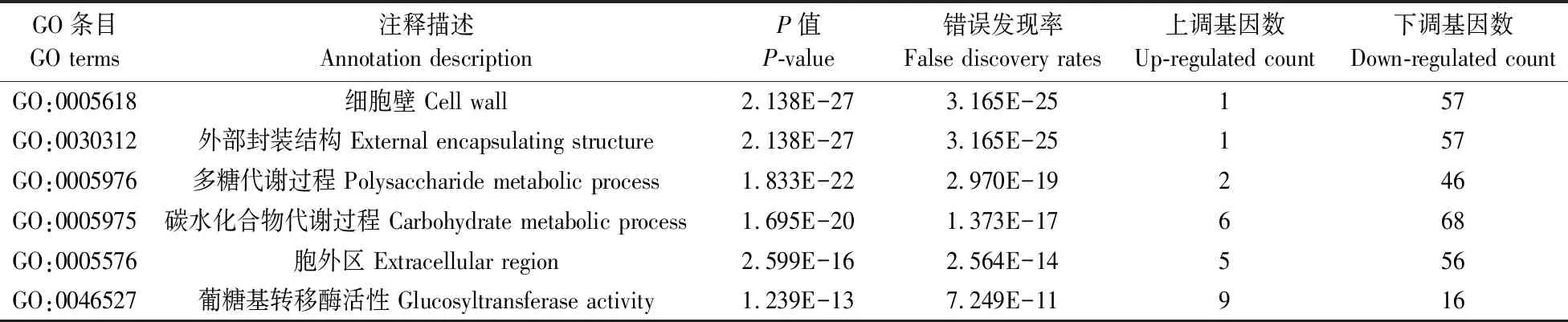
表4 生物质炭可溶性组分处理下不结球白菜叶片中显著富集的GO条目Table 4 Significantly enriched GO items in non-heading Chinese cabbage leaves treated with biochar extract
2.5 差异基因KEGG通路分析
对Unigene中筛选出的差异基因与KEGG数据库进行比对,获得差异基因在小麦秸秆生物质炭可溶性组分处理下不结球白菜叶片代谢途径中的功能定位。差异基因一共参与到62条代谢通路中,以P<0.05为标准,应用超几何检验对KEGG通路进行富集分析,选出差异基因显著富集的通路。结果显示,在62条代谢通路中,戊糖和葡萄糖醛酸相互转化(pentose and glucuronate interconversions,ko:00040)通路显著富集,与前文GO分析中碳水化合物和多糖代谢相互佐证,结果表明生物质炭可溶性组分的添加对不结球白菜叶片细胞壁中糖类物质的合成和分解可能产生显著影响。
2.6 差异表达基因的实时荧光定量PCR验证
挑选15个基因进行RT-qPCR验证(图3)。这15个基因RT-qPCR的表达倍数虽与转录组测序分析的结果在数值上有一定的差异,但是基因表达变化趋势一致,表明高通量转录组分析结果具有较高的准确性。
3 讨论
已有研究证实生物质炭以及生物质炭表面可溶性有机物具有较高的生物活性,可以促进作物养分吸收,并且提高作物的产量和品质[16-17]。作物养分吸收、运输和转化是由不同基因参与的多种代谢过程交织而成的复杂网络系统。通过对不同环境、时空条件下转录组差异表达信息的全面分析有助于深入了解生物质炭表面可溶性物质对作物生长的作用机制。碳水化合物是不同种类糖的总称,包括单糖、双糖以及多糖等,而生物质炭可溶性组分的施入可能改变其中多糖的代谢过程。对富集在多糖代谢条目里48个差异基因中的46个下调表达的差异基因进行整合分析之后发现,这些基因分别控制果胶裂解酶、果胶甲酯酶和胼胝体合成酶的合成。
植物细胞壁的成分主要是纤维素、半纤维素、木质素以及果胶,其中果胶为植物细胞壁中一种重要的多糖形式,主要存在于中胶层以及初生壁中,以细胞间支撑物质的形式存在[18]。果胶裂解酶(PL)和果胶甲酯酶(PME)是可以促进果胶降解,其同源基因表达的下调说明这2类酶在细胞壁中的活性降低[19]。对于果蔬类作物而言,果胶的含量和完整性与果实贮藏、运输和抗病能力等方面有着密不可分的关系[20]。果实在被采摘之后,果胶裂解酶活性增加,加速果胶类物质的分解,使细胞间黏合能力下降,最终导致果实快速成熟软化[21]。有研究证明PME活性的抑制不影响果实的成熟和软化,并且可以保持果实的完整性,延长果实的贮存时间[22]。因此,本研究中PL和PME 2类酶同源基因的下调表达可以更好地维持叶片的结构,延缓细胞和组织的衰老分解,从而提高作物的品质和抗性。这可能是由于生物质炭可溶性组分中小分子有机酸和类腐殖酸物质具有极强的氧化还原能力,可通过电子传递调节植物体内氧化还原反应进程和方向,从而影响作物生长和品质[5,10,23]。
胼胝质是围绕在筛管周围的一种无定形多糖类物质,累积形成胼胝体。其形成与季节有关,一般多产生于秋冬季节[24],胼胝体合成酶活性的降低是响应季节的一种变化。在葡糖基转移酶活性中上调表达的9个基因中有7个与UDP-葡糖基转移酶活性有关,另外2个属于功能未知的基因。这7个基因分别为UGT73C2、UGT73C3、UGT73C5、UGT74E2、UGT75D1、UGT84A1、UGT84A3。这类酶的主要功能是将糖基从供体转移到受体并调节受体分子在细胞和机体内的活性,主要涉及生物活性、激素平衡、解毒以及防御过程等[25]。拟南芥中UGT74E2和UGT75D1均以吲哚-3-丁酸(IBA)这种生长素前体作为供体,通过供体羧基与葡萄糖结合形成生长素糖脂使IBA失活。这2个基因在拟南芥中的过表达会扰乱生长素稳态,改变作物形态结构,但也提高了拟南芥的抗逆性,使其在干旱条件或盐分胁迫的情况下仍可以正常生长[26]。UGT73C5可以调控细胞分裂素的应答并维持其含量的动态平衡,在UGT73C5过表达的拟南芥植株体中细胞分裂素含量明显增加,促进细胞分裂的过程[27]。UGT73C5基因还可糖基化镰刀霉毒素使其丧失毒性,从而提高植物体的抗病性[27]。Copley等[12]研究结果也证实生物质炭添加可显著改变大豆叶片初级代谢和植物防御、免疫相关基因的表达,从而提高大豆抗病能力,而生物质炭表面的可溶性有机组分可能是激活植物抗病基因的关键因子。
综上所述,生物质炭表面可溶性组分可能改变作物基因的表达,从而调控作物的代谢过程和抗病性,影响作物生长和健康。本研究结果初步揭示生物质炭-作物相互作用的分子生物学机制。然而,生物质炭对作物生长的作用效果同时也受生物质炭制备原料、热裂解炭化条件和作物类型的影响,因此不同类型生物质炭表面可溶性组分的生物活性及其对不同作物生长的影响机制仍需进一步研究和探索。
