不同肉质型桃果实成熟过程中乙烯生物合成相关基因的表达差异
2020-07-28陈星星张斌斌郭绍雷马瑞娟姜卫兵
陈星星,张斌斌,郭绍雷,,马瑞娟,姜卫兵*
(1.南京农业大学园艺学院,江苏 南京210095;2.江苏省农业科学院果树研究所/江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
果实成熟是一个复杂的、基因程序化的过程,涉及多种生物代谢途径,可影响果实的颜色、质地、风味,并调控果实软化[1-2]。桃(Prunuspersica)属于典型的呼吸跃变型果实,在果实成熟过程中果实质地发生变化,硬度下降,呼吸强度迅速升高,伴随着乙烯的大量释放[3],相关基因的表达水平上调,果实发育迅速进入成熟阶段。
研究表明,桃果实的成熟过程与乙烯的产生密切相关,其成熟与衰老较难控制,贮藏期较短,属易腐烂果实类型[4-7]。乙烯释放量的变化与其生物合成途径的关键酶1-氨基环丙烷羧酸合成酶(ACS)和1-氨基环丙烷羧酸氧化酶(ACO)活性有关[8-9],与乙烯合成相关的基因表达变化对果实颜色、风味、质地等特征的变化都有影响,进而决定果实的综合品质[10]。Mathooko等[11]指出PpACS1和PpACO1基因的表达在桃果实成熟期对乙烯生物合成的调节起关键作用。在乙烯生物合成过程中,由多基因家族编码的ACS和ACO表达水平受发育进程和环境因素的综合影响。有研究表明,不同成熟度的桃果实软化过程中乙烯合成相关基因编码种类和表达水平存在差异[12-13]。软溶质型桃‘雨花3号’果实在成熟度Ⅰ到成熟度Ⅴ过程中,ACS和ACO活性变化趋势与乙烯相似,且伴随乙烯的生成,其基因表达量逐渐增加;而硬溶质型桃‘加纳岩’在成熟过程中,ACS表达趋势相对平缓,ACO活性一直较低,其基因的表达在成熟前期几乎检测不到,成熟度Ⅲ时开始有较弱的表达,之后表达量缓慢上升[12]。
本研究以4种不同肉质类型的桃果实为材料,采用气相色谱技术研究3个成熟度桃果实乙烯释放的规律,并对乙烯生物合成相关基因的表达进行分析,结合果实硬度和呼吸速率的变化,以期明确桃果实成熟过程中呼吸和乙烯的变化规律与成熟度的关系,阐明导致成熟度差异的内在因素,进而为深入研究果实软化机制及准确判断成熟度、适时采收提供理论依据。
1 材料与方法
1.1 试验材料与处理
供试材料为4种肉质类型的12个桃品种(表1),果实均采自国家果树种质南京桃资源圃。树体健壮,树形为三主枝自然开心形,每个品种3株,常规栽培措施管理。
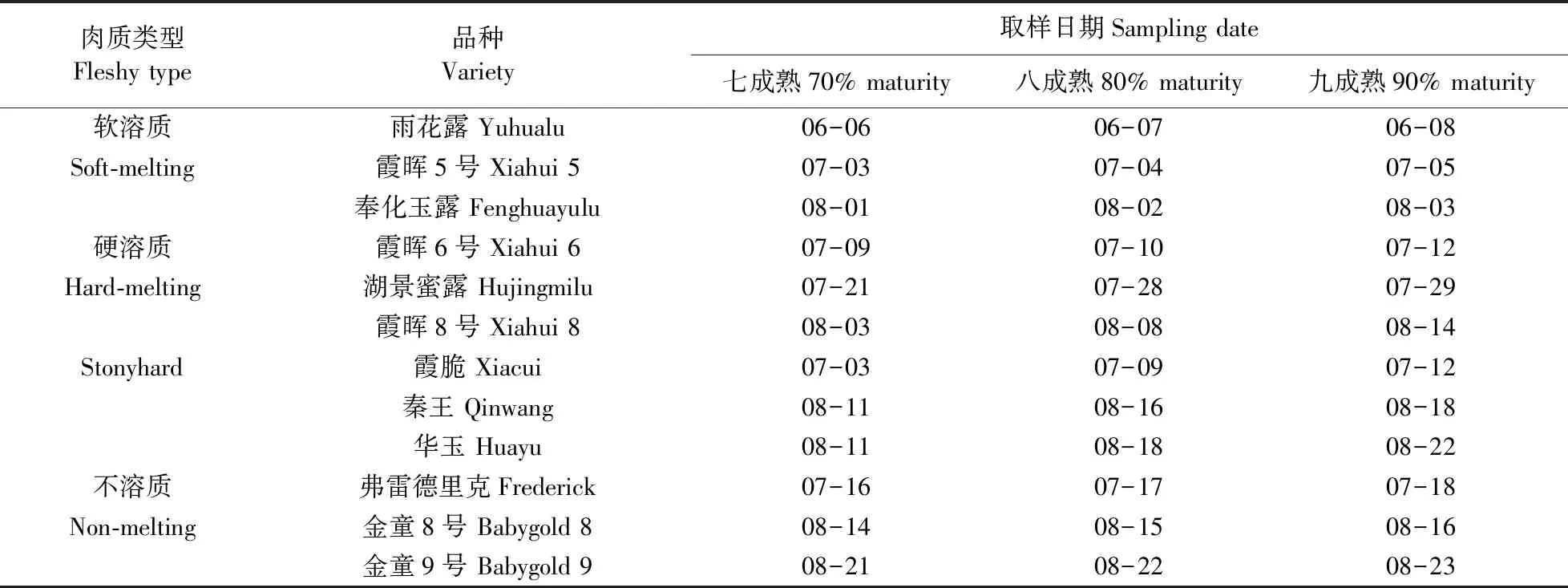
表1 不同肉质桃3个成熟度果实的取样日期Table 1 The sampling dates of fruits with three maturity degrees of different fleshy peaches
于2018年按各品种的成熟期(表1)采收树冠中部以上外围光照条件良好的果实,采后迅速带回实验室,根据不同的成熟度(七成熟:果实底色为绿色,已充分发育,但茸毛厚、多;八成熟:底色变淡,发白或黄,果面丰满,毛茸稍稀,果实仍较硬;九成熟:果皮呈乳白色或浅黄色,弹性增大,有芳香气味,果面着色充分)随机选留大小均匀、无病虫害的果实各15个,每5个果实为1个重复,进行相关指标试验测定。桃果实去皮后切碎,放入液氮速冻,置于-80 ℃冰箱中备用。
1.2 试验方法
1.2.1 果实呼吸速率的测定采用气体分析仪(PBI Dansensor,丹麦)测定果实呼吸速率,以25 ℃下单位质量的桃果实在单位时间内CO2的释放量表示果实的呼吸速率。将果实称量并记录其质量(m),在25 ℃条件下置于4.5 L的密闭容器中1 h,连接仪器测量CO2含量(C),最后用改进排水法[13]测定每组果实的体积(V)。呼吸速率计算公式为:
呼吸速率(mg·kg-1·h-1)=103×(4.5-V)×C× 1.96/m。
式中:V为果实体积(L);C为CO2体积分数(%);1.96为CO2密度(mg·mL-1);m为桃果实质量(kg)。
1.2.2 果实乙烯释放速率与硬度的测定将果实置于密闭容器中,2 h后抽取气体测定乙烯释放量。以单位时间内单位质量果实的乙烯释放量表示桃果实的乙烯释放速率。乙烯测定所用仪器为GC-7890A型气相色谱仪(Agilent),色谱条件:FID检测器,Hp-Plot q 毛细管柱(20 m×0.53 mm×20 μm),分流比10,载He,柱温40 ℃,检测器温度220 ℃,进样量1 mL。以鲜果测定,重复3次。
在桃果实缝合线对侧中部用TA.XT.Plus型质构仪(探头直径8 mm,测试深度5 mm,贯入速率1 mm·s-1)测定果实的去皮硬度(果肉硬度)。取2个点的平均值作为每个果实的去皮硬度。
1.2.3 总RNA提取及反转录采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(TIANGEN)提取样品总RNA,通过PrimeScriptTM反转录试剂盒(TaKaRa)合成第1链cDNA作为RT-qPCR模板。
1.2.4 相关基因表达分析根据桃已登录序列采用Primer Premier 5.0设计并结合前人研究[14],通过预试验,选定5个ACS和1个ACO基因的特异性引物序列(表2),引物由TSINGKE生物公司合成。荧光染料使用SYBR Green(TaKaRa)。采用RT-qPCR技术,研究乙烯生物合成相关基因在不同肉质类型3个成熟度桃果实上的表达特性,以桃TEF2(PpTEF2)为内参基因,用ABI7500的实时定量PCR仪进行荧光定量分析。以反转录合成的cDNA为模板进行RT-qPCR检测,扩增体系(20 μL):2 μL cDNA,上、下游引物各0.8 μL,10 μL反应MIX,0.4 μL ROX Reference DyeⅡ,6 μL ddH2O。反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,共40个循环。3次重复。
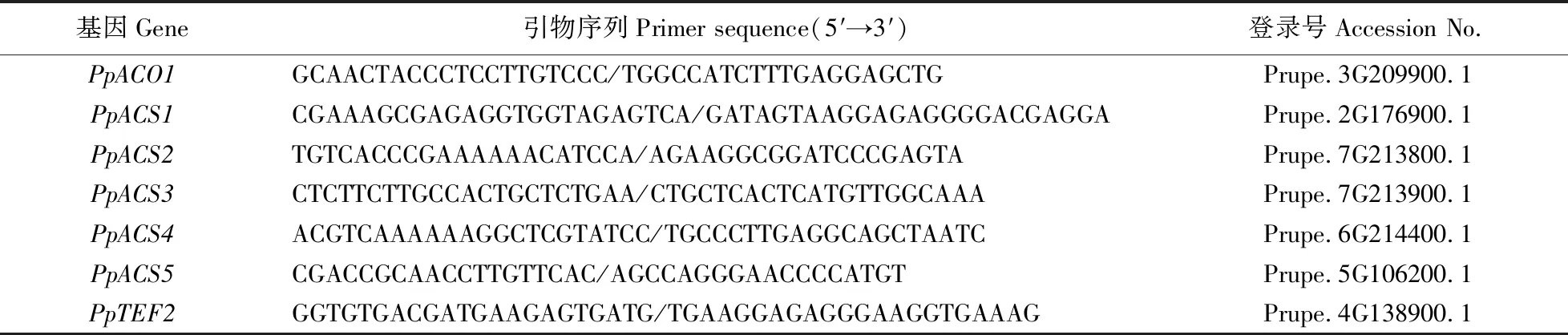
表2 RT-qPCR所用引物序列Table 2 Sequences of the primers used for RT-qPCR
1.3 数据处理
分别采用Excel 2013和SPSS 23.0软件进行数据处理和统计分析,基因相对表达量采用 2-ΔΔCT法[15]计算,差异显著性分析用邓肯氏新复极差法。
2 结果与分析
2.1 不同肉质型桃果实成熟过程中呼吸速率的变化
由图1可见:不溶质型桃果实的呼吸速率高于其他溶质型。软溶质型‘雨花露’七、八、九成熟果实呼吸速率差异不显著,‘奉化玉露’九成熟果实的呼吸速率最高。硬溶质型‘霞晖6号’九成熟果实呼吸速率显著高于七、八成熟,‘湖景蜜露’七成熟果实呼吸速率显著高于八、九成熟,‘霞晖8号’八成熟果实呼吸速率显著高于七成熟和九成熟。不同成熟度的Stonyhard型桃果实的呼吸速率整体低于其他肉质型,‘霞脆’和‘华玉’八成熟果实的呼吸速率低于七、九成熟,‘秦王’不同成熟度果实的呼吸速率无显著差异。不溶质型‘弗雷德里克’和‘金童9号’九成熟果实的呼吸速率显著高于七、八成熟,‘金童8号’七成熟果实的呼吸速率显著高于八、九成熟,八成熟果实的呼吸速率最低。可见同一肉质不同品种桃不同成熟度果实的呼吸速率不同,但整体来说,桃果实在成熟期间呼吸速率都比较高,呼吸代谢更快。
2.2 不同肉质型桃果实成熟过程中硬度的变化
随着果实成熟度的增加,不同肉质型桃果实硬度均呈显著下降的趋势(图2)。软溶质型桃果实硬度随着成熟度的增加下降幅度大且快,较其他溶质型而言,九成熟果实硬度最低;硬溶质型‘湖景蜜露’和‘霞晖8号’七成熟到八成熟果实硬度的下降幅度明显高于八成熟到九成熟的;随着成熟度的增加,Stonyhard型果实整体上保持着较高的硬度且八成熟到九成熟变化缓慢;不溶质型果实七、八、九成熟硬度的下降幅度无显著性差异,果实硬度随成熟度的增加匀速下降。
2.3 不同肉质型桃果实成熟过程中乙烯释放速率的变化
如图3所示:不同肉质型桃在不同成熟度果实中乙烯释放速率不同。随着成熟度的增加,软溶质、硬溶质、不溶质型果实乙烯释放速率逐渐升高。软溶质型‘雨花露’和‘奉化玉露’果实达到九成熟时乙烯释放迅速增加,分别达到25.211和21.634 μL·kg-1·h-1;随着果实成熟度的增加,硬溶质型果实的乙烯释放量明显低于软溶质和不溶质型;Stonyhard型果实乙烯释放速率始终处于较低的水平;不溶质型不同成熟度果实乙烯释放速率的增加幅度较软溶质型低,说明桃果实成熟时软化速度较软溶质慢且成熟期较长。
2.4 不同肉质型桃果实成熟过程中乙烯合成相关基因的表达分析
2.4.1ACS家族成员的基因表达随着桃果实成熟度的增加(从七成熟到九成熟),5个ACS基因中,PpACS1和PpACS4基因相对表达量逐渐积累且不同成熟度间差异显著,PpACS5基因相对表达量极低,而PpACS2、PpACS3基因的表达则未检测到。
由图4可见:随着成熟度的增加PpACS1基因表达水平差异较大。软溶质型‘雨花露’和‘霞晖5号’果实的PpACS1基因相对表达量从大到小表现为九成熟、七成熟、八成熟,‘奉化玉露’八、九成熟果实相对表达量显著高于七成熟;硬溶质型‘霞晖6号’和‘霞晖8号’果实的PpACS1基因相对表达量从大到小表现为八成熟、九成熟、七成熟,‘湖景蜜露’则为九成熟、八成熟、七成熟;PpACS1基因在Stonyhard型果实中表达水平极低;不溶质型PpACS1基因的相对表达量随果实成熟度的增加稳定升高,且九成熟果实的PpACS1基因相对表达量显著高于七成熟和八成熟。整体来看,不同肉质型桃九成熟果实PpACS1基因的相对表达量由大到小表现为:软溶质型、不溶质型、硬溶质型、Stonyhard型。
随着桃果实成熟度的增加,PpACS4基因表达上调(图5)。软溶质型3个品种基因的相对表达量由大到小依次为‘霞晖5号’‘奉化玉露’‘雨花露’,表明同一肉质型不同桃品种PpACS4基因的相对表达量不同。硬溶质型‘霞晖6号’和‘湖景蜜露’果实随着成熟度增加PpACS4基因表达逐渐上调,而‘霞晖8号’八成熟果实的PpACS4基因表达量显著高于七成熟和九成熟。Stonyhard型‘霞脆’果实随成熟度增加PpACS4基因表达上调,‘华玉’果实PpACS4基因表达量由大到小表现为八成熟、九成熟、七成熟,‘秦王’九成熟果实的PpACS4基因相对表达量显著高于八成熟和七成熟。不溶质型‘弗雷德里克’和‘金童9号’随着成熟度增加PpACS4基因表达逐渐上调,‘金童8号’八、九成熟果实的PpACS4基因表达无显著差异。由此可见,在不同肉质桃果实中,随着成熟度的增加,PpACS4基因在溶质型果实中具有较高的表达量,而在Stonyhard型果实中表达量较低。
2.4.2PpACO1基因表达如图6所示:不同溶质型不同成熟度果实的PpACO1基因相对表达量不同。随着成熟度的增加,软溶质型‘雨花露’七成熟果实的PpACO1基因表达量显著高于八、九成熟,且八成熟果实的PpACO1基因表达量最低,‘奉化玉露’八成熟果实PpACO1基因表达量显著高于七、九成熟,说明同一肉质不同品种间PpACO1基因表达水平差异较大。硬溶质型八成熟果实的PpACO1基因表达量均高于七、九成熟。Stonyhard型‘霞脆’和‘华玉’八成熟果实PpACO1基因的相对表达量显著高于七成熟;‘秦王’七、八成熟的PpACO1基因表达量无显著差异,且Stonyhard型在4种肉质型桃中PpACO1基因表达水平最低。对不溶质型果实而言,‘弗雷德里克’和‘金童9号’PpACO1基因相对表达量随着成熟度的增加基因表达上调;‘金童8号’果实PpACO1基因表达由大到小依次为八成熟、七成熟、九成熟。
3 讨论
呼吸跃变型果实的乙烯生物合成在发育成熟过程中存在2个不同的调节系统:系统Ⅰ和系统Ⅱ。系统Ⅰ产生的乙烯主要是调节正常生长、发育和胁迫反应;系统Ⅱ主要是自我催化反应,负责花的凋亡和果实的成熟[16-17]。果实成熟被认为是发生在果实发育后期一系列复杂生理生化反应的过程[18],不同树种以及同一树种不同品种(基因型)间的果实成熟机制存在明显差异。因此,进一步探讨不同肉质不同品种果实成熟差异的生理和分子机制,对桃果实成熟的品质调控具有重要意义。本研究结果表明,PpACS1、PpACS4、PpACO1基因在不同肉质型桃果实乙烯生物合成中起关键作用,是控制桃果实成熟软化的主要因子,这与前人研究结果一致[11-12,19-20]。溶质型(软溶质、硬溶质、不溶质)桃果实在成熟过程中,九成熟果实的基因表达丰度最高。
呼吸跃变型果实成熟后期需要系统Ⅱ释放大量的乙烯,从而促进果实成熟软化[17]。本试验中,不同成熟度(七、八、九成熟)不同肉质型桃果实的乙烯生成能力有显著差异,2个关键酶ACS和ACO相关基因的转录水平对乙烯生物合成的调节至关重要。本研究中溶质型桃表现出明显的呼吸跃变果实所具有的特征:呼吸速率随成熟度的增加升高,乙烯释放量明显升高,果实硬度迅速下降;而Stonyhard型七、八、九成熟果实的呼吸速率相对平缓,乙烯释放量极低,硬度随成熟度的增加保持较高的水平,均高于溶质型桃,表明Stonyhard型桃果实成熟期间由于缺少乙烯的释放,导致果实成熟无法正常软化。不同肉质型桃果实在成熟阶段乙烯释放量的高低与PpACS1基因的转录水平相关。RT-qPCR结果显示,不同肉质型桃果实PpACS1基因表达水平与乙烯释放规律表现出高度的一致性,PpACS1基因在溶质型桃果实中表现出较高的表达丰度,导致溶质型桃成熟期间果实快速软化;而Stonyhard型果实表达水平极低,这与前人研究结果一致[11,19],表明PpACS1基因表达受抑制是Stonyhard型果实乙烯合成受阻、果实无法正常软化的主要原因。
桃果实软化启动阶段及软化早期,果实乙烯含量增加缓慢,乙烯的大量释放发生在果实成熟的软化后期[5],是果实成熟、衰老的结果,也反过来加速衰老及软化进程,且溶质型桃果实硬度迅速下降先于乙烯高峰的出现[21]。本研究中软溶质和不溶质型七、八、九成熟果实硬度迅速下降,且九成熟果实乙烯释放量最高,这与陆胜民等[22]对梅果实的研究结果一致。硬溶质型九成熟果实硬度显著高于软溶质型,但同一时期的乙烯释放量明显低于软溶质型,表明硬溶质型桃果实的成熟软化速度明显低于软溶质型,更有利于采后贮藏和延长货架期,这与阚娟等[23]的研究结果一致。溶质型桃九成熟果实的乙烯释放量最高,且PpACS1、PpACS4基因的表达水平随成熟度的增加显著上调;不同肉质型桃PpACO1基因表达水平随果实成熟度的增加有所差异,表明与乙烯生物合成的相关基因(PpACS1、PpACS4、PpACO1)共同调控果实的成熟及乙烯释放。杨勇[3]、潘磊[14]和姜航等[24]在研究桃果实贮藏期间基因表达变化中均未检测到PpACS2和PpACS3基因的表达,本研究也未检测到,同时在果实成熟期间PpACS5基因表达量也极低,可能这些基因的表达发生在果实发育期,这有待于进一步研究。
