71例小婴儿B族链球菌败血症早发型和晚发型临床分析
2020-07-27彭海波詹媛丽吴丽娟梁小琴
彭海波 詹媛丽 吴丽娟 刘 方 黄 艳 梁小琴 陈 幽
广东省深圳市宝安区妇幼保健院1.新生儿科,2.检验科(广东深圳 518106)
B族链球菌(group B streptococcus,GBS)也称为无乳链球菌,常寄生于妊娠期妇女的下消化道和泌尿生殖道,在婴儿鼻咽、直肠及皮肤定植可持续数周至数月,是新生儿及小婴儿败血症的主要病原菌之一[1]。根据发病年龄,GBS败血症可分为早发型(7天内)和晚发型(7~89天)[2]。早发型多为围生期感染;晚发型可通过母乳喂养、环境等感染[3]。国内小婴儿GBS败血症的报道不多,且样本量较小,关于早发型与晚发型临床特点及相关炎性指标的对比研究尚未见报道。本研究通过比较小婴儿早发型和晚发型GBS败血症的临床和实验室炎性指标的差异,为临床采取更有针对性的防控措施提供科学依据。
1 对象与方法
1.1 研究对象
收集2011年1月1日至2019年12月31日入住广东省深圳市宝安区妇幼保健院新生儿科及儿科的败血症小婴儿。研究对象入选标准:①年龄<90天;②血培养GBS阳性;③排除合并遗传代谢性疾病或免疫缺陷性疾病者。根据发病时间,将 GBS败血症分为早发型(7 d内)和晚发型(7~89 d),根据分型将病例分为早发型 GBS败血症组(早发组)和晚发型 GBS败血症组(晚发组)。
1.2 方法
1.2.1 诊断标准 新生儿败血症、化脓性脑膜炎参考《实用新生儿学》第五版[4];儿童败血症及化脓性脑膜炎诊断标准参考《诸福棠实用儿科学》第八版[5]。
1.2.2 标本采集原则 血培养:入院后1小时内使用抗生素前留取1.5~2 mL全血标本,采用美国 BD FX400全自动培养仪进行培养,阳性标本行药物敏感试验。腰椎穿刺术指征[4]:①血培养阳性;②有临床表现且非特异性感染指标≥2项阳性;③抗感染治疗效果不佳。
1.2.3 资料收集 采用回顾性研究方法,收集信息包括一般资料:母产前情况、分娩方式,性别、胎龄、出生体质量、临床症状及体征、合并症、预后;实验室检查:感染相关指标、血培养、脑脊液检查结果。根据发病时间将实验室检测包括全血细胞计数、超敏C反应蛋白(high-sensitivity C reactive protein,hsCRP)等记为,检测1:发病 0~0.5天(入院1小时内留取标本,如发病12小时内未入院,第1次结果为缺失值);检测2:发病0.5~1.5天;检测3:发病 1.5~3天;检测4:发病 4~7天。
1.2.4 实验室指标异常相关定义 新生儿期白细胞计数(WBC)异常为WBC减少(<5×109/L)或WBC增多(≤3日龄,WBC ≥30×109/L;>3天,WBC ≥20×109/L);血小板计数(PLT)减少为PLT<150×109/L[4]。婴儿期WBC异常为WBC减少(<4×109/L)或WBC增多(≥12×109/L);PLT减少为<100×109/L。HsCRP升高为 ≥8 mg/L[6]。母WBC增高定义为WBC≥15×109/L[7]。
1.3 统计学分析
采用 SPSS 21.0软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以百分比表示,组间比较采用χ2或校正χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
血培养确诊GBS败血症共71例,其中早发组43例、晚发组28例;新生儿64例、婴儿7例。早发组出生胎龄27.86~41.71周,出生体质量 900~3 900 g,中位发病年龄5.0(0.5~8.0)h。晚发组出生胎龄33.43~42.00周,出生体质量 2 000~3 850g,中位发病年龄17.0(12.0~30.3)d。早发组及晚发组各有1例发病后 12~20h入院,余均 12h内入院。早发组的初产和早产发生率均高于晚发组,差异有统计学意义(P<0.05)。见表 1。
2.2 母亲围产期情况
早发组胎膜早破以及胎膜早破≥18小时的发生率均高于晚发组,早发组母亲年龄小于晚发组,差异有统计学意义(P<0.05)。见表 2。
2.3 临床表现
早发组气促/呻吟、肺炎发生率均高于晚发组,发热发生率低于晚发组,差异有统计学意义(P<0.05)。见表 3。
2.4 实验室检查结果
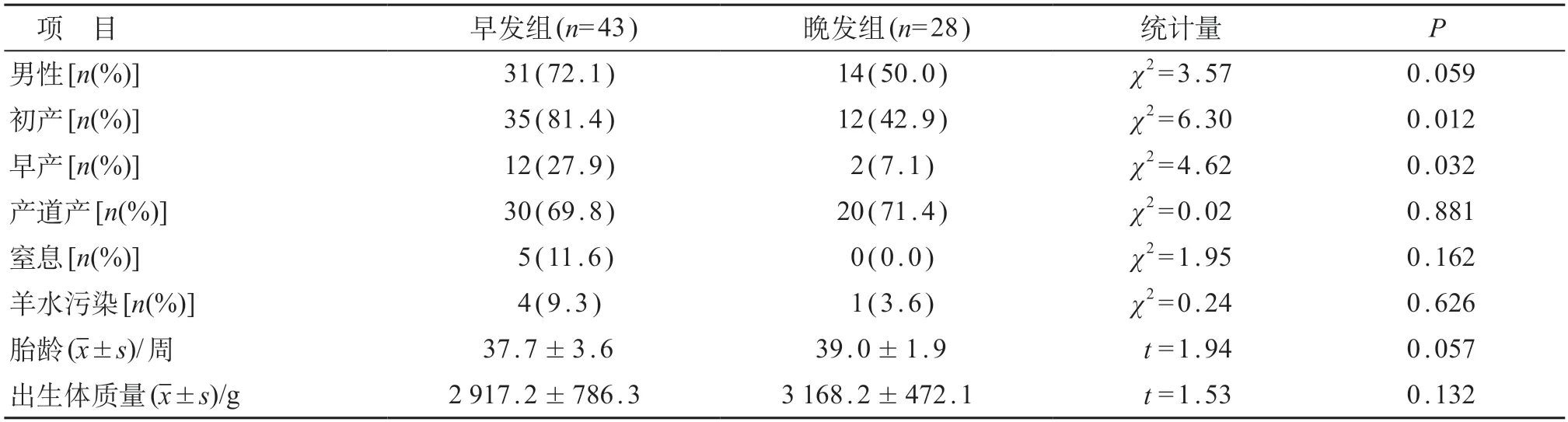
表1 两组婴儿一般情况比较

表2 两组婴儿母亲围产期情况比较
与晚发组相比,早发组住院期间达到最低WBC时间较短,PLT减少比例较高,PLT最低水平较低,差异有统计学意义(P<0.05)。见表4。
根据发病时间,对相关感染指标(WBC异常、hsCRP增高、PLT减少)进行4次检测,结果显示,检测1和2,除PLT减少两组间差异有统计学意义(χ2=4.79~6.20,P均<0.05),其余指标两组间差异均无统计学意义(χ2=0.00~2.57,Z=1.01~1.54,P均>0.05)。检测3和4,除检测3 PLT减少及检测4 hsCRP增高发生率差异有统计学意义(χ2=3.88~5.78,P均<0.05),其余指标两组间差异均无统计学意义(χ2=0.09~2.03,Z=0.89~1.87,P均>0.05)。
63例行腰椎穿刺术,8例未做(均为早发组病例,3例系超低出生体重儿因病情危重,5例因家属拒绝)。早发组和晚发组之间脑脊液常规、生化以及脑脊液培养阳性率差异均无统计学意义(P>0.05)。见表4。
2.5 药物敏感试验
所有血及脑脊液培养阳性标本均进行了药物敏感试验,结果显示所有菌株对青霉素、头孢曲松、万古霉素敏感率均为 100%,对红霉素、克林霉素、左氧氟沙星的敏感率分别为 9.9%、16.9%、78.9%。

表3 两组婴儿临床表现及合并症比较 [n(%)]
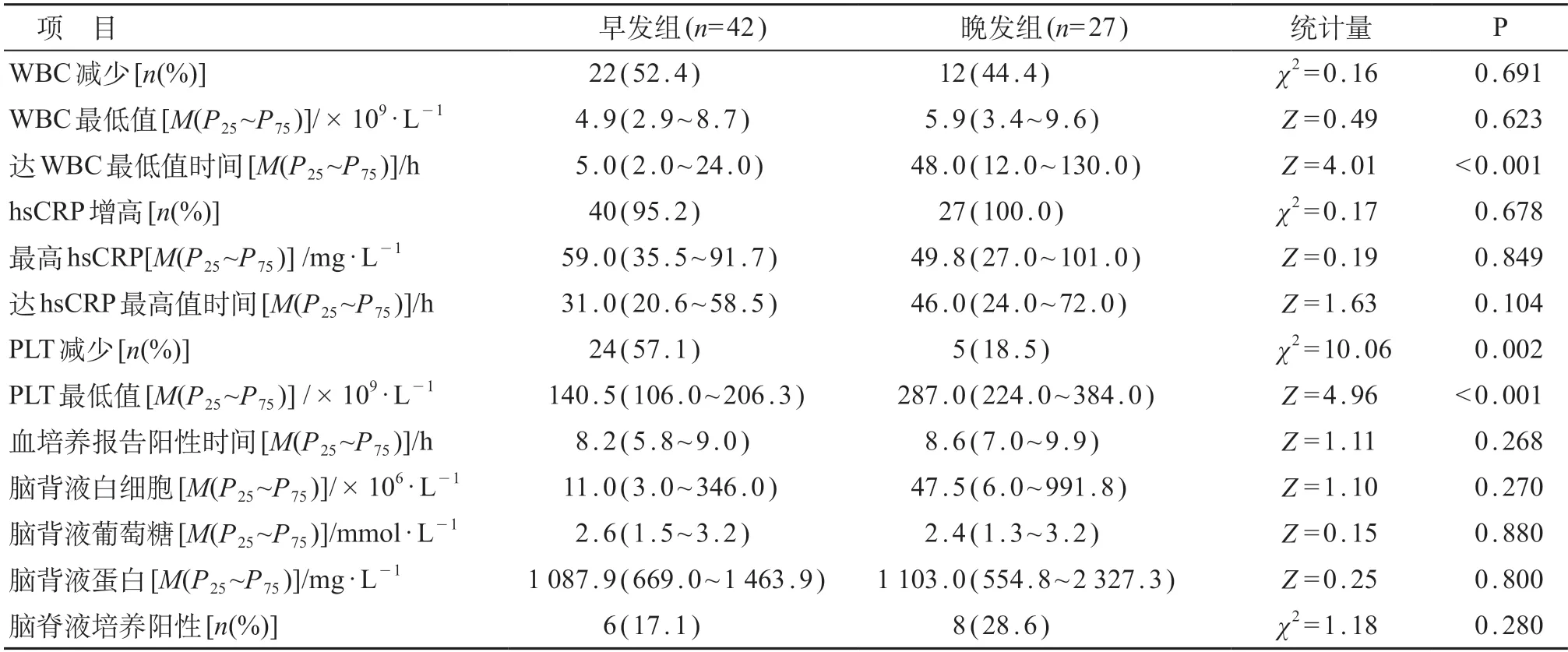
表4 两组住院期间实验室检查结果比较
2.6 治疗和转归
71例病例中,单用青霉素治疗 19例(26.8%);单用头孢菌素 5例(7.0%);青霉素联合头孢菌素 27例(38.0%);青霉素联合万古霉素 7例(9.9%);6例(8.5%)入院感染性休克,使用青霉素联合美罗培南治疗,培养回报后停用美罗培南;万古霉素联合头孢菌素 4例(5.6%);单用万古霉素、美罗培南各 1例;1例合并化脓性脑膜炎使用青霉素联合万古霉素治疗,后改利奈唑胺。
早发组治愈 36例,好转出院 3例(好转出院病例出院前复查血培养阴性、感染指标均已正常,疗程未足家长签字出院,出院后门诊或电话随访均无异常),死亡 4例,死亡率 9.3%。死亡病例均为早产儿,其中 3例为 2011年出生,三胞胎,胎龄 27+6周,出生体质量分别为 980、900、930 g,3例入院胸片均提示肺部斑片影、无毛玻璃样改变,均合并感染性休克、弥散性血管内凝血,其中两例合并肺出血,分别于生后 1、2、3天死亡;另一例为 2016年出生,胎龄 33+4周,出生体质量 2 300 g,并发肺炎、脑膜炎、多脏器功能障碍综合征、毛细血管渗漏综合征,住院后 3天死亡。晚发组 28例,治愈 27例,好转出院 1例,无死亡病例。
早发组的中位住院时间为14.0(9.0~21.0)天,晚发组为15.0(12.0~15.3)天,两组间差异无统计学意义(Z=1.21,P=0.225)。早发组脑室扩大发生率为5.1%,晚发组为19.2%;早发组病死率为9.3%,晚发组为0,差异均无统计学意义(χ2=1.93、1.29,P均>0.05)
3 讨论
GBS常寄生于妊娠期妇女的下消化道和泌尿生殖道中,可通过垂直传播、母乳、环境等途径感染小婴儿。相关研究报道,2017年 5月-2018年 6月期间,常规筛查妊娠晚期孕妇生殖道 GBS 17 920例,阳性率为 14.08%(2 719/17 920)[8]。本研究中早发型GBS败血症病例数明显多于晚发型,与国内报道[9]及英国调查结果[10]类似,但与美国[11]、意大利[12]、日本[13]等国家近年的结果不一致,考虑部分国家常规实施产前 GBS筛查与产时抗生素预防策略,而本院 3年前未常规开展。
孕妇生殖道 GBS定植是胎膜早破及早产的诱因[14],而早产、胎膜早破是早发型 GBS感染的危险因素[15]。本研究中 71例 GBS败血症,早产儿 14例,其中 12例为早发型,说明早产儿更容易发生早发型GBS败血症。早发组胎膜早破发生率高于晚发组,与国内报道一致[2]。目前孕妇 GBS筛查时间点为妊娠35~37周,多数早产的孕妇尚未行 GBS筛查,因此,有早产可能的孕妇应及时筛查 GBS,为早产儿生后治疗提供参考依据。部分学者认为,产道分娩是新生儿GBS定植的危险因素[16],但本研究早发组及晚发组病例的分娩方式无差异,与国内外大多数文献报道类似[17-18]。早发组母亲初产率高,且母亲年龄低于晚发组。相关研究认为,母亲年龄<20岁是早发型 GBS败血症的危险因素,原因不详,可能与低年龄母亲缺乏抗 GBS荚膜多糖抗体有关[19]。
GBS败血症的临床表现多为非特异性,包括少吃少哭少动、反应差、体温异常(发热或低体温)、呼吸困难、抽搐等。本研究中早发型病例均在 72 h内起病,约 70% 以气促或呻吟为首发表现,且大部分经胸片证实存在肺部炎症,与暨南大学报道一致[20]。原因考虑早发型感染常为垂直传播,含 GBS的阴道分泌物或羊水经口腔进入呼吸道繁殖、释放毒素,引发肺炎[21]。对于母亲 GBS筛查阳性、生后 3天内的新生儿,一旦出现呼吸困难,应高度警惕早发型 GBS败血症。约 90% 的晚发型病例以发热起病,合并脑膜炎的比例也高于早发型。母亲 GBS筛查阳性、生后 7~89天的婴儿,若出现发热、反应差、吃奶差、惊厥等症状,应高度警惕晚发型 GBS败血症。
国内报道,白细胞低是早发型 GBS败血症的一大特点,与病情严重程度及预后相关,尤其 WBC<2×109/L容易出现预后不良[22]。本研究中,无论早发还是晚发型 GBS败血症,均有白细胞减少;而WBC <2×109/L 7例,早发组 4例,晚发组 3例,均治愈。败血症所致血小板减少的特点为迅速降低但恢复缓慢,血小板减少的机制包括血小板生成和消耗两方面。新生儿败血症时血小板生成速度增快(血小板生成素浓度以及网织血小板比例增高),但感染引发的弥散性血管内凝血、细菌毒素对血小板的破坏等导致血小板的消耗速度增快,且消耗速度大于生成速度,从而发生血小板减少[23]。C反应蛋白在感染后 6~8 h升高,24 h达到顶峰,是诊断 GBS败血症的常用非特异性指标。由于 hsCRP和血常规可共管检测,为减少医源性失血,本院未常规行 CRP检查;降钙素原费用高,需血量多,且 2015年前未常规行降钙素原检测,缺失值多,故 CRP和降钙素原均未纳入统计。本研究中 hsCRP增高比例为 97.10%,早发组达到最高 hsCRP值 中位时间为 31 h,晚发组 46 h,提示在应用敏感抗生素情况下,仍有部分病例 hsCRP继续增高,需结合临床表现及药敏试验综合判断抗生素治疗的有效性。通过对入院后 1小时内炎性指标比较发现,与晚发型相比,早发型在 hsCRP未升高时,多数已出现血小板减少。母亲 GBS阳性或不详的新生儿,尤其是早产儿、有胎膜早破时,一旦出现气促或呻吟,血小板或白细胞减少,应高度警惕早发型 GBS败血症可能,在血培养未回报前,考虑尽早使用抗生素治疗。本研究所有菌株对青霉素、头孢曲松、万古霉素等抗生素均敏感,红霉素、克林霉素耐药率高于国外报道[11-12],考虑与我院对有感染高危风险孕妇积极采用红霉素预防治疗从而产生耐药有关。因此,确诊病例,可首选青霉素治疗[24]。
GBS败血症病死率高,美国研究显示早发型病死率为 6.90%,其中早产儿病死率高达 19.1%,是足月儿的 9倍;晚发型病死率 5.40%,合并脑膜炎是晚发型死亡的高危因素[11]。本研究 GBS败血症共死亡4例,均为早产儿、早发型,总病死率为 5.71%,早发型病死率 9.09%,其中 3例为三胞胎,超低出生体质量儿;晚发型无死亡病例,但脑室扩大发生率较高。Meta分析发现,32% GBS脑膜炎在 18月龄时存在神经系统发育损害,18% 为中重度损害,严重影响儿童生活质量[25]。国内有学者认为,GBS化脓性脑膜炎病情危重,存活者可发生神经系统后遗症,需尽早使用合适抗生素,必要时联合用药[26]。因此,确诊 GBS败血症的小婴儿,行脑脊液检查明确有无颅内感染,有利于指导治疗及改善预后。
本研究是国内首次对小婴儿早发型和晚发型GBS败血症临床特点及相关炎症指标对照分析的研究,时间跨度长达 9年,纳入的病例数也较多。本单位自 2017年起已开展孕妇 GBS的普筛及产时抗菌素干预预防新生儿 GBS感染,今后,本研究组将继续进行GBS感染的相关研究,包括产时抗菌素干预的效果及GBS血清型分析,为预防及治疗小婴儿 GBS感染提供更多依据。
