2型糖尿病患者血管内皮细胞功能衰老对血管病变的影响
2020-07-27吉向军李淑霞葛淑芝李华君
张 颖,吉向军,李淑霞,葛淑芝,李华君
糖尿病的并发症众多,其中,最普遍的便是心血管疾病[1-2],且已经成为出现血管病变患者的主要致残及致死因素[3]。目前,有研究提出血管内皮细胞(VEC)可以在此类病变中起到关键性作用[4],在糖尿病血管衰老及并发症、动脉硬化的发生发展起着关键性作用的晚期糖基化终产物(AGEs)[5]是由葡萄糖等其他还原糖与脂类、蛋白质及核酸经非酶在发生促糖基化反应之后的产物[6],而AGEs导致的血管病变,在早期的主要生理、病理基础是VEC活化而导致的血管通透性升高[7]。血管通透性增高是糖尿病所导致的血管病变中的一个重要事件,VEC存在于血管壁与血液的交界处,其可以为组织间物质与血液交换提供平台,且其中的黏附链接(AJs)也会与循环细胞一同参与对血管壁通透性的调节。功能正常且完整的VEC在维持血管通透性中具有重要意义,因此所有造成VEC发生异常的因素,都会导致血管通透性发生异常[8]。本研究探讨VEC功能衰老对2型糖尿病血管病变的影响。现报告如下。
1 资料与方法
1.1临床资料 选取2017年5月—2018年5月我院收治的老年2型糖尿病(老年糖尿病组)30例,中青年2型糖尿病(中青年糖尿病组)30例,选择同期于我院门诊进行体检的老年健康志愿者(老年健康组)30例,中青年健康志愿者(中青年健康组)30例。糖尿病的诊断标准参照2013年中华医学会糖尿病分会制定的《中国2型糖尿病防治指南》[9]。纳入标准:老年糖尿病组年龄60~72岁,中青年糖尿病组年龄30~59岁;糖尿病病程均>5年。老年健康组年龄60~72岁,中青年健康组为30~59岁;体检结果均显示身体健康无疾病发生。排除标准:不明确或不同意本课题研究者;严重肝肾功能不全者。
1.2检测方法 所有入组患者均在入组后次日晨7点,抽取空腹外周静脉血5 ml,3000 r/min,离心10~15 min后取血清,于-80℃冰箱保存待测。采用酶联免疫吸附试验(ELISA)检测血清AGEs、环氧合酶-2(COX-2)、基质金属蛋白酶-9(MMP-9)及血管内皮钙黏蛋白(VE-cadherin)指标,试剂盒购于美国RD公司,严格按试剂盒说明书步骤操作。

2 结果
2.1临床资料 4组性别、年龄、高密度脂蛋白胆固醇(HDL-C)、体重指数(BMI)比较差异无统计学意义(P>0.05);老年糖尿病组、中青年糖尿病组、老年健康组低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三酯(TG)、糖化血红蛋白(HbA1c)、空腹血糖(FPG)、空腹血清胰岛素(FINS)、稳态模型胰岛素抵抗指数(HOMA-IR)水平均高于中青年健康组,差异有统计学意义(P<0.05),而老年糖尿病组、中青年糖尿病组、老年健康组组间比较差异无统计学意义(P>0.05)。见表1。
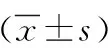
表1 4组临床资料比较
2.2血清中AGEs、COX-2、VE-cadherin及MMP-9水平 老年糖尿病组和中青年糖尿病组AGEs水平高于老年和中青年健康组,差异有统计学意义(P<0.05)。老年糖尿病组和中青年糖尿病组、老年健康组和中青年健康组AGEs水平组间比较差异无统计学意义(P>0.05)。老年糖尿病组和老年健康组COX-2水平高于中青年糖尿病组和中青年健康组,差异具有统计学意义(P<0.05)。老年糖尿病组和中青年糖尿病组VE-cadherin及MMP-9水平均高于老年健康组和中青年健康组(P<0.05),但中青年糖尿病组和老年健康组VE-cadherin及MMP-9水平比较差异无统计学意义(P>0.05)。见表2。
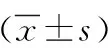
表2 4组血清中AGEs、COX-2、VE-cadherin及MMP-9的水平表达
3 讨论
AGEs在糖尿病血管衰老及并发症、动脉硬化的发生发展中起着关键性作用[10-11]。本研究通过观察不同病理机制,不同年龄之间的VEC功能的变化以及产生的影响,研究其在糖尿病患者发生血管病变中的作用。
有研究指出,即便是十分微小的内皮损伤,也能够导致血液中的血小板发生聚集以及黏附,这会引起血小板源性生长因子等细胞因子产生过多,从而使得结缔组织基质成分等受到影响,也就促使动脉粥样硬化(AS)的发生进展[12]。提示血管内皮损伤会刺激AGEs产生,且诱导内皮细胞组织因子以及黏附分子的表达增加等会促进AS的发生进展。
血管通透性增高是糖尿病所导致的血管病变中的一个重要事件,通过周围细胞以及底层的平滑肌细胞来影响血管直径及张力的变化是VEC的主要作用,可以调节人体全部组织灌注以及血流量,且其表面可以分泌大量分子来调节人体凝血和血小板活化功能,以此做到防止血管损伤后形成血栓并维持机体血流量[13]。
年龄增长是许多心血管疾病发生的危险因素,年龄越大,越容易出现内膜增厚、管腔扩大和血管硬化[14-15]。在很早的研究中,衰老的VEC便在AS斑块中发现,且发现了急性诱导VEC损伤的缺血再灌注损伤与AS的出现有着密切联系。
炎性细胞因子的分泌、一氧化碳合酶(eNOS)解耦联、活性氧(ROS)的产生,以及DNA损伤和端粒功能障碍均为VEC衰老的特征,而这些会导致心血管系统结构及功能出现障碍。ROS会因为VEC的衰老而加速生成,也就更加容易造成脂质氧化以及内皮功能受到损伤,从而也就引起了大量的脂质进入到内皮下,大量泡沫细胞在血管壁中形成,这些机制是动脉斑块发生的基础,且其又导致引发内皮功能障碍,血管的促凝机制以及抗凝机制平衡发生失调,内膜中形成的微血栓将不易溶解,这会加速斑块形成及发展[16]。
在机体处于老年且具有疾病的状态下,VEC的功能障碍主要是VEC依赖性扩张受到损伤,此机制可能与VEC的功能以及结构的改变或VEC产生的活性物质释放有着相互影响机制。COX是产生于花生四烯酸代谢中的限速酶,COX同工酶分为COX-1及COX-2两种,其基因编码不同,作用不同。COX-1是一种具有固有保护作用的看家酶,可以维持人体必需的生理功能,而COX-2则由血管损伤后或细胞因子刺激而诱导表达。目前,有研究发现,在大多数细胞类型及正常组织中COX-2表达水平较低,然而增多的COX-2表达被发现在老年人组织中,提示COX-2会参与到机体的老龄化过程中,被释放而出的COX-2依赖性血管活性因子及其作用也许会致使衰老的VEC出现功能障碍。随着患者的年龄增长,COX-2的水平表达也会随之增加,而增加表达的COX-2会与年龄相关疾病的发展相关,包括糖尿病及AS[17]。本研究结果显示,老年糖尿病组、中青年糖尿病组、老年健康组LDL-C、TC、TG、HbA1c、FPG、FINS、HOMA-IR水平均高于中青年健康组,老年和中青年糖尿病组AGEs、VE-cadherin、MMP-9水平高于老年和中青年健康组,老年糖尿病组和老年健康组COX-2水平高于中青年糖尿病组和中青年健康组。
血管病变在老年糖尿病患者中早期发生的便是血管通透性异常,VEC在血管通透性的出现中具有重要影响作用,VEC的衰老会使得老年糖尿病患者更大概率发生包括AS在内的血管病变[18],通过本课题的研究我们发现并证实了此观点,因此对老龄化及糖尿病同时存在的患者,早期对VEC的功能进行改善可能对其发生血管病变起到预防作用。是防治老年糖尿病患者出现血管病变的直接有效方法。
