长链非编码RNA SNHG3在食管鳞状细胞癌中的表达及其对ECA-109细胞迁移和侵袭的影响*
2020-07-27郭晓锋朱曼许广辉王文光郝安林
郭晓锋 朱曼 许广辉 王文光 郝安林
食管癌(esophagealcarcinoma,ESCA)是一种包括食管腺癌(esophageal adenocarcinoma,EAC)和食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)两种主要亚型的高度恶性肿瘤[1-2]。ESCC 起源于食管上皮细胞,是食管癌的主要亚型之一,也是世界范围内与癌症相关死亡的主要原因之一[2]。尽管医学诊疗技术不断进步,但由于缺乏特异性症状和有效的早期诊断方法,50%左右的ESCC患者确诊时已处于晚期阶段,且5年生存率仅为15%~25%[3]。因此,迫切需要进一步了解ESCC的发展机制,以探索新的诊疗靶点。
长链非编码RNA(long non-coding RNA,lncRNA)是一类转录本长度大于200个碱基且不具有编码蛋白质功能的RNA[4]。先前的研究表明,lncRNA 通过不同的作用机制,在机体的几乎所有生理和病理过程中都发挥着关键的作用[5-6]。Fei等[7]的研究揭示了lncRNA SNHG3通过将转录因子EZH2募集到KLF2和p21 启动子区,在表观遗传学层面抑制KLF2和p21的表达,从而促进胶质瘤的恶性进展。Zheng等[8]研究发现,在骨肉瘤中异常表达的lncRNA SNHG3 作为分子海绵,通过吸收miR-151a-3p 上调RAB22A的表达,从而促进骨肉瘤细胞的侵袭和迁移能力。当前,关于lncRNA SNHG3 在ESCC 中的作用机制和临床相关研究鲜见报道。在本研究中,我们旨在探究lncRNA SNHG3在ESCC中的表达情况及其对ECA-109细胞生物学功能的影响。
1 材料与方法
1.1 材料
收集安阳市肿瘤医院2011年6月到2014年6月收治的60例ESCC患者,平均年龄(63.13±7.26)岁,同时取相应的邻近正常组织作为癌旁组织组(距离原发灶>5 cm),所有组织标本迅速冷冻于液氮中,并保持在-80℃,以便后期分离核糖核酸和蛋白质。所有入选患者均未接受术前抗肿瘤治疗,包括放疗、化疗和手术,患者术后总生存期为手术后至ESCC相关疾病死亡时间。本研究获得安阳市肿瘤医院伦理委员会批准,并由每位患者提供书面知情同意书。
1.2 方法
1.2.1 细胞培养 人食管鳞状细胞癌细胞ECA-109和人正常食管上皮细胞株HEEC均购自美国典型培养物保藏中心(American type culture collection,ATCC)。所有细胞系用含有10%胎牛血清(setal bovine serum,FBS)的高糖DMEM进行培养。于37℃、5%CO2浓度和95%饱和湿度条件下的培养箱中进行培养,待细胞生长密度为90%左右时进行传代。
1.2.2 细胞转染 将处于对数生长期的ECA-109细胞消化并接种于6 孔板中,待细胞密度达80%~90%,使用lipofectmine 2000(Invitrogen 公司,USA)试剂盒按照说明进行转染。转染6h 之后换新鲜培养基,48h 后进行检测。阴性对照质粒和siRNA-SNHG3 质粒均购自上海吉玛制药有限公司(阴性对照质粒序列:5ʹ-CCAGACTGCAGGTTTGAC-3ʹ,siRNASNHG3质粒序列:5ʹ-CCAGAATTGCTTGCCTCAT-3ʹ)。
1.2.3 qRT-PCR 检测 使用TRIzol 试剂(Invitrogen公司,美国)提取样本组织和细胞中的总RNA,根据逆转录试剂盒(Takara 公司,日本)的说明将RNA 反转录成cDNA,体系20 μL,反应条件为:37℃,15 min;85℃,5 s;使用SYBR Premix EX Taq试剂盒(Takara公司,日本)进行扩增,样品在实时荧光定量PCR仪(ABI7500,ABI公司,USA)中进行qRT-PCR 反应,qRT-PCR的反应条件为95℃,5 min;95℃,15 s;58℃,30 s和74℃,30 s。共40个循环,以GAPDH为内参,采用公式2-ΔΔCt法计算产物相对表达量。SNHG3上游引物:5′-TTCCGGCGTTACTTAAGG-3′;SNHG3 下游引物:5′-GGTCAAGAACAAGCACACCAA-3′;SNAIL上游引物:5′-TGACCTGTCTGCAAATGCTC-3’;SNAIL下游引物:5′-CAGACCCTGGTTGCTTCAA-3′;TWIST 上游引物:5′-TCCAGAGAAGGAGAAAATGGA- 3’;TWIST下游引物:5′- CCCACGCCCTGTTTCTTTGA-3’;GAPDH 上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′;GAPDH 下游引物:5′-GTGCAGGGTGAGCT-3′。
1.2.4 Western blot 实验 使用含有PMSF的RIPA裂解液(KenGen 公司,中国)提取样本组织或细胞中的总蛋白,冰上孵育30 min,4℃,10 000 g 离心5 min 后取上清液。应用BCA蛋白分析试剂盒(碧云天生物技术有限,中国)对蛋白质浓度进行定量。接下来,用10%的SDS-PAGE凝胶电泳分离蛋白质,然后转移到PVDF膜上(Millipor公司,美国),5%的脱脂牛奶室温封闭2 h。随后,用稀释的抗SNAIL和TWIST 抗体(1:1 000,Abcam公司,美国)在4℃下孵育过夜,然后用HRP结合的二抗(1:5 000,翼飞雪生物科技有限公司公司,中国)孵育2 h。取ECL 荧光检测试剂盒(碧云天生物技术有限,中国)中等量的A液和B液,暗室中混匀,将其滴加膜上,放入凝胶成像仪中曝光成像。
1.2.5 Transwell实验 在无血清培养基中悬浮细胞,调整浓度为1.0×105/mL。将带或不带预涂Matrigel膜的Transwell 小室插入24 孔板中,上室含200 μL 细胞悬浮液,下室加入500 μL 含有20%胎牛血清的培养基。于37℃,5%CO2浓度的培养箱中进行培养,48 h后取出Transwell 小室用PBS 洗2次,5%多聚甲醛固定20 min,0.1%结晶紫染色20 min,PBS 冲洗2次,棉球擦去上表面细胞,倒置荧光显微镜(TE2000,Nikon公司,日本)下观察,随机读取5个视野进行拍照(200×),取平均值为每组穿过小室细胞数。侵袭实验使用预涂Matrigel膜的Transwell小室进行。
1.3 统计学方法
所有数据采用SPSS21.0软件(IBM,美国)进行分析。所有实验至少重复3次,计量资料用表示。癌组织和癌旁组织的表达比较采用配对t检验,两组间比较采用t检验,生存分析采用Kaplan-Meier和Log-rank检验。计数资料以例数表示,组间比较采用χ2检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 lncRNA SNHG3在ESCC肿瘤组织和细胞中的表达水平显著提高
通过qRT-PCR 检测ESCC肿瘤组织及对应的癌旁组织中lncRNA SNHG3表达,结果显示,与癌旁正常组织相比,ESCC肿瘤组织中lncRNA SNHG3的表达水平显著提高(P<0.05,图1)。

图1 ESCC肿瘤组织及对应的癌旁组织中lncRNA SNHG3表达水平(***P<0.001)
通过qRT-PCR 检测ESCC细胞ECA-109和人正常食管上皮细胞HEEC 中lncRNA SNHG3表达,结果显示,与HEEC细胞相比,ESCC细胞ECA-109 中lncRNA SNHG3的表达水平显著提高(P<0.05,图2)。
2.2 lncRNA SNHG3的表达与ESCC患者临床病理特征及预后的关系
根据ESCC肿瘤组织中lncRNA SNHG3的表达水平,将lncRNA SNHG3表达高于中位值的患者定为高表达组,而低于或等于中位值的患者定为低表达组。为了确定lncRNA SNHG3的表达水平是否与ESCC的进展有关,分析lncRNA SNHG3的表达水平与ESCC患者临床病理特征的关系。发现lncRNA SNHG3表达水平与肿瘤分化程度、TNM分期及淋巴结转移情况显著相关(P<0.05),但与年龄、性别和肿瘤部位无关(P>0.05,表1)。

图2 ESCC细胞ECA-109和人正常食管上皮细胞HEEC 中lncRNA SNHG3表达水平(**P<0.01)

表1 lncRNA SNHG3的表达水平与ESCC患者临床病理特征的关系例
通过Kaplan-Meier法绘制出lncRNA SNHG3高、低表达组ESCC患者的生存曲线并进行比较。结果显示,与低表达lncRNA SNHG3组相比,高表达lncRNA SNHG3组患者的总体5年生存率显著降低,lncRNA SNHG3的高表达与ESCC患者的预后不良显著相关(P=0.008,图3)。

图3 ESCC患者lncRNA SNHG3高、低表达组的生存曲线
2.3 siRNA-SNHG3 敲降ECA-109细胞中lncRNA SNHG3的表达水平
ECA-109细胞使用siRNA-SNHG3 敲降质粒处理后,lncRNA SNHG3的表达水平显著降低(P<0.05)。结果表明,lncRNA SNHG3 敲降的ECA-109细胞构建成功。见图4。
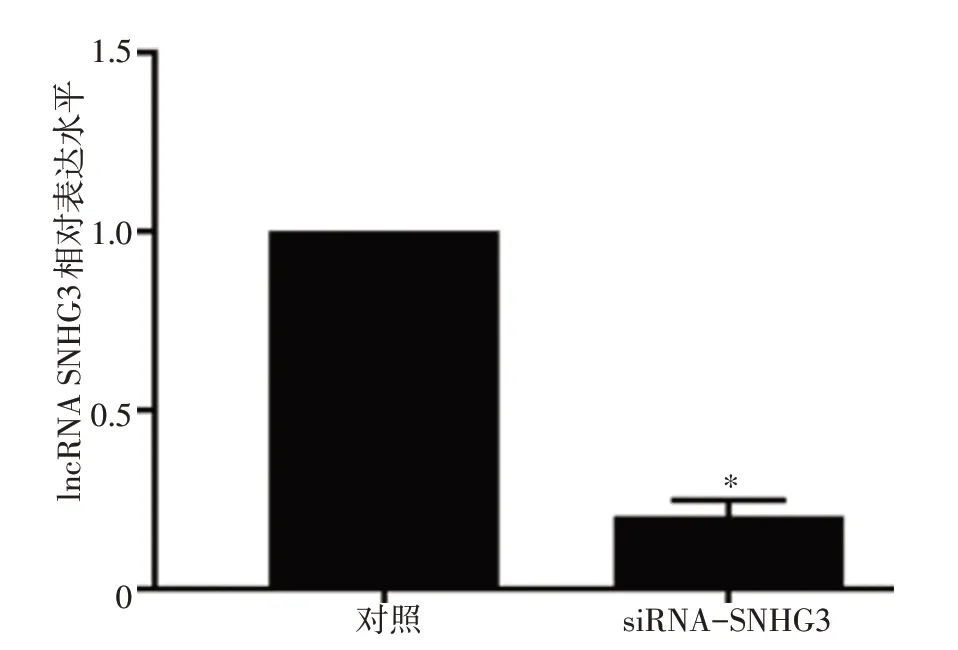
图4 两组ECA-109细胞中lncRNA SNHG3表达水平(*P<0.05)
2.4 敲降lncRNA SNHG3抑制ECA-109细胞的迁移和侵袭能力
为了探究lncRNA SNHG3 对ECA-109细胞的影响,在ESCC细胞ECA-109 中敲降lncRNA SNHG3 以检测其对ESCC细胞的影响。通过Transwell 实验检测敲降lncRNA SNHG3 后ECA-109细胞的迁移和侵袭情况,结果显示与对照组相比,siRNA-SNHG3组中迁移和侵袭的细胞数目显著减少(P<0.05)。结果表明,敲降lncRNA SNHG3能够显著抑制ECA-109细胞的迁移和侵袭能力。见图5。
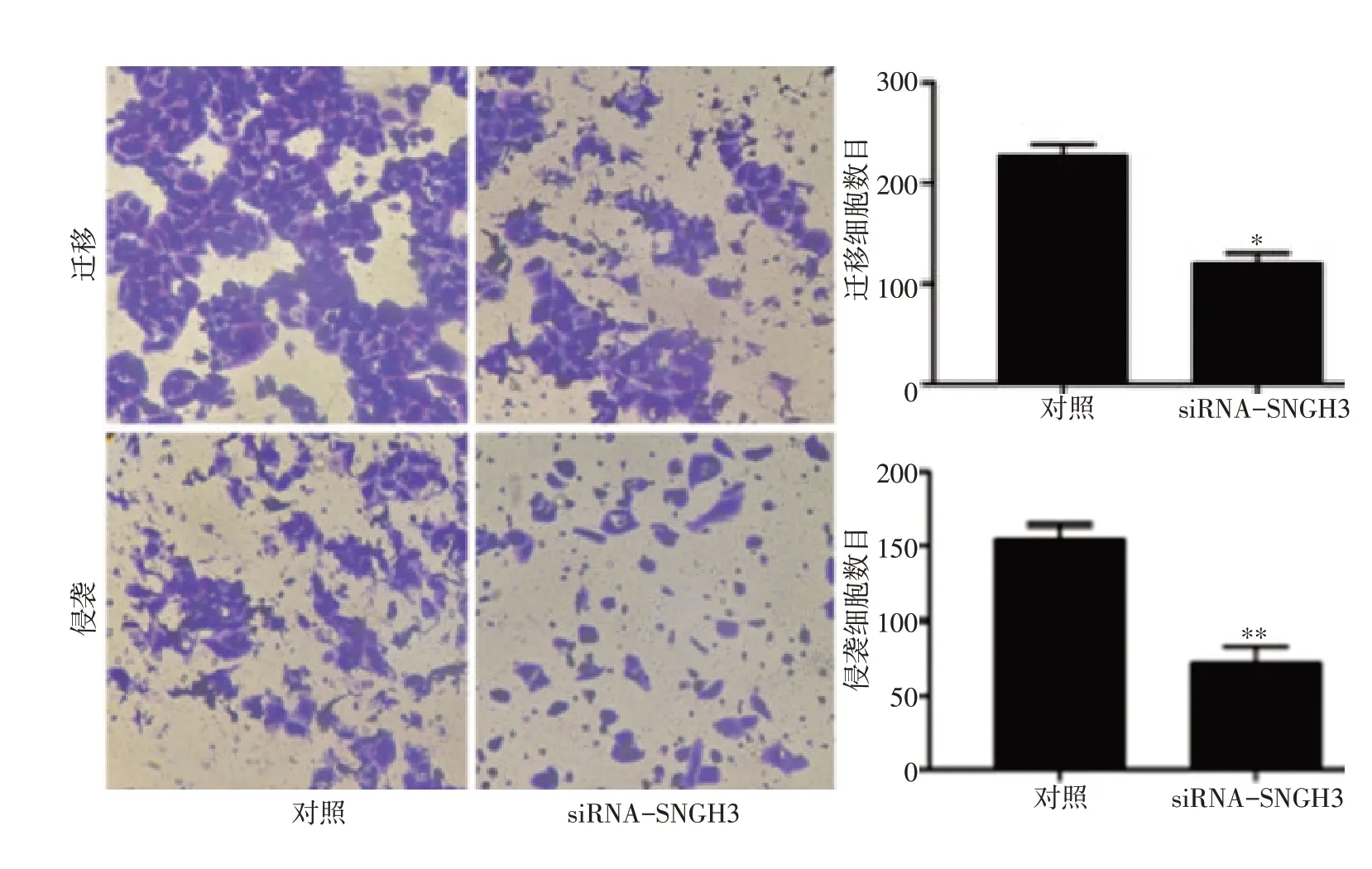
图5 siRNA-SNHG3 处理后ECA-109细胞迁移和侵袭能力变化(*P<0.05,**P<0.01)
2.5 敲降lncRNA SNHG3 抑制ECA-109细胞中SNAIL和TWIST的mRNA及蛋白的表达水平
为进一步探究lncRNA SNHG3 促进ECA-109细胞迁移和侵袭的作用机制,通过qRT-PCR和Western blot 实验检测了siRNA-SNHG3 组和对照组细胞中SNAIL和TWIST的mRNA及蛋白的表达水平。结果显示,与对照组相比,siRNA-SNHG3组中SNAIL和TWIST的mRNA及蛋白的表达水平显著降低(P<0.05)。结果表明,敲降lncRNA SNHG3 能够显著抑制ECA-109细胞中SNAIL和TWIST的mRNA及蛋白的表达水平。见图6。

图6 siRNA-SNHG3处理后ECA-109细胞中SNAIL和TWIST的mRNA及蛋白的表达(*P<0.05)
3 讨论
ESCC 是由包括lncRNA 失调等多种遗传因素以及吸烟、饮酒等多种环境因素引起的恶性肿瘤[9-10]。ESCC患者在诊断时大多数已经处于疾病的晚期且预后通常很差[3]。此外,目前用于治疗晚期ESCC的治疗方法(包括手术、放疗和化疗)并不令人满意,而包括癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原199(carbohydrate antigen 199,CA-199)在内的传统肿瘤分子标志物缺乏对ESCC 早期检测的敏感性和特异性[11]。因此,需寻找更加敏感和特异的分子标志物对ESCC进行早期诊断和治疗。
肿瘤的发生发展过程涉及一个复杂的基因调控网络,虽然lncRNA缺乏蛋白编码能力,但它们通过直接或间接的机制在基因调控中发挥着关键作用[12-13]。多项研究表明,lncRNA作为致癌或肿瘤抑制因子参与ESCC的进展。Ma等[14]报道,在ESCC中高表达的lncRNA lnc-ABCA12-3通过调节纤维连接蛋白1(fibronectin 1,FN1)发挥促进细胞迁移、侵袭和增殖的作用。Zheng等[15]实验发现lncRNA MNX1-AS1通过上调IGF2促进ESCC细胞的迁移和侵袭。下调lncRNA XLOC_001659通过miR-490-5p/PIK3CA信号轴抑制ESCC细胞的增殖和侵袭,参与ESCC肿瘤的发生发展[16]。提示这些lncRNA可能是确定ESCC患者预后的潜在诊断工具和分子标志物。
已有研究发现,lncRNA SNHG3在口腔鳞状细胞癌[17]、肝细胞癌[18]和非小细胞肺癌[19]等多种恶性肿瘤的癌与癌旁组织中表达具有显著差异,并作为关键因子促进肿瘤的恶性进展。然而,关于lncRNA SNHG3 在ESCC 发生发展中的作用机制的研究目前尚未见有关报道。鉴于此,本研究发现,在ESCC肿瘤组织和细胞中,lncRNA SNHG3的表达水平显著提高,提示lncRNA SNHG3可能与ESCC的发生发展密切相关。本文分析lncRNA SNHG3的表达水平与ESCC患者临床病理特征的关系,发现lncRNA SNHG3表达水平与肿瘤分化程度、TNM分期及淋巴结转移情况显著相关(P<0.05)。通过Kaplan-Meier 生存分析发现,高表达的lncRNA SNHG3 与ESCC的预后不良显著相关,表明lncRNA SNHG3可能是影响ESCC患者预后的分子标志物。ESCC是一种高度具有高度转移和侵袭能力的恶性肿瘤,高度迁移性和侵袭性也是ESCC 致死的主要原因之一。为了进一步探究lncRNA SNHG3对ESCC细胞ECA-109迁移和侵袭能力的影响,通过Transwell 实验分析siRNA-SNHG3 组和对照组中ECA-109细胞数量,发现敲降lncRNA SNHG3的ECA-109细胞迁移和侵袭的数目显著减少,表明敲降lncRNA SNHG3的表达,能够显著抑制ECA-109的迁移和侵袭能力。
SNAIL是一种锌指样转录抑制因子,在胚胎发生和肿瘤进展过程中调控EMT的进程,并通过其N-末端SNAG 结构域与几个共抑制因子和表观重塑复合物相互作用,抑制特定的靶基因,如E-cadherin 基因(CDH1)的表达[20-21]。TWIST 是EMT的主要调节因子,参与促进细胞分化、运动和增殖,并与肿瘤干细胞表型相关[22-23]。研究表明,在包括ESCC 在内的多种原发性和转移性肿瘤中普遍存在SNAIL和TWIST蛋白的过度,并且参与肿瘤细胞的转移和侵袭过程[24-26]。在本研究中,通过qRT-PCR和Western blot检测siRNA-SNHG3 组和对照组ECA-109细胞中SNAIL和TWIST的mRNA及蛋白的表达水平,发现敲降lncRNA SNHG3 后,SNAIL和TWIST的mRNA及蛋白的表达水平显著降低,提示lncRNA SNHG3可能从转录层面调控SNAIL和TWIST蛋白的表达水平,促进ESCC细胞的EMT进程,从而增强ECA-109细胞的转移和侵袭能力。
研究表明,在ESCC组织和细胞中高表达的lncRNA SNHG3可能通过调控SNAIL和TWIST蛋白的表达水平,促进ECA-109细胞的迁移和侵袭,并且与ESCC患者的预后不良显著相关。本研究表明在ESCC 中lncRNA SNHG3 作为促癌基因发挥作用,lncRNA SNHG3有望成为ESCC治疗的潜在靶点。未来我们将进一步在体内实验中探究lncRNA SNHG3的作用。
