NaOH溶液改性沸石对氨氮吸附的研究
2020-07-27王秀云
王秀云
(合肥市固体废物管理中心,安徽 合肥 230601)
氨氮废水的大量排放是导致水体离营养频发的主要原因之[1],而违规的生物处理工艺对高浓度氨氮废水处理难以达到排放标准[2]。
沸石作为一种可再生的非金属矿物具有特殊的孔隙结构,其特殊的孔隙结构和稳定的物理化学性质,让其在处理氨氮废水中具有独特的优势[3]。但是天然沸石中的化学组成多种多样, 需要通过一些物理化学方法让其变得更纯[4]。这也吸引了国内外和学者对天然沸石进行各种条件下的改性研究,并取得不错的效果。如张璐等[5]揭示了NaOH改性过的沸石明显提高了对氨氮的吸附能力;杨炳飞等研究改性过后的沸石对氨氮的去除率从54.4%提高到62.6%和98.3%[6]。目前常用的去除氨氮的方法有物化法预处理或深度处理脱除氨氮等。本文主要说明了吸附法的应用,沸石以及改性沸石对氨氮都有一定的吸附作用。单明丹等[7]认为吸附法和折点加氯法不适用于处理高浓度的氨氮废水;解玉红等[8]将改性沸石去除率提高了34.9%。本文研究了NaOH溶液和人造沸石以一定配比制成的改性沸石对氨氮废水的吸附,选择几种不同条件,然后进行研究和探讨,进而确定改性沸石处理氨氮废水的最佳条件。
1 材料与方法
1.1 试剂和仪器
NaOH、人造沸石、碘化钾、碘化汞、氯化铵、氯化钠、酒石酸钾钠、活性氧化铝、氯化钾、氯化铁、氯化锌等均为分析纯,购于国药试剂公司。
可见分光光度计;电热恒温鼓风干燥箱;电子天平;双层调速多用振荡器。
1.2 改性沸石的制备
1.5 mol/L的NaOH溶液浸渍沸石[9],震荡24 h,冲洗改性过的沸石直到中性,在75 ℃下烘干,最后得到改性沸石[10]。
1.3 实验方法
本试验采用了单因素法和四因素三水平正交实验法研究改性沸石对氨氮的去除效率的影响[11]。
2 结果与分析
2.1 氨氮标准曲线
2.1.1 标准曲线的绘制 移取5.00 mL氨氮标准储备液注入500 mL容量瓶中,加水定容,得氨氮标准使用液。吸取0、0.50、1.00、3.00、5.00、7.00、10.00 mL氨氮标准使用液,加1.0 mL KNaC4H4O6·4H2O溶液,加1.5 mL纳氏试剂,混匀。静置10 min后,于420 nm处,以蒸馏水为空白对照,如图1所示,建立氨氮的标准曲线。
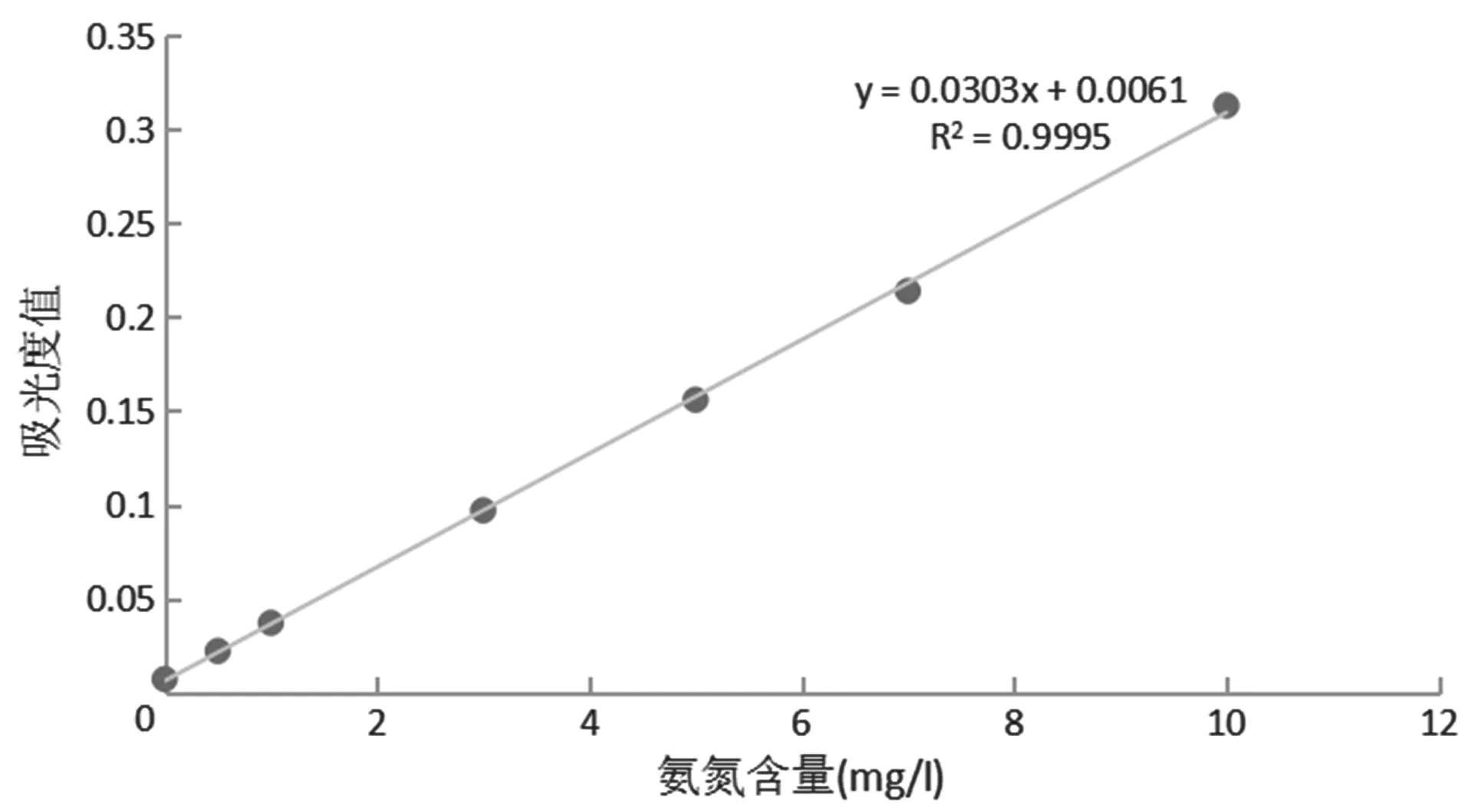
图1 氨氮标准曲线
2.1.2 水样中所含氨氮的测定 从所准备的水样中吸取5.0 mL,再缓慢放入比色管中,得到水样中氨氮的浓度。
2. 四种不同因素控制变量处理最优条件的探究
2..1 沸石投加量对氨氮吸附效果的影响 往锥形瓶中装入100 mL的80 mg/L的氨氮模拟废水[12],分别称取0、1.0、2.0、3.0、4.0、5.0、6.0 g沸石分别装入7支锥形瓶中,摇匀,贴上标签,封上封口膜,在25 ℃下振荡90min后进行过滤出澄清液[13],再按照水样测试方法测定吸光度并拟合曲线,如图2所示。

图2 沸石投加量影响
沸石的投加量增多时,氨氮浓度下降,表示处理效果加强,在1.0~4.0 g时,吸光度逐渐减小;在4.0~6.0 g时,吸光度逐渐增加,则说明处理效果开始下降;综合可得,最佳沸石投加量为4.0 g。
2.3.2 氨氮浓度对吸附效果的影响 锥形瓶中加入100 mL浓度分别为0、10、20、30、40、50、60 mg/L的氨氮模拟废液,加入4.0 g改性沸石,摇匀,贴标签在25 ℃下振荡90 min[14],然后过滤出澄清液,按照水样测试的方法测定吸光度记录吸光度并拟合曲线,如图3所示。
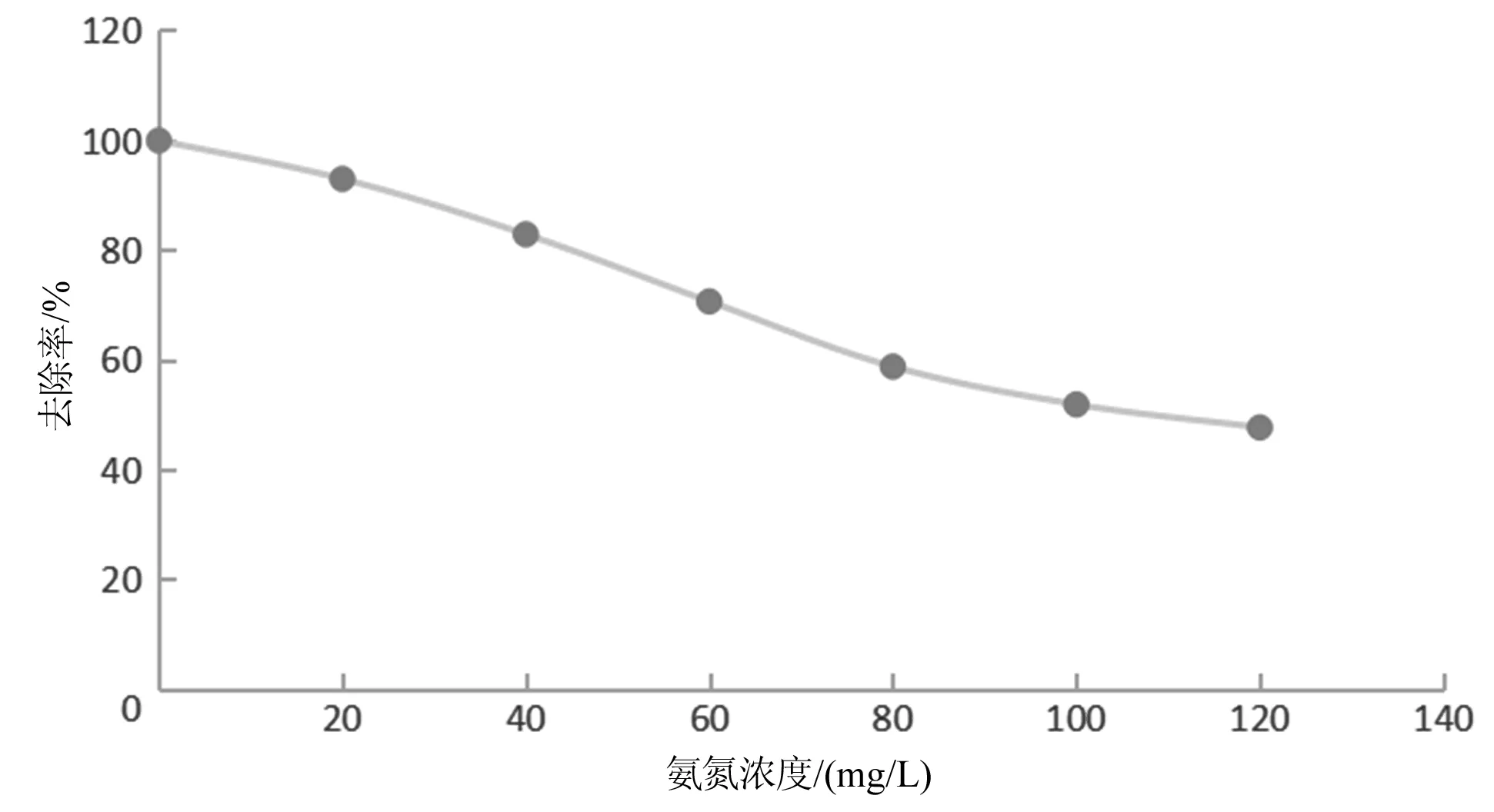
图3 氨氮浓度影响
由图可知,氨氮浓度在0~80 mg/L时,下降趋势较快,80 mg/L之后趋势减缓,最后趋于平缓。因此以80 mg/L氨氮浓度为后续研究。
2.2.3 沸石接触时间对氨氮吸附效果的影响 在7只锥形瓶中分别装入模拟氨氮废水100 mL,投入4.0 g改性沸石,摇匀,封口,在25 ℃下分别振荡5、10、15、30、60、90、120、240 min后,滤出澄清液后,按照水样测试的方法测定吸光度并绘制拟合曲线,如图4所示。
由图可知,在0~15 min之间,吸光度在增加,而15~60 min之间快速下降,即这段时间内氨氮的吸附效果很好,在50~240 min之间吸光度上升后下降,总体呈下降的趋势,综合可得在60 min时处理效果良好。
2.2.4 共存阳离子对氨氮吸附效果的影响 取100 mL的80 mg/L的氨氮废水加入4.0 g改性沸石,再分别加入Al3+、Fe3+、Mg2+、Zn2+、K+、Na+摇匀,封口,在25 ℃下振荡60 min后,滤出澄清液,再按照水样测试的方法测定吸光度并拟合曲线。如图5所示:
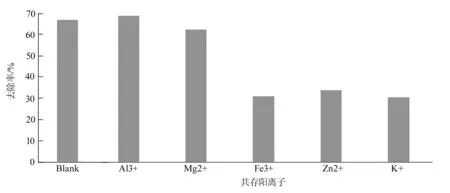
图5 不同金属阳离子影响
由图可得Al3+和Mg2+不影响氨痰的吸附,而Fe3+、K+和Zn2+起到抑制作用[15-16]。因此,废水中应先去掉配位能力较强的阳离子,否则会影响改性沸石的吸附能力。
2.3 正交实验

表2 改性沸石吸附氨氮废水的正交试验结果
正交实验选择了四种因素来进一步探究其对氨氮废水的吸附性能效果,采用四种因素三种变量的正交实验。其中,吸附时间分别为30、60、90 min;投加量:3.0、4.0、5.0 g;氨氮浓度:40、60、80 mg/L;共存阳离子:Fe3+、Mg2+、K+;实验结果如表2。
由表格分析可得:控制时间因素时,沸石与氨氮废水接触时间为60 min时,氨氮的去除率会高于接触30 min和接触90 min时的氨氮去除率,此时为74.02%;配比不同的氨氮废水,当配比浓度为60 mg/L时,处理效果最佳,去除率可达73.91%;控制沸石投加量来说,投加5 g经改性过的沸石的处理效果最佳,去除率可达72.77%;阳离子对氨氮的去除率有一定影响,这可能与沸石本身的结构性质有关,其中最佳的共存阳离子为Mg2+;最佳综合处理条件为:处理时间为60 min,氨氮浓度为60 mg/L,沸石投加量为5.0 g,共存阳离子为Mg2+。
2.4 吸附动力学的探究
吸附动力学研究的是吸附剂对溶质的吸附速率,再通过数据的对比分析得到吸附剂吸附溶质的规律。
采用准一级、二级动力学方程处理实验中的数据[17-18]。
准一级吸附动力学方程:
ln(Qe-Qt)=lnQe-K1t
(4)
准二级吸附动力学方程:
t/Qt=1/(K2Qe2)+t/Qe
(5)
准一级动力学方程作图6所示:

图6 准一级动力学方程拟合曲线
准二级动力学方程如图7所示:
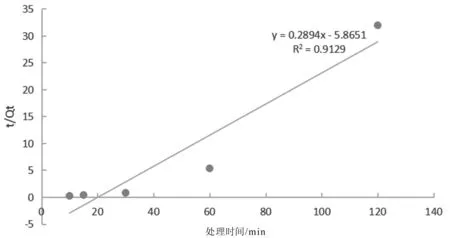
图7 准二级动力学方程拟合曲线
两者通过数据和曲线对比,可以看出准二级动力学学方程比准一级动力学方程更能够准确的反应氨氮废水的吸附行为,所以选择第二个,说明第二个会出现吸附饱和的现象。
2.5 吸附等温线实验
取一只250 mL锥形瓶,然后加入100 mL模拟氨氮浓度废水,再加入4 g改性沸石,在室温条件下进行震荡2 h,然后进行过滤,测定氨氮浓度,最后根据公式(3)计算平衡时的吸附量,如图8所示。
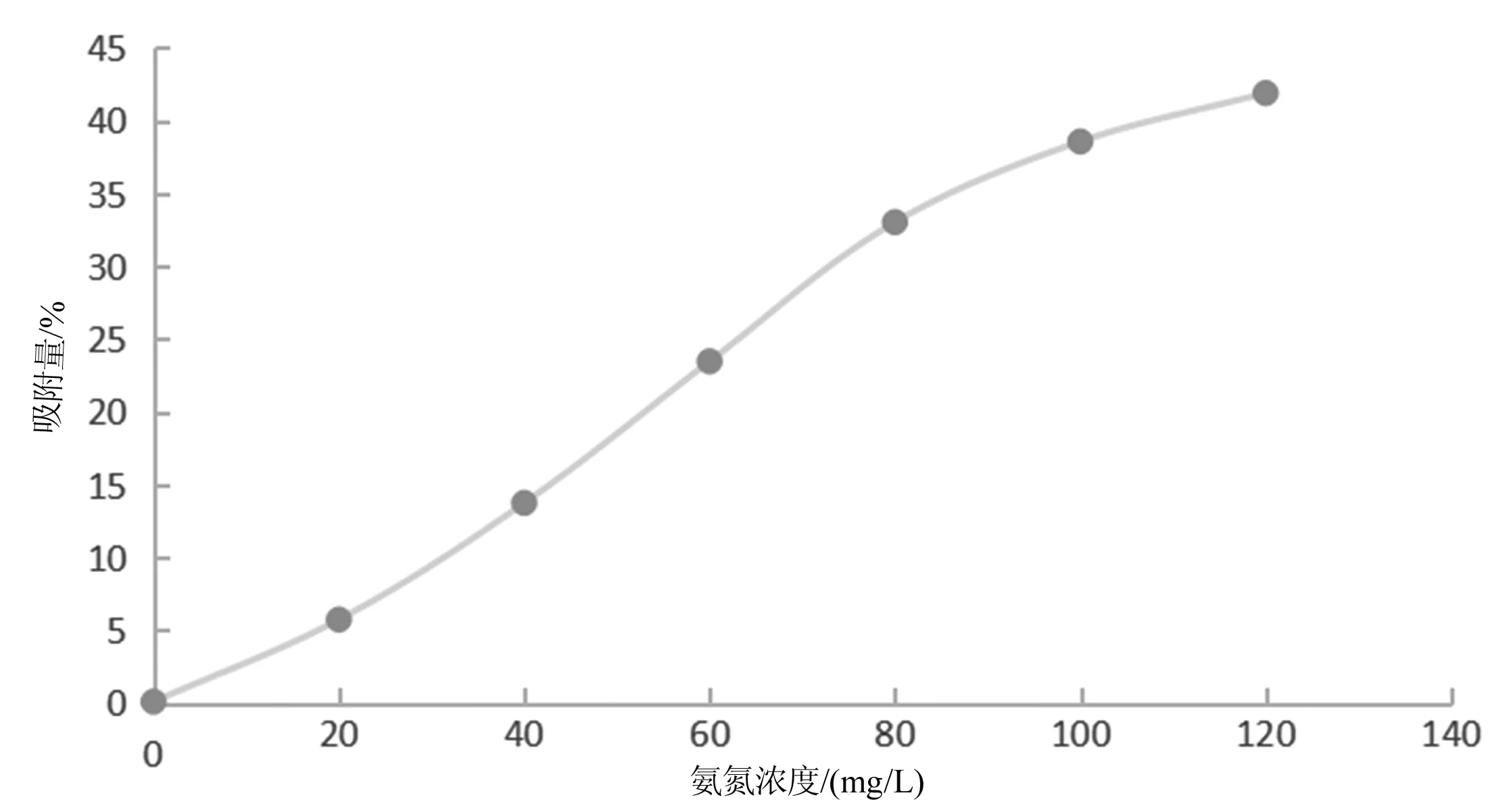
图8 氨氮浓度与吸附量的关系
Langmuir吸附等温式和Freundlich吸附等温式方程如下[19-20]:
Ce/Qe=ce/Qm+1/kL*Qm
(6)
lnQe=(1/n)lnce+lnKf
(7)
Langmuir吸附等温式拟合曲线如图9。
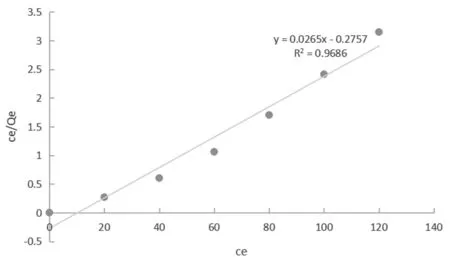
图9 Langmuir吸附等温线
Freundlich吸附等温式拟合曲线如图10。

图10Freundlich吸附等温
Fig.10Freundlichadsorptionisotherm
由图可知,两种吸附等温线都能够很好地描述热力学吸附。
3 结论
(1)改性沸石的最优制备条件:NaOH溶液浓度1.5 mol/L,振荡器震荡24 h,然后用蒸馏水冲洗至中性,最后用鼓风干燥机烘干。
(2)正交实验结果表明,改性沸石的投加量为4.0 g,氨氮废水浓度为80 mg/L,氨氮去除时间60 min为佳。
