富春江下游段夏季浮游植物群落结构特征及其与环境因子的关系
2020-07-27郝雅宾刘金殿张爱菊周志明
郝雅宾,刘金殿,张爱菊,王 俊,于 喆,周志明
(浙江省淡水水产研究所,农业农村部淡水渔业健康养殖重点实验室,浙江省淡水水产遗传育种重点实验室,浙江湖州 313001)
浮游植物是江河水域生态系统的主要初级生产者,对江河水域生态系统的能量流动、物质循环和维持水域生态系统平衡具有重要的作用[1]。浮游植物群落结构对水域环境变化非常灵敏,具有指示作用[2],其群落结构和生物多样性能够有效反映水体的水质状况,从而弥补水化学指标评价水质的不足。目前,浮游植物群落结构特征及生物多样性与水环境因子、水生态系统的影响关系的研究已受到相关领域学者的广泛关注[3-5]。
富春江属钱塘江水系中下游,西起建德梅城东关,向东流经贯穿桐庐、富阳两县市,至与浦阳江汇合口处(29°32′~30°06′N,119°31′~120°10′E),干流全长104.3 km,水域面积约为6 658 km2,年平均径流量305亿m3,支流众多[6]。富春江沿程桥梁繁多,且中途被富春江水库大坝拦截,其中桐庐富阳段还存在采砂、水路货运和水污染等,这些因素严重影响其水体环境和水生态系统状况,生物多样性下降和水域生态功能降低等问题日渐突显[6-9]。
近年来,钱塘江中下游江段有关浮游植物的研究较少[10],主要集中于富春江水库[11-12]和钱塘江口[13-14],而富春江下游段浮游植物的相关研究未见报道。因此,本研究于2018年7月对富春江下游段浮游植物进行了取样调查,旨在了解该江段水域浮游植物的种类组成、优势种和群落生物多样性等群落特征及其与环境因子的关系,以期为流域内的水生生物资源利用和水环境管理提供参考资料。
1 材料与方法
1.1 采集时间与样点设置
2018年7月中旬在富春江干流和一级支流分水江设置10个采样点,其中干流点位9个(1#,3~10#),支流点位1个(2#)(图1),采集浮游植物样品。样点的布设依据《水环境监测规范》(SL219—2013)[15]并结合调查区域生态环境条件设置。
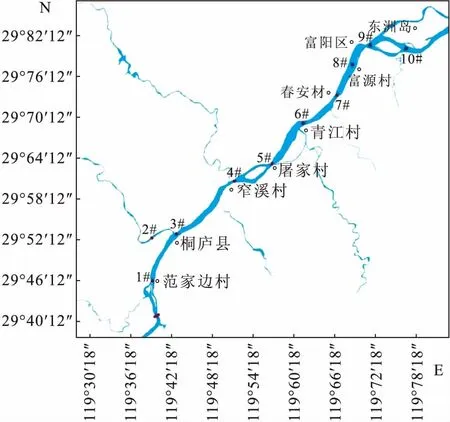
图1 采样点分布图Fig.1 Location of samplings sites
1.2 浮游植物样本采集与测定方法
采集浮游植物定性样品时,使用25号筛绢网制作的浮游生物网在样点表层水匀速按“∞”字形拖曳[15],样品收集于100 mL聚乙烯瓶中,加1 mL的4%福尔马林进行固定保存。采集定量样品时,使用5 L有机玻璃采水器分别采集表层水0.5 m和1 m处的水样,于塑料桶内混合均匀后,取1 L水样加入15 mL鲁哥氏液固定保存,带回实验室后,经分液漏斗静置沉淀48 h以上,浓缩至30 mL,摇匀后,取0.1 mL浓缩液注入0.1 mL浮游植物计数框内,在显微镜下观察鉴定并计数。每个样本计数2~3次,取平均值。浮游植物种类参考文献[16,17]进行鉴定。
1.3 水质样本采集与测定方法
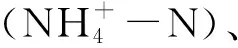
1.4 数据处理与分析
1.4.1 优势种和生物多样性分析
采用Margalef多样性指数(D)[19]、Simpson多样性指数(λ)[20]、Shannon-Wiener多样性指数(H′)[21]、Pielou均匀度指数(J′)[22]和优势度(Y)[23]描述浮游植物群落特征。
计算公式:
(1)
(2)
(3)
(4)
(5)
Y=PiPi×fi
(6)
式中:Pi为第i种的细胞密度占总细胞密度的比例;S为样点中浮游植物总种数;Ni为第i个种的细胞密度;N为样点中浮游植物总细胞密度;fi为第i种在各样点出现的频率。当优势度Y≥0.02时,本研究认为该种即为优势种。利用Excel 2007和Primer 5软件进行以上数据统计分析。
1.4.2 Pearson相关性分析
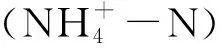
1.4.3 典范对应分析
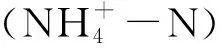
2 结果与分析
2.1 浮游植物种类组成及数量
本次调查共鉴定出浮游植物6门50属99种(含只鉴定到属的种类、变种和变形)。其中硅藻门最多,为20属56种,占总种数的56.57%;绿藻门为17属26种(占26.26%);蓝藻门为5属7种(占7.07%);甲藻门为3属4种(占4.04%);裸藻门为3属3种(占3.03%);隐藻门为2属3种(占3.03%)。在富春江下游段水域的浮游植物群落结构组成中,硅藻门与绿藻门处优势地位,表明该水域浮游植物种类组成表现为硅藻-绿藻型。
各样点浮游植物种类组成有所不同,但硅藻、绿藻、甲藻、隐藻在各样点均有出现。10#硅藻种类最多,有33种,2#与6#采样点最少,分别为13种;2#采样点绿藻种类居多,为10种,1#、6#和9#采样点最少,为4种;3#和4#采样点甲藻最多,为4种,2#、6#、8#、9#和10#采样点各仅1种;4#采样点隐藻最多,为3种,9#采样点仅1种。浮游植物种类数在10#采样点最多,为44种,6#采样点最少,为20种;蓝藻除在1#和6#采样点未见外,其他采样点均有出现;裸藻除在2#和7#采样点出现外,其他采样点均未出现(图2)。
富春江下游段水域各采样点浮游植物密度为(1.66±0.77)×105ind./L,各采样点均在104ind./L以上(图2)。空间分布上,10#采样点藻类密度最高,4#采样点藻类密度最低,且5#、6#和4#采样点藻类密度相差不大,表明不同采样点的浮游植物细胞密度具有一定的差异性。此外,不同采样点的硅藻、绿藻和隐藻的细胞密度也具有差异性。5#、6#、3#、7#、4#和1#采样点主要是小支流与干流交汇后的水体,藻类细胞密度相对较低,硅藻和隐藻占据绝大部分;8#和9#采样点是干流江段的水体,除10#采样点外,8#采样点藻类细胞密度相对其他采样点的较高;9#采样点相对4#、5#和6#采样点较高,而相对其他采样点较低,两个采样点的藻类情况为硅藻和绿藻占据绝大部分;2#采样点是一级支流分水江水体,除8#、10#采样点外,藻类细胞密度相对其他采样点较高,以绿藻为主;10#采样点是多沙洲多支流交汇水体,藻类细胞密度相对较高,以硅藻为主。
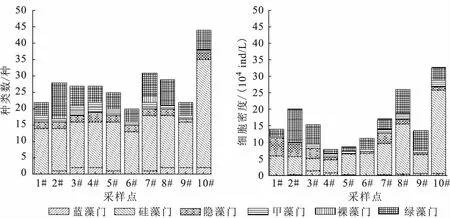
图2 采样点浮游植物种类组成和细胞密度Fig.2 Composition of phytoplankton species and cell density in the downstream section of Fuchun River in summer
2.2 优势种组成
根据优势度计算结果显示,富春江下游段水域夏季浮游植物优势种为4门7种(表1),分别为梅尼小环藻(Cyclotellameneghiniana)、颗粒直链藻(Melosiragranulata)、颗粒直链藻最窄变种(M.granulatavar.angustissima)、变异直链藻(M.varians)、卵形隐藻(Cryptomonsovata)、微小多甲藻(Peridiniumpusillum)和小球藻(Chlorellavulgaris),其中颗粒直链藻最窄变种优势度最高。
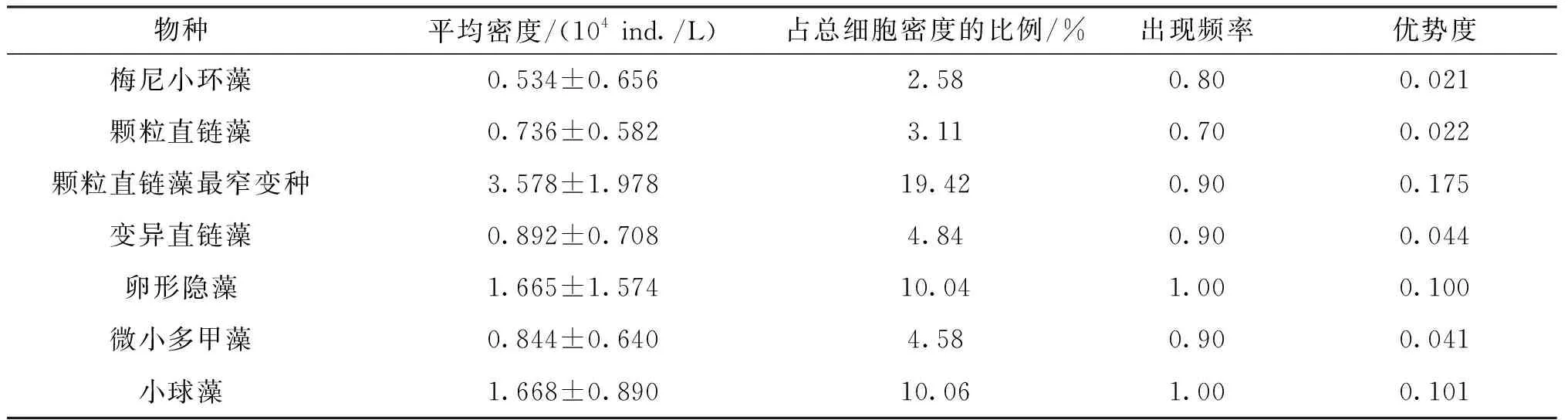
表1 富春江下游段夏季浮游植物优势种名录Tab.1 Dominant species of phytoplankton in the downstream section of Fuchun River in summer
2.3 浮游植物群落生物多样性
富春江下游段水域夏季浮游植物群落的Margalef指数(D)和Shannon-Wiener指数(H′)均在空间上的存在差异性变化;而Pielou均匀度指数(J)和Simpson多样性指数(λ)在空间上差异性变化不显著(图3)。Margalef指数(D)的变化范围为1.63~3.39,平均值为2.21±0.49;Shannon-Wiener多样性指数(H′)的变化范围为2.09~3.16,平均值为2.60±0.31,浮游植物种类较为丰富;Pielou均匀度指数(J′)的变化范围为0.65~0.86,平均值为0.79±0.06;Simpson多样性指数(λ)的变化范围为0.75~0.93,平均值为0.87±0.06,浮游植物分布较为均匀(图3)。在空间上,10#采样点浮游植物的多样性指标中的D、H′和λ值最大,J′值相对较大,在此认为10#采样点水体中浮游植物群落多样性最高,且种群分布较为均匀。
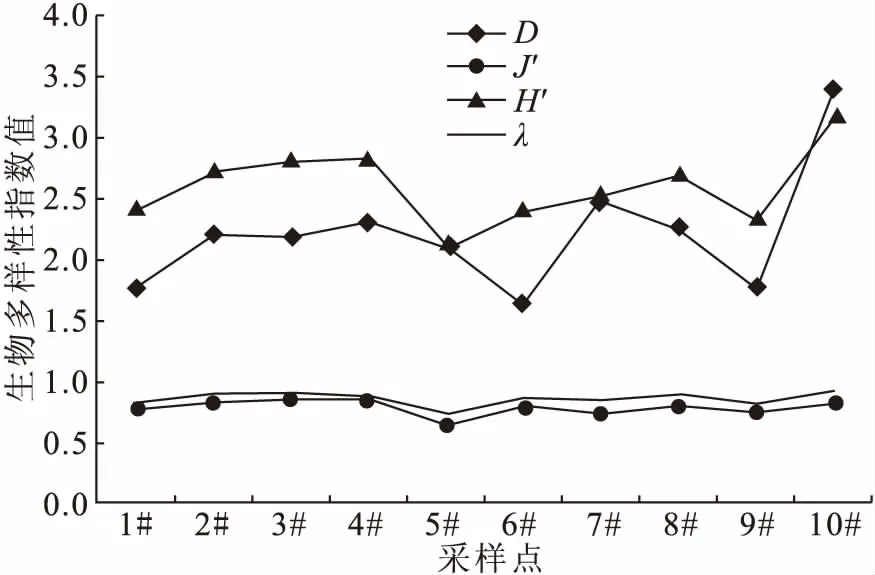
图3 富春江下游段夏季各采样点的浮游植物多样性指数Fig.3 Phytoplankton diversity index at each sampling point in the downstream section of Fuchun River in summer
2.4 浮游植物与环境因子的关系
2.4.1 Pearson相关性分析
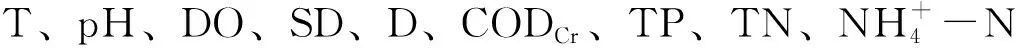
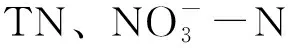
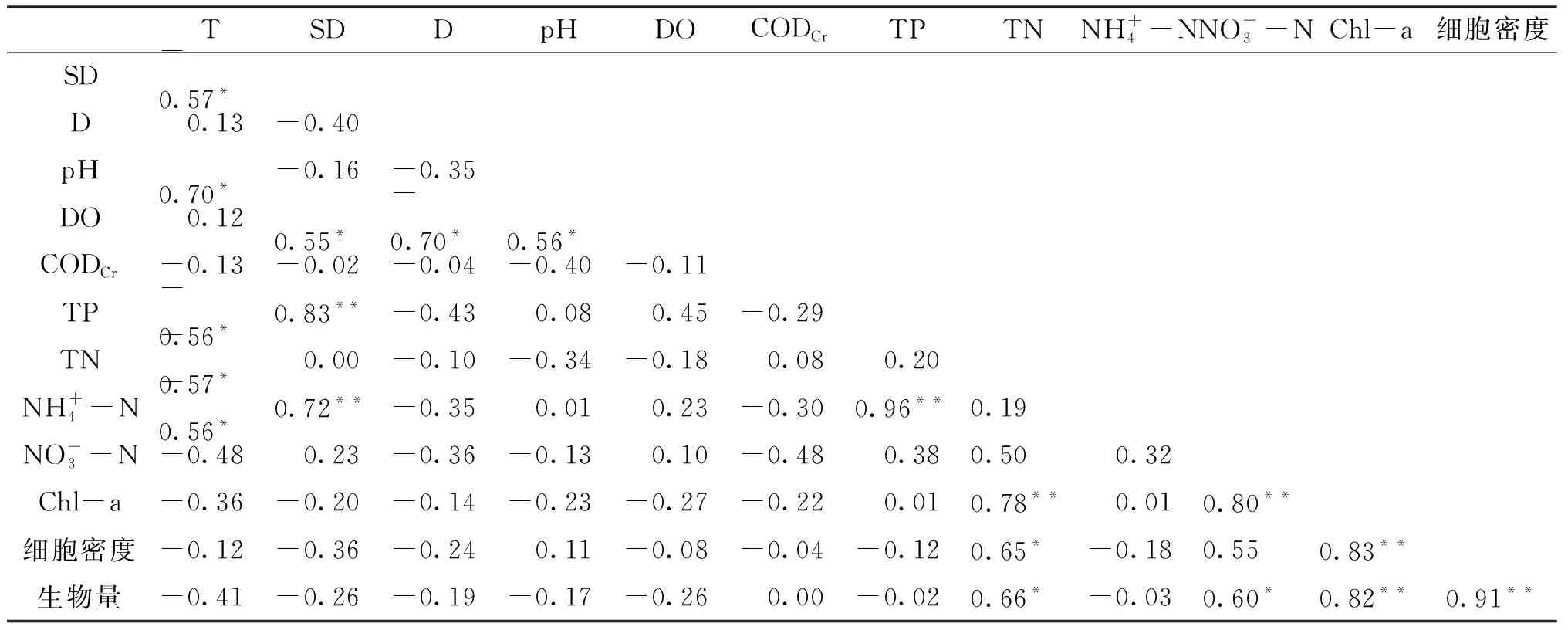
表2 浮游植物与环境因子的Pearson相关性分析Tab.2 Pearson correlation analysis of phytoplankton and environmental factors
2.4.2 CCA分析
按照上述筛选方法,筛选出34种的浮游植物用于CCA分析。CCA排序分析的4个排序轴的特征值分别为0.21、0.14、0.12和0.11。前 2个排序轴共解释了浮游植物群落变异程度的40.67%。
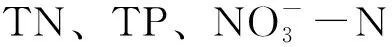
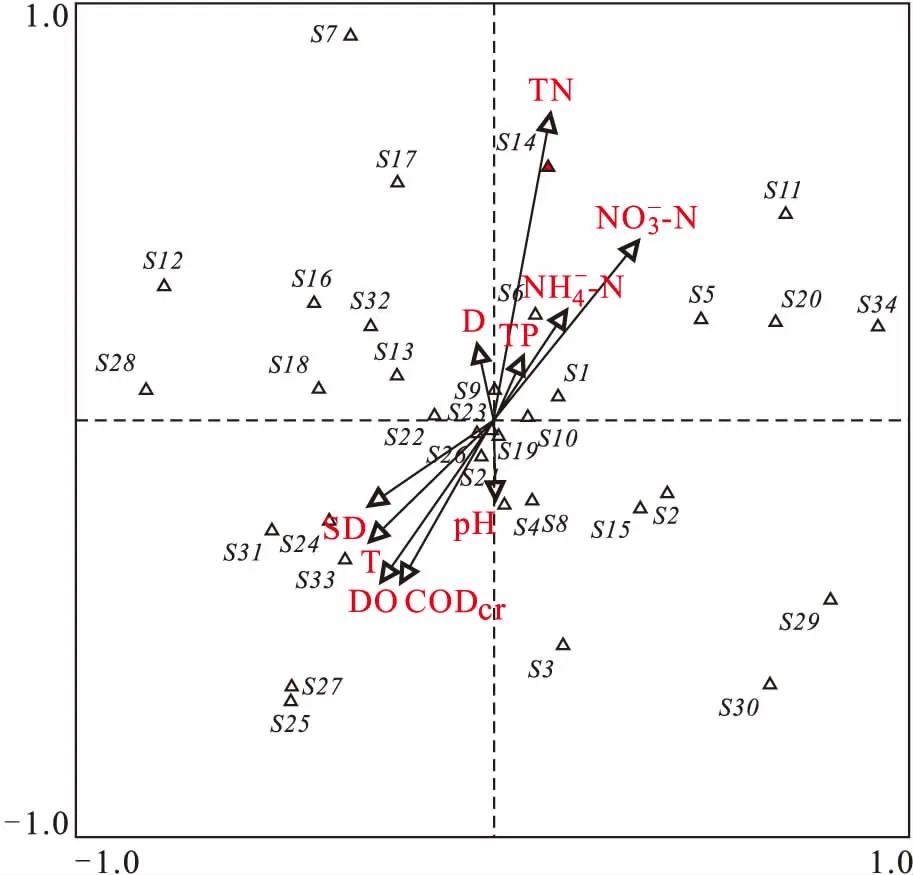
图4 富春江下游段夏季浮游植物与环境因子的典范对应分析Fig.4 Canonical correspondence analysis of phytoplankton and environmental factors in the lower reaches of the Fuchun River in summer
3 讨论
3.1 浮游植物群落结构特征
调查共鉴定出浮游植物7门50属99种(含只鉴定到属的种类、变种和变形),采样点多分布在富春江干流水域。与1983-1984年、2006-2007年调查相比,本次调查钱塘江浮游植物种类数均减少[10,11],但多于2009-2010年调查的种类数(6门12属)[12]。另外,1983-1984年钱塘江下游江段调查结果以绿藻门种类最多[10],而本次调查结果以硅藻门的种类最多。造成上述结果的因素较多,一方面,可能与采样频次、采样点数量、藻类计数方式及实验人员鉴定操作的详细程度等因素有关;另一方面,近年来调查水域受渔业增殖放流活动、采沙作业、桥梁工程建造及水路航运等影响较大。浮游植物的细胞密度变化与种类组成变化存在类似的结果,也与上述因素存在较大关系。
夏季(7月)气温和水温均较高,光照作用增强,有利于硅藻和绿藻的生长[25]。因此,硅藻和绿藻成为了调查江段的主要优势类群,以硅藻居多,尤其是直链藻。导致上述结果有几个因素,一是人为大量的增殖放流鳙,加大了对大型浮游动物的滤食作用,从而使得水体中的小型浮游动物占优势,使得较大个体的浮游植物在数量上有所增加,如直链藻属中的种类[5];二是泥沙颗粒物对藻类的影响较大[26],7#~10#采样点的水体较为浑浊,透明度较低,且含沙量较大,硅藻类具有较硬的外壳且耐磨和耐滚动[26];三是泥沙中大多吸附营养盐成分,可以为藻类生长和繁殖提供有利的条件。
生物多样性指数可用来衡量浮游植物群落结构是否稳定,一般的,生物多样性指数越高,群落结构越稳定,水质状况或水体营养状况也越好[27-28]。D值代表了物种的丰富度情况,其变化范围为1.63~3.39,表明浮游植物物种较为丰富;而在J′值上则反映各物种个体分配均匀情况,J′值的变化范围为0.65~0.86,表明浮游植物分布较为均匀;H′值越大,代表生物群落结构越复杂和稳定,本研究中H′值的变化范围为2.09~3.16,表明浮游植群落结构较为稳定。侧面反映了增殖放流鲢鳙对浮游植物群落结构的稳定影响可能较小,但很大程度上对水体营养状况的改善有良好的促进效果。
3.2 浮游植物群落结构与环境因子的关系
浮游植物的生长受营养盐、温度、光照和水中各种外部环境因子等的影响[29],而营养盐的作用可能比其他因子更为重要[30]。Pearson相关性分析可知,影响富春江下游江段夏季浮游植物最主要的环境因子是总氮和硝态氮,这与李思阳等[31]研究结果相似。可能与富阳江段的7#~10#采样点水体中的透明度较低(变化范围为0.6~1.2 m)、含沙量较大有关,大量的沙粒流动带来丰富的营养盐,为浮游植物的生长和繁殖创造了有利条件。一般认为,中营养型水体以硅藻门、甲藻门、隐藻门占优势,而富营养型水体以蓝藻门和绿藻门占优势[32]。富春江下游江段夏季浮游植物的细胞密度较低,但群落结构组成以硅藻门为主,以绿藻为次,说明水体中营养盐的含量介于中营养型和富营养型水体之间。
CCA分析结果表明,总氮和硝态氮在第1排序轴和第2排序轴上均有较大的贡献率,这与Pearson相关性分析结果一致。因此,在本研究中,总氮和硝态氮是影响浮游植物群落结构与分布的关键因子。各个浮游植物类群在排序图上有较好的分化,硅藻门的种类主要分布在第一、二和四象限,与温度呈负相关性,表明高温限制了硅藻的生长;绿藻门的种类分布于各个象限,可能与种类的多样性有关,这与倪蒙等[33]研究结果相一致。隐藻门的种类分布于第二和三象限,可能与其对温度等环境因子的适应性极强,无论夏季或冬季,在水体均可形成很好的生长和繁殖有关。甲藻门的种类集中分布于第三象限,与T、DO、SD和CODCr正相关,可能与甲藻好氧耐高温特性有关。
