饲料中添加抗菌肽对黄鳝肠道菌群的影响
2020-07-27谭凤霞杨代勤
谭凤霞,柴 毅,彭 梦,杨代勤
(长江大学动物科学学院,湖北省黄鳝工程技术研究中心,湖北 荆州 434025)
黄鳝(Monopterusalbus)是广泛分布于我国南北水域的一种名优养殖品种,随着养殖密度的加大造成水体环境的恶化等因素引起的各种病害严重制约其规模化养殖。鱼类消化道是病原入侵机体的门户之一,而肠道内覆盖在肠黏膜上的正常菌群是肠道防御外源致病菌入侵的天然屏障[1]。肠道中微生物的种类、数量等会随着鱼类的生长阶段、生理状态、生活环境及饵料组成等变化而处于动态变化之中[2-4]。一般情况下,鱼类肠道内条件致病菌数量最多,益生菌次之,致病菌最少,细菌的种类及数量在一定程度上影响鱼类肠道健康甚至机体健康。当外界条件(水质、饵料等)改变时,可能引起鱼类不同程度的应激反应,肠道内的条件致病菌异常生长,由共栖菌转为致病菌,导致菌群失调甚至爆发疾病,毒害鱼体健康[5,6]。
抗菌肽(antimicrobial peptides,AMPs)是一类在生物体内广泛存在,具有抗菌作用的小分子多肽的总称,包括天蚕素(cecropins)、防御素(defensins)、蛙皮素(magainins)、蜂毒素(melitins)和细菌素(bacteriocin)等不同类型。抗菌肽作为机体天然免疫防御系统的重要组成部分,对细菌、真菌、病毒、寄生虫、肿瘤细胞等均具有抑制作用,同时对生物体的自身细胞无破坏性,无免疫原性,是生物体用来抵制病原微生物入侵的重要屏障[7,8]。体内和体外抑菌试验均表明,抗菌肽对常见的多种病原菌均具有抑制作用,能显著降低病原菌的数量,维持养殖水环境和肠道的微生态平衡[9]。
目前已用于鱼类饲料添加剂的抗菌肽包括天蚕素抗菌肽、Surfactin抗菌肽以及水产动物重组抗菌肽等。凡纳滨对虾(Litopenaeusvannamei)[10]、中华绒螯蟹(Eriocheirsinensis)[11]、鲤(Cyprinuscarpio)[12]、罗非鱼(Oreochromis)[13-16]、花鲈(Lateolabraxmaculatus)[17]、黑鲷(Sparusmacrocephlus)[18]、石斑鱼(Epinephelus)[19,20]等水产动物摄食抗菌肽可提高其生长性能、抗氧化能力和免疫能力。本实验在黄鳝饵料中添加不同水平的抗菌肽(基因工程产品),通过研究其对黄鳝肠道好氧和兼性厌氧细菌种类、数量的影响,为黄鳝养殖和病害防治提供参考依据。
1 材料与方法
1.1 试验设计与饲养管理
试验用黄鳝,来自长江大学黄鳝养殖基地。暂养两周后,将体格健壮,均重为(30±5)g的黄鳝随机分为5组(对照组、组Ⅰ、组Ⅱ、组Ⅲ、组Ⅳ),每组3个重复,每个重复60尾。从2018年7月20日—9月28日每天18 ∶00投喂一次,对照组投喂基础饵料,试验组分别投喂基础饵料+200 mg/kg抗菌肽、基础饵料+400 mg/kg抗菌肽、基础饵料+600 mg/kg抗菌肽、基础饵料+800 mg/kg抗菌肽,日投饵量占黄鳝体重7%~11%。基础饵料为70%冰蚯蚓+30%黄鳝颗粒饲料,抗菌肽为深圳市圣西马生物技术有限公司提供,商品名:太轻松W。
1.2 样品采集及计数
试验结束禁食后每组取3尾黄鳝,先用蒸馏水冲洗鱼体表面,拭干,再用酒精棉球擦拭鱼体表面消毒。在超净工作台内用灭菌解剖工具打开试验鱼腹腔取出肠道,用磷酸盐缓冲液PBS pH=7.2冲洗肠道去除肠道内容物。将每组所取的3尾黄鳝的肠道混合,冰浴中匀浆,称量混合匀浆液0.5 g,加入4.5 mL灭菌生理盐水,制成肠道原液,然后进行梯度稀释至10-7。取10-5、10-6、10-7三个梯度的稀释液各100 μL,涂布于营养琼脂平板,每个梯度做3个平行,然后将涂布好的平板置于28 ℃恒温生化培养箱培养24 h。选取细菌生长疏密适当,菌落清晰,分散良好并且菌落数在30~300个的平板计数。将菌悬液浓度CFU/mL换算成每克肠道所含细菌的数量CFU/g,用IBM SPSS Statistics进行单因素方差分析。
1.3 肠道细菌鉴定
观察记录平板上的菌落特征,随机挑取50个左右单菌落作为待测菌株,纯化后接种在营养斜面上,28 ℃培养24 h后,置于4 ℃备用。针对肠道好氧和兼性厌氧细菌参照《伯杰细菌鉴定手册》(第八版)[21]按照以下步骤进行鉴定:①待测菌株进行革兰氏染色,结合镜检将细菌分成革兰氏阳性球菌、阳性杆菌、阴性球菌及阴性杆菌;②用玻璃棒蘸取菌苔与玻片上3% H2O2反应,立即产生气泡者为阳性,反之为阴性;③用1%四甲基对苯二胺试剂湿润的滤纸蘸取菌苔,观察颜色变化,10 s内出现红色者阳性,反之为阴性;④穿刺接种半固体营养琼脂进行细菌动力试验,培养后细菌在穿刺线周围有扩散生长者为阳性,反之为阴性;⑤将待测菌同时接种两支HL(Hugh-Leifson)葡萄糖培养基,一支滴加无菌液体石蜡,培养后两支培养基均无变化者为产碱型(-),两支培养基均产酸者为发酵型(F),仅不加石蜡的培养基产酸者为氧化型(O)。
1.4 多样性分析
根据菌株鉴定结果,以各类细菌所占比例及其多样性指数评价不同抗菌肽添加水平对肠道菌群结构的影响。
计算公式:
各类细菌在菌群中所占比例:Pi=Ni/N;
Shannon-Wiener指数:H′=-∑PilnPi
Simpson指数:D=1-∑(Pi)2
式中,Pi为第i类细菌在菌群中所占比例,Ni为第i类细菌的个体数目,N是肠道中全部细菌种类的总个体数。
2 结果
2.1 抗菌肽对肠道细菌总数的影响
采用平板菌落计数法对各组黄鳝肠道好氧和兼性厌氧菌进行计数,结果见表1。对照组细菌总数最多为(3.80±1.95)×107CFU/g,组Ⅲ细菌总数最少为(3.00±1.66)×107CFU/g,单因素方差分析表明各组肠道细菌总数无显著性差异。

表1 饲料中添加抗菌肽对黄鳝肠道细菌总数的影响Tab.1 Effects of dietary antimicrobial peptide supplementation on the total number of intestinal microflora of M.albus 107 CFU/g
2.2 肠道菌群鉴定
对黄鳝各组随机分离纯化50个左右菌落进行鉴定,如图1所示,各组黄鳝肠道中鉴定出好氧和兼性厌氧菌共14类。通过革兰氏染色结合镜检,将分离纯化菌株分成阳性球菌、阳性杆菌、阴性球菌和阴性杆菌。对革兰氏阳性球菌进行动力试验,阳性者为动性球菌属(Planococcus)。阳性球菌无动力细菌进行接触酶试验,阴性者为链球菌属(Streptococcus);接触酶阳性者进行氧化发酵试验,发酵型为葡萄球菌属(Staphylococcus),其他为微球菌属(Micrococcus)。革兰氏染色阳性杆菌进行动力试验,无动力者为棒杆菌属(Corynebacterium)。阳性杆菌中有动力细菌进行氧化酶试验,阳性者为芽孢杆菌属(Bacillus),阴性者为乳杆菌属(Lactobacillus)。革兰氏染色为阴性球菌者为奈瑟菌属(Neisseria)。而革兰氏染色阴性杆菌是待测菌株中最多的类型。发酵型阴性杆菌进行氧化酶试验,阳性者为气单胞菌属(Aeromonas),阴性者为肠杆菌科(Enterobacteriaceae)。其他阴性杆菌进行动力试验,有运动性且为氧化型者为假单胞菌属(Pseudomonas),有运动性为产碱型者为产碱菌属(Alcaligenes);无运动性且氧化酶阳性者为黄杆菌属(Flavobacterium),阴性者为不动杆菌属(Acinetobacter)。
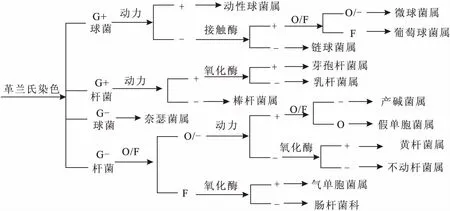
图1 肠道好氧及兼性厌氧菌鉴定结果Fig.1 Identification of isolated aerobic and facultative anaerobic strains from the intestinal
2.3 抗菌肽对肠道菌群组成的影响
各组分离纯化的细菌的类型及各类细菌所占的比例如图2。从图中可见,对照组黄鳝肠道中以肠杆菌科(未分属)、气单胞菌属、假单胞菌属、黄杆菌属4类革兰氏阴性菌为主,其含量分别为23.2%、14.3%、12.5%、14.3%,共占所有细菌的64.3%。与对照组相比,饲料中添加不同含量的抗菌肽均能降低肠道中肠杆菌科和黄杆菌属细菌所占比例。肠杆菌科细菌在组Ⅰ~组Ⅳ中所占比例分别为18.5%、20.8%、17.6%、22.0%,黄杆菌属细菌的所占比例分别为9.3%、9.4%、2.0%、4.0%。而气单胞菌属细菌在组Ⅰ和组Ⅳ中所占比例高于对照组,在组Ⅱ中所占比例最低为11.3%;假单胞菌仅在组Ⅲ中的所占比例低于对照组,为11.8%。肠道中除革兰氏阴性杆菌外,革兰氏阳性芽孢杆菌也在各组中所占比例较高,在对照组和各处理组中均为10%左右;而另一种革兰氏阳性杆菌乳酸杆菌的含量在抗菌肽添加组的含量均比对照组高,在组Ⅲ中最高为13.7%。除杆菌之外,各组还分离鉴定出部分球菌,各类球菌在肠道中所占比例在10.7%~16.7%之间,在组Ⅰ中含量最高,在对照组中最低。
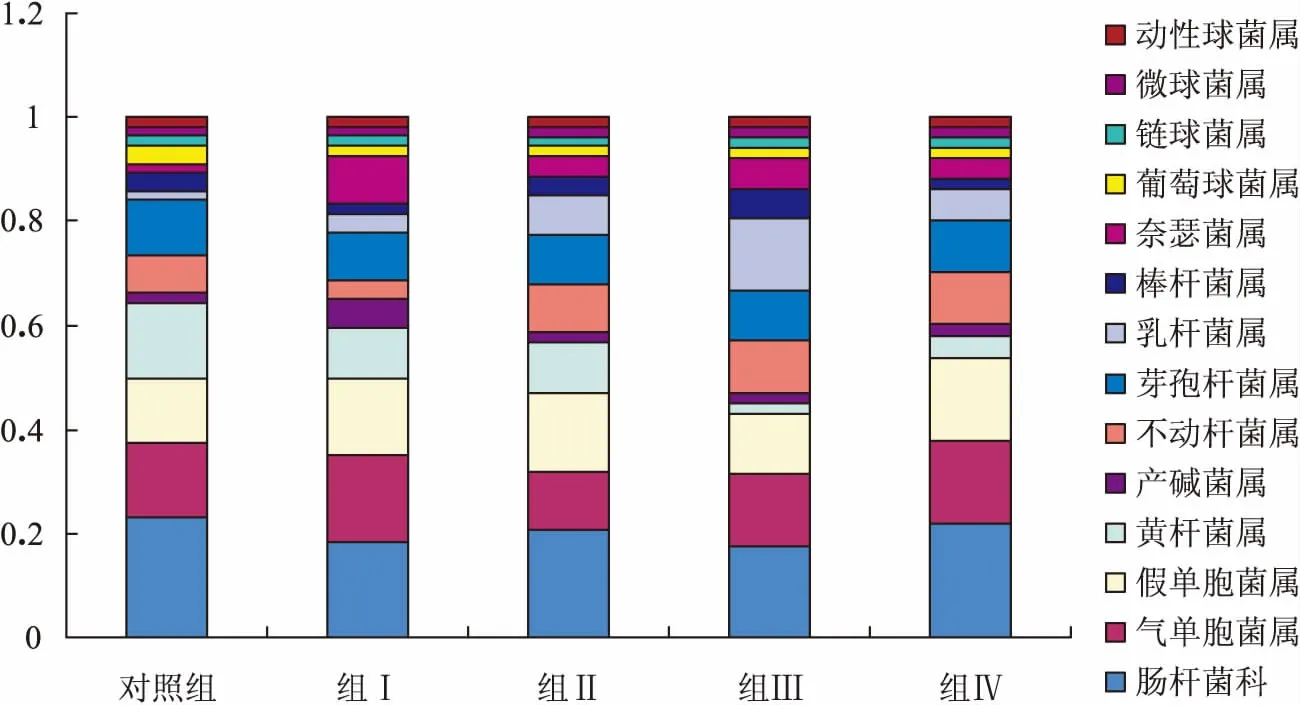
图2 饲料中添加抗菌肽对黄鳝肠道菌群组成的影响Fig.2 Effects of dietary antimicrobial peptide supplementation on the proportion of intestinal microflora of M.albus
黄鳝肠道中的优势菌群中革兰氏阴性杆菌肠杆菌科、气单胞菌属、假单胞菌属、黄杆菌属细菌是鱼类的主要条件致病菌,而革兰氏阳性杆菌芽孢杆菌属和乳酸杆菌属细菌则是肠道中的主要益生菌。对其肠道中主要条件病原菌(肠杆菌科、黄杆菌属、假单胞菌属、气单胞菌属4类细菌所占比例总和)和益生菌(芽孢杆菌属和乳酸杆菌属2类细菌所占比例总和)进行分类比较,如图3所示:随着抗菌肽添加浓度的升高,肠道中条件病原菌的含量呈现先降后升的趋势,而益生菌则呈现先升后降的趋势。其中组Ⅲ(600 mg/kg)条件病原菌所占最低,比对照组64.3%下降10.2%;而益生菌所占比例最高,比对照组高出11.0%。随着抗菌肽的添加量达到800 mg/kg时,黄鳝肠道中的条件病原菌的比例表现出上升的趋势,其所占比例达到58.0%,高于组Ⅲ和组Ⅱ(400 mg/kg)中的比例;同时其益生菌的比例出现下降的趋势,由组Ⅲ中23.5%的比例下降到16.0%。
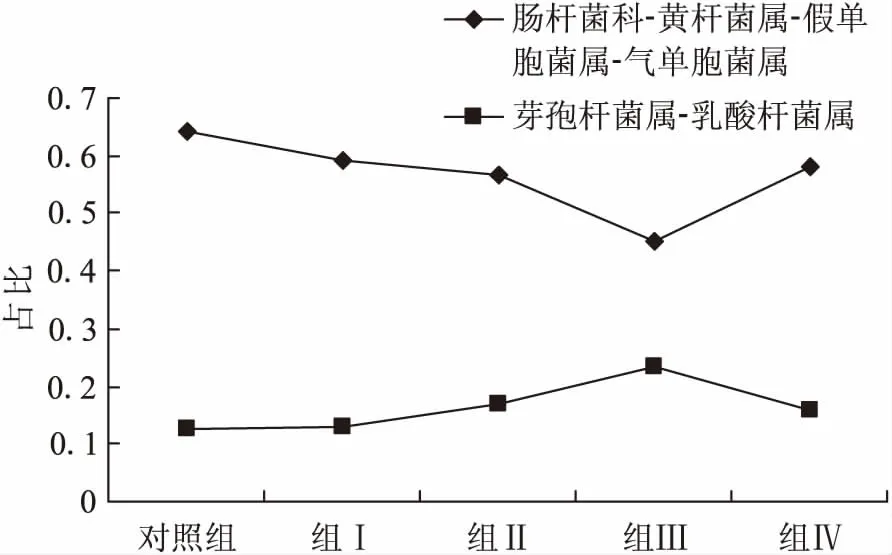
图3 饲料中添加抗菌肽对黄鳝肠道优势菌群组成的影响Fig.3 Effects of dietary antimicrobial peptide supplementation on the proportion of dominant intestinal microflora of M.albus
2.4 抗菌肽对肠道菌群多样性的影响
抗菌肽不同添加水平处理组的肠道菌群多样性显示(图4):随着抗菌肽添加量的增加,Shammon-Wiener多样性指数(H′)和Simpson多样性指数(D)均呈现出先升后降的趋势。组Ⅰ、组Ⅱ、组Ⅲ的细菌多样性指数均显著高于对照组和组Ⅳ。其中组Ⅲ的多样性指数最高,分别为H′ 2.35、D0.89。对照组肠道菌群多样性指数最低,分别为H′ 2.25、D0.87。
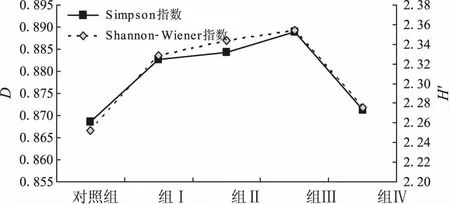
图4 饲料中添加抗菌肽对黄鳝肠道菌群多样性的影响Fig.4 Effects of dietary antimicrobial peptide supplementation on the diversity of intestinal microflora of M.albus
3 讨论
动物肠道菌群是按一定的比例组合,菌群间互相制约,互相依存,构建的一个复杂的微生物生态系统[1]。抗菌肽具有广谱抗菌性,体内外试验表明其对常见的多种病原菌具有抑制作用[22]。如饲料中添加基因工程抗菌肽Pc-pchc能降低黑鲷肠道内梭菌纲的相对丰度[18],天蚕素抗菌肽能降低斜带石斑鱼肠道内条件致病菌弧菌的数量[19],在一定程度上抑制肠道有害菌。翟少伟等[15]研究表明饲料中添加不同含量Surfactin抗菌肽对吉富罗非鱼肠道可培养细菌总数无显著性影响;苏保元[19]研究表明饲料中添加天蚕素抗菌肽对斜带石斑鱼肠道细菌总数无显著影响;本研究同样发现饲料中添加抗菌肽对黄鳝肠道细菌总数无显著性影响。相较于对肠道细菌总数的影响,抗菌肽作为饲料添加剂进入肠道可塑造和控制肠道菌群的组成,在降低肠道病原菌的同时增加益生菌的数量。如Surfactin抗菌肽能降低吉富罗非鱼肠道致病性大肠杆菌[15]、斜带石斑鱼肠道中条件致病菌弧菌的数量[19],同时增加乳酸菌的数量。本研究结果表明饲料中添加600 mg/kg基因工程抗菌肽,黄鳝肠道中肠杆菌科、黄杆菌属、气单胞菌属和假单胞菌属4类条件致病菌合占比例最低为45.1%,比对照组下降10.2%;而肠道益生菌乳杆菌属所占比例由对照组的1.8%达到13.7%,且各抗菌肽添加组乳杆菌属占比均比对照组高。肠道中致病菌和益生菌数量的变化表现为:致病菌数量的降低增加了肠道正常菌群和益生菌的营养物质和生存繁殖空间,从而改善肠道微环境。
肠道菌群多样性的差异与饲料成分密切相关。郝耀彤等[23]对草鱼饲喂苏丹草,微生物多样性指数显示后肠样品Shannon指数H′一般不低于4.25,而前、中肠样品H′均未超过 4.25;而饲喂人工饲养草鱼后肠多样性指数不低于4.95。本研究中随着抗菌肽添加量的增加,黄鳝肠道菌群Shammon-Wiener多样性指数和Simpson多样性指数均呈现出先升后降的趋势。组Ⅰ、组Ⅱ、组Ⅲ的多样性指数均显著高于对照组和组Ⅳ。可见,在饲料中适量添加抗菌肽能提高肠道菌群的多样性水平,改善肠道的微环境。 本研究同样发现,在抗菌肽添加剂量达到800 mg/kg时,肠杆菌科、黄杆菌属、气单胞菌属和假单胞菌属等条件致病菌所占比例达到58.0%,超过了组Ⅱ(400 mg/kg,56.6%)和组Ⅲ(600 mg/kg,45.1%)中这4类细菌所占的比例;而乳杆菌属所占比例为6.0%,虽然高于对照组1.8%和组Ⅰ(200 mg/kg)的3.7%,但是低于组Ⅱ的7.5%和组Ⅲ的13.7%。同时抗菌肽添加剂量达到800 mg/kg时,多样性指数H′从2.35下降到2.28,D从0.89下降到0.87。可见,饲料中添加抗菌肽对肠道有益菌和致病菌的数量及菌群多样性水平的调控与抗菌肽的剂量有关。抗菌肽的种类和饲喂鱼类都影响抗菌肽在饲料中的添加量,如Surfactin抗菌肽在吉富罗非鱼中的添加量超过50 mg/kg[15],在花鳗鲡中超过25 mg /kg[24],在斜带石斑鱼中超过100 mg/kg[25];家蝇抗菌肽在黄颡鱼中超过0.2%[26],重组中国明对虾抗菌肽在罗非鱼中超过50 mg/kg[27],天蚕素抗菌肽在建鲤中超过600 mg/kg时[28],对鱼类的生长有一定的抑制作用。
综上所述,黄鳝基础饲料中添加适量的抗菌肽具有调节黄鳝肠道菌群结构的效果。本试验的基础饲料中添加600 mg/kg抗菌肽投喂黄鳝后,较200 mg/kg和400 mg/kg剂量添加组其肠道中条件致病菌的组成比例最低,有益菌的组成比例最高,其菌群多样性水平也最高。但抗菌肽添加剂量达到800 mg/kg时,其相关指标如条件致病菌的组成比例有所增加,有益菌的组成比例下降,菌群多样性水平下降。因此,本试验条件下,基础饲料(70%冰蚯蚓+30%黄鳝颗粒饲料)中添加600 mg/kg抗菌肽饲喂黄鳝后,对其肠道菌群结构有较好的改善作用。
