三叶木通离体培养和多倍体诱导
2020-07-27姜放军陶抵辉
姜放军,陶抵辉
(湖南生物机电职业技术学院,湖南长沙410127)
三叶木通(Akebia trifoliate)为落叶木质藤本,在湖南省主要分布于湘西武陵山和雪峰山地区及湘东罗霄山脉地区,湘中、湘南、湘北也有少数分布[1]。三叶木通具有美容养颜、保健、清理体内垃圾、提高免疫力等奇特功效[2],是一种潜力很大的保健水果。三叶木通果实目前以野生果为主,因其国内外市场蕴含着巨大潜力,野生果的产量在当地已供不应求。在农业产业结构调整和构建和谐社会的省情下,结合农业可持续发展,三叶木通作为一项高效农业种植项目将受到社会关注。
三叶木通长期野生尚未开发的主要原因是籽多、皮厚、鲜食率低。已有研究资料表明,野生三叶木通为二倍体,染色体数是16[3]。三倍体无籽西瓜的成功研究[4]和生产上大面积推广应用具有示范作用。野生三叶木通若用人工加倍的方法育成三倍体植株,籽多、皮厚、鲜食率低的缺陷能有很大程度上的改进,从而提高商品质量。该试验旨在以三叶木通带芽茎段为外植体,构建三叶木通离体快繁体系,再用秋水仙素溶液对增殖芽诱导,获得多倍体材料,为三叶木通的种质创新及三倍体三叶木通品种的选育奠定基础和技术支持。
1 材料与方法
1.1 试验材料
试验材料三叶木通采自湖南生物机电职业技术学院藤本植物资源圃。选取当年生健壮无病虫害、半木质化的三叶木通茎段,现采现用。
1.2 试验方法
1.2.1 外植体处理与消毒。将采集的茎段去除叶片后,先用适量的洗洁精水浸泡5 min,再用自来水流水冲洗20 min。材料沥干自来水后置于超净工作台中,然后用75%酒精消毒 30 s,无菌水冲洗 1 次,0.1% HgCl2消毒 10 min,无菌水冲洗5 次,沥干水备用。将消毒好的茎段分割成1.0~1.5 cm长的单芽茎段接种到培养基(添加蔗糖30 g/L、琼脂7.5 g/L,pH 5.8~6.0,下同)中。
1.2.2 腋芽诱导培养。选用WPM 和MS 基本培养基,并分别添加 2.0 mg/L 6-BA,0.2 mg/L NAA,2.0 mg/L GA3。每个培养瓶接种3 个外植体,培养基配方每个组合接种10个培养瓶,培养30 d 后统计腋芽诱导情况,筛选出适宜的培养基。
最适基本培养基确定好后,将消毒的单芽茎段接种在含 6-BA(0、1.0、2.0 mg/L)、NAA(0、0.1、0.5 mg/L)和 GA3(0、1.0、2.0 mg/L)的 WPM 培养基中进行腋芽诱导,1 000 lx光照条件下培养。培养30 d 后统计腋芽诱导率,每个处理接种30 个培养瓶,每个培养瓶接种3 个外植体。腋芽诱导率=(萌芽的外植体数/接种外植体总数)×100%。
1.2.3 继代增殖培养。将初代培养的腋芽切下后转接到含 6-BA(0、1.0、2.0、3.0 mg/L)、NAA(0、0.2 mg/L)的 WPM培养基中,每个处理接种30 个培养瓶,每瓶接种2 个不定芽,温度(25±2)℃,1 000 lx 光照条件下培养,40 d 后统计增殖系数。増殖系数=增殖后获得的芽数/接种时的芽数。
1.2.4 生根培养。待丛生芽长到2~3 cm 时,切取生长健壮的芽苗接种在 1/2 MS 含 NAA(0、1.0、2.0 mg/L)、GA3(0、1.0 mg/L)的培养基中进行生根培养,每个处理接种30个培养瓶,每瓶接种2 个芽,25 d 后统计生根率。生根率=(生根的芽总数/接种芽总数)×100%。
1.2.5 多倍体诱导及鉴定。将生长良好的幼嫩丛生芽接入抽滤灭菌的秋水仙素溶液(0.1%、0.3%、0.5%)中,摇床振荡培养(12、24、48 h),摇床转速为 50 r/min,培养温度为25℃,光照(1 000 lx)24 h/d,处理后用无菌水清洗药液,然后接种到最佳增殖培养基上培养。培养条件同上。
鉴定方法采用染色体计数方法,取丛生芽→预处理(对二氯苯+α-溴萘饱和溶液)5~6 h→固定(甲醇∶冰醋酸=3∶1)2 h 以上→70%酒精保存→去离子水清洗→解离(1 mol/L 盐酸,在60℃下)12 min→去离子水清洗→染色(卡宝品红常规)3~5 min →压片(十字压片法)→镜检、鉴定。根据染色体数确定加倍处理材料的倍性。
2 结果与分析
2.1 基本培养基对三叶木通腋芽诱导率的影响
用WPM 和MS 2 种培养基进行三叶木通腋芽诱导,由表1 可知,WPM 培养基的腋芽诱导率明显高于MS 培养基的诱导率,下面的腋芽诱导和继代增殖培养均选用WPS 培养基。

表1 基本培养基对三叶木通腋芽诱导率的影响
2.2 不同植物生长调节剂对三叶木通腋芽诱导的影响
由表2 可知,不添加任何植物生长调节剂组(A1)不能使三叶木通腋芽萌发,当6-BA 浓度为0 mg/L 时,添加NAA 和GA3少数三叶木通茎段萌发腋芽,且有部分茎段基部愈伤化;当6-BA 浓度为1.0 mg/L,NAA 浓度为0.1 mg/L,GA3浓度为2.0 mg/L 时,三叶木通腋芽长势较好,诱导率达75.12%。随着6-BA 浓度升高,三叶木通腋芽诱导率呈下降趋势,添加NAA 浓度为0.5 mg/L 的处理组均有部分愈伤化,可能是NAA 浓度添加过高而导致,从而抑制腋芽的萌发。在7 个三叶木通腋芽诱导培养基处理组中,最适宜的诱导培养基为WPM+1.0 mg/L 6-BA+0.1 mg/L NAA+2.0 mg/L GA3。

表2 不同植物生长调节剂对三叶木通腋芽诱导率的影响
2.3 不同植物生长调节剂对三叶木通不定芽增殖系数的影响
三叶木通继代增殖培养过程中添加了不同浓度的6-BA 和NAA,共设置了8 个培养基处理组。由表3 可知,在不添加6-BA 的处理组中,三叶木通不定芽没有呈现增殖生长现象;在添加6-BA 的处理组中,随着6-BA 的浓度升高,增殖系数呈上升趋势,当6-BA 浓度为3.0 mg/L 时增殖系数最高,说明细胞分裂素6-BA 在三叶木通不定芽增殖中起主导作用,同时低浓度NAA 起到辅助作用。在8个三叶木通继代增殖培养基处理组中,最适宜的继代培养基为WPM+3.0 mg/L 6-BA+0.2 mg/L NAA。

表3 不同植物生长调节剂对三叶木通不定芽增殖系数的影响
2.4 不同植物生长调节剂对三叶木通不定芽生根率的影响
三叶木通生根培养25 d 后不定芽有根系生长,在不同的处理组中,不定芽生根情况有差异。由表4 可知,不添加NAA 处理组不能使三叶木通生根;添加NAA 的处理组均有根系生长,当NAA 浓度为1.0 mg/L、GA3浓度为 1.0 mg/L 时,根系生长较好,生根率高,而NAA 浓度为0.2 mg/L 处理组有根系生长,但出现部分愈伤化。结果表明细胞生长素NAA 在三叶木通生根诱导中起主导作用,同时GA3起到促进作用,但高浓度的NAA 会促使芽愈伤化,降低生根率。最适宜的生根培养基为1/2 MS+1.0 mg/L NAA+1.0 mg/L GA3。
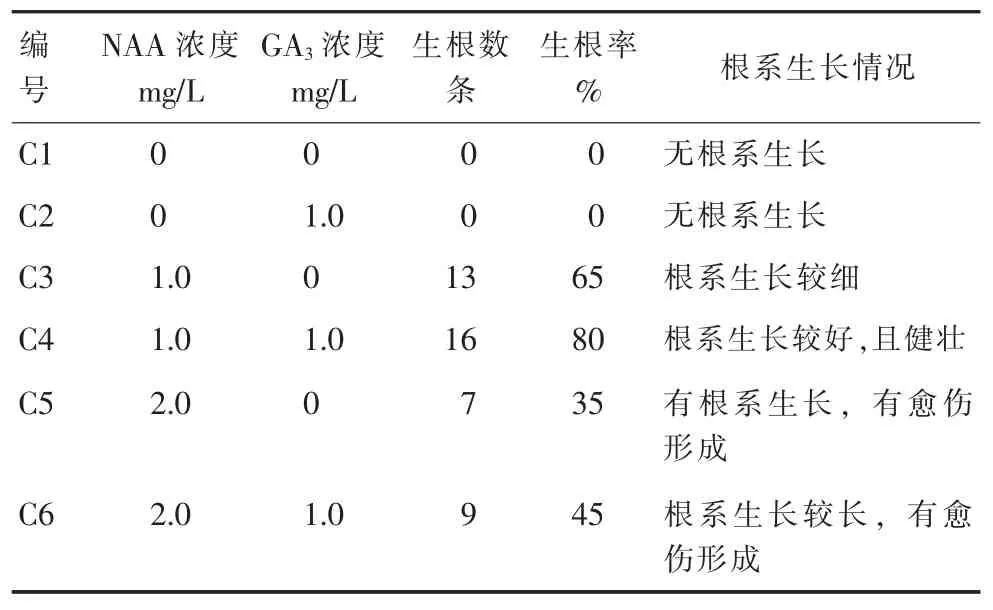
表4 不同植物生长调节剂对三叶木通不定芽生根率的影响
2.5 秋水仙碱对三叶木通不定芽多倍体诱导的影响
采取秋水仙碱溶液直接浸泡方式对三叶木通多倍体诱导,并通过染色体直接计数。由表5 可知,三叶木通丛生芽用3 种不同浓度的秋水仙碱溶液浸泡12 h,均没有获得加倍体,浸泡延长至24 h 时,0.3%、0.5%秋水仙碱溶液均能诱导加倍体,但0.3%秋水仙碱溶液诱导效果好,诱导率为15%,浸泡再次延长至48 h 时,只有0.3%秋水仙碱溶液能诱导多倍体,且诱导效果较浸泡24 h 处理组的诱导效果差。不同浓度秋水仙碱在同一处理时间诱导率并没有随着浓度的变化而呈现诱导率上升的趋势,其原因可能是高浓度的秋水仙素对丛生芽的伤害大,使得存活下来的丛生芽数减少,并且生活力下降,从而使检测到加倍的丛生芽块数相应很少。

表5 秋水仙碱对三叶木通不定芽多倍体诱导的影响
3 讨论
三叶木通在WPM 培养基比MS 培养基中腋芽诱导率高,这与吴玲利等在白木通茎段腋芽诱导[5]中的研究结果相一致。腋芽诱导培养基采用6-BA、NAA 和GA3激素组合,在同一浓度的条件下加入GA3和不加入GA3诱导效果不一样,表明GA3在初代腋芽生长中起到促进作用,这与岑忠用等在木薯腋芽萌发诱导的研究[6]结果相一致,同时,在三叶木通初代培养时,NAA 浓度为0.5 mg/L 时有茎段基部出现愈伤化,可用IBA 代替NAA 做进一步研究。
继代增殖培养是组培离体快繁的关键,找到适宜的增殖培养基配方,才能达到组培快速繁殖的目的。在继代增殖培养过程中,6-BA 和NAA 是常用的激素组合[7]。在三叶木通腋芽增殖培养试验中发现,单独使用NAA 不能使腋芽增殖;单独使用6-BA 腋芽能增殖,但生长较弱,说明6-BA 在增殖培养中起主导作用;一定浓度6-BA 和NAA组合使用增殖效果好,且随着6-BA 的浓度增高增殖系数升高,这与姜傲芳等在薜荔中的研究[8]结果相一致。三叶木通生根培养选用1/2 MS 培养基,发现试管苗的生根效果更好,说明降低无机盐的浓度更有利于根的诱导,这与罗士伟等在无籽西瓜生根试验[9]中的结果相一致。
三叶木通染色体加倍是种质创新的主要途径之一,陶抵辉等指出染色体加倍方法有形态鉴定、细胞学鉴定、染色体记数、分子水平的鉴定等[10],熊大胜等用秋水仙素浸泡三叶木通根发现混倍性明显,四倍性细胞只占31.7%~37.9%[11]。该试验发现用0.3%秋水仙碱浸泡无菌试管苗24 h 能获得四倍体丛生芽块,虽然丛生芽诱导率低,但凭借其快速增殖的优势,能获得大量加倍丛生芽。对于同一材料,染色体加倍概率通常随处理强度的增大而增大,但同时秋水仙素对细胞伤害增大,死亡率提高,因此,选择合适的浓度和处理时间至关重要。该研究以三叶木通带芽茎段为外植体,构建三叶木通离体快繁体系,进行三叶木通多倍体诱导和鉴定,为三叶木通的种质创新和三叶木通品种的选育奠定了基础和技术支持。
